经典型热射病大鼠恢复期体温变化与预后的关系
2013-08-08刘亚楠耿焱付炜彭娜古正涛苏磊
刘亚楠,耿焱,付炜,彭娜,古正涛,苏磊
经典型热射病大鼠恢复期体温变化与预后的关系
刘亚楠,耿焱,付炜,彭娜,古正涛,苏磊
目的构建经典型热射病(HS)大鼠模型,观察恢复期核心体温的调节特征,并分析其与预后的关系。方法雄性SPF级SD大鼠60只随机分为HS组(n=50)和正常对照组(n=10)。HS组大鼠予39℃热打击,监测核心体温及动脉收缩压(SBP)变化,达到HS诊断标准后结束热打击,观察72h恢复期核心体温的变化特征及生存情况,并对预后因素进行单因素和多因素Cox回归分析。结果HS组大鼠在热打击后恢复期表现为双相式变化,即发生低体温和迟发性高热。单因素分析显示,HS大鼠最高核心体温、最低核心体温均与预后相关(P<0.05)。多因素分析显示,HS大鼠最高核心体温(P=0.000,HR=102.386)、恢复期最低核心体温(P=0.001,HR=0.134)为影响HS大鼠预后的独立危险因素。结论大鼠达到HS时核心体温越高,其发生低体温的程度越深,预后越差。热应激期和恢复期核心体温水平可作为HS大鼠预后的敏感指标。
中暑;体温调节;预后
热射病(heat stroke,HS)是中暑最严重的状态,常合并多器官功能衰竭(MODS),死亡率高,但其发病机制目前尚不清楚[1-3]。以往关于中暑的研究都以达到预设的核心温度为中暑发生,或对麻醉大鼠进行有创血压测量,以热打击时血压下降这一点来界定中暑发生,但这些实验设计均存在混淆因素,不能正确地反映自然清醒状态下HS大鼠核心体温的调节特征[4]。本研究在大鼠无麻醉的情况下,采用无创血压检测系统进行监测,以血压下降作为HS诊断标准,并对其恢复期体温进行监测,旨在探讨重症HS大鼠恢复期的体温变化及其对预后的影响。
1 材料与方法
1.1 主要设备 模拟热气候动物舱(南方医科大学公共卫生与热带卫生学学院提供),BW-NIBP型电子无创大鼠鼠尾动脉血压分析系统(上海软隆科技发展有限公司),Powlalr 8sp生理记录仪(澳大利亚Adinstruments公司)。
1.2 方法
1.2.1 实验动物及分组 SPF级雄性SD大鼠60只,体重220~300g,于南方医院实验动物中心饲养2周左右,环境温度23℃,湿度55%±5%,12h昼/夜循环。实验大鼠随机分为2组,分别为:正常对照组(C组)10只,HS组50只。C组和HS组大鼠均在实验前接受2周无创血压测量适应性训练,频率为2次/d。
1.2.2 无创血压测量 参照说明书利用大鼠鼠尾动脉血压测量仪测量收缩压(SBP)。方法:在实验过程中每10min测量1次,直至达到HS标准(动脉收缩压从峰值开始下降[5])后停止测量,对照组大鼠在室温23℃下测量,测量时间与HS组一致。
1.2.3 核心体温测量方法 用生理记录仪的热电偶测量各组大鼠直肠温度(Tc),以Tc代表核心体温。
1.2.4 热打击方法及监测指标 热打击前将高温舱预热至30℃,热打击前30min内(time –30、–20和–10min)测量3次核心体温及SBP。热打击方法:将HS组大鼠置于预热到30℃的仿真热气候动物舱(time 0min),于30min内将舱内温度升至39℃,湿度65%。HS组大鼠每10min连接一次无创血压测量系统和直肠热电偶,记录SBP和Tc。大鼠达到HS诊断标准后从气候舱中取出。实验期间各组大鼠均禁食、水,C组大鼠全程置于23℃环境中。
1.2.5 恢复期处理方法 将两组大鼠称重,接受20min酒精擦浴全身降温治疗后,恢复进食、水,在恢复过程中继续给予体温监测,每10min记录1次,持续8h后,改为每6h记录1次,3d后终止实验。
1.2.6 热应激计算方法 以热暴露前的核心体温和SBP为基线核心体温和SBP,成模时的核心体温为最大核心体温(Tcmax),以到达最大核心体温的时间代表总热暴露时间。低体温定义为核心体温<35℃(即低于正常大鼠核心体温基线水平1℃的体温);体温最低值(Tcmin)为热打击恢复期最低体温值;热打击后达到体温最低值的时间为从最高核心体温到发生最低体温的时间;低体温的持续时间(HL)为热打击后恢复期大鼠核心体温<35℃的总时间;低体温转换时间(HTT)为从体温最低值回升至35℃的时间;迟发性高热指在热打击恢复过程中,比正常对照组基线水平最高体温高出1℃,在本实验中迟发性高热的体温设定为39℃;发生迟发性高热的时间为从低温转换期结束后到达39℃的时间。总热负荷(℃.min)=核心体温≥39℃的热暴露时间×(最大核心体温-39℃)。核心体温39℃时,已经与热打击环境温度相同,在该温度下大鼠已经无法通过辐射散热。以核心体温≥42℃作为重度热负荷的开始。重度热负荷(℃.min)=核心体温≥42℃的热暴露时间×(最大核心体温-42℃)。本实验恢复期有26只HS大鼠死亡,24只存活,分别列入死亡HS大鼠组(NS-HS组)和存活HS大鼠组(S-HS组)。
1.2.7 大鼠体重丢失情况 在热打击前和到达最大核心体温时立即测量大鼠体重,精确度±0.1g。体重丢失情况采用下述公式进行估算:体重丢失(热打击前体重—最大核心温度时体重)/热打击前体重×100%。
1.3 统计学处理 采用SPSS 13.0软件进行统计分析。计量资料以表示,在方差齐性基础上应用单因素方差分析(one-way ANOVA)比较各组Tcmax、总热暴露时间、达到体温最低值时间、低体温深度、低体温持续时间等的差异;根据上述危险因素建立Cox比例风险模型,分析影响预后的危险因素。P<0.05为差异有统计学意义。
2 结 果
2.1 HS大鼠热应激及恢复期Tc调节特征 如图1所示,在热暴露期间,HS组大鼠核心体温呈三相式上升,表现为初始阶段核心体温快速上升,随后表现为类似于平台的缓升期,缓升期持续较长时间,此后进入快速上升期,直至达到HS诊断标准。热打击开始及结束后的570min内,HS组大鼠核心体温与正常对照组比较差异均有统计学意义(P<0.05)。将大鼠从舱内移出后,S-HS组体温先降低,后出现发热样高体温,NS-HS组大鼠20只发生低体温后维持在27℃,未发生迟发性高热即死亡,6只在恢复期第2天死亡。S-HS和NS-HS两组大鼠到达低体温的时间差异无统计学意义(P>0.05),但其热暴露时间、低体温的深度和低体温持续时间之间差异均有统计学意义(P<0.05,表1)。
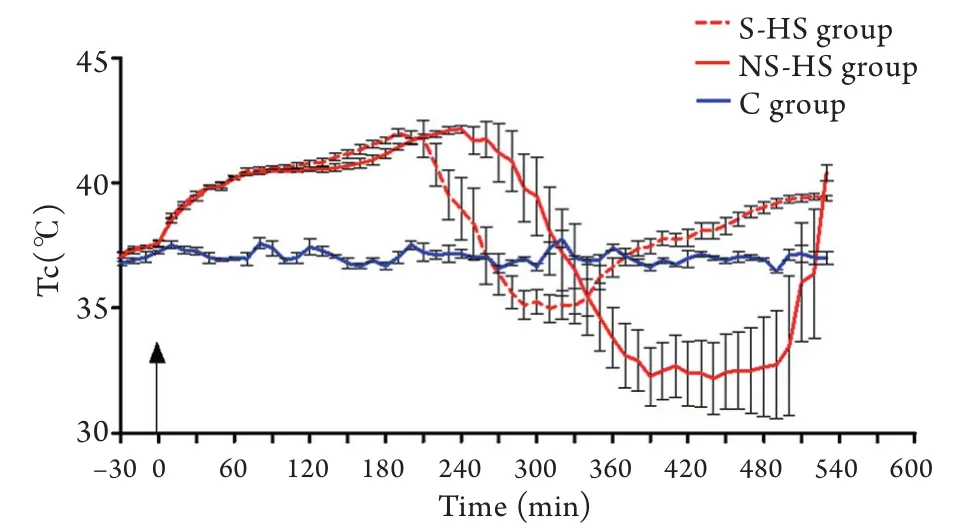
图1 热打击过程中及恢复期核心体温特征Fig.1 Characters of core temperature in heat stress and recovery profile
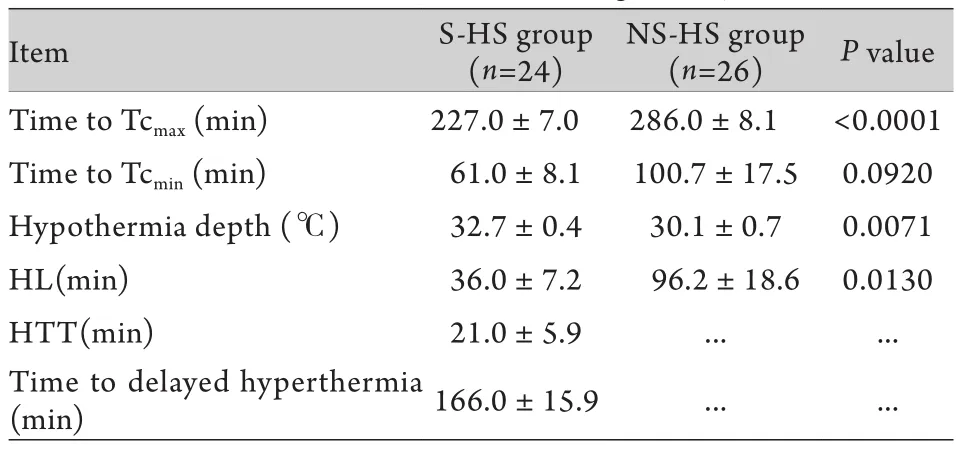
表1 HS大鼠核心体温调节特征Tab.1 Characters of core thermoregulatory of HS rats
2.2 热应激体温调节反应定量分析 如图2所示,S-HS组和NS-HS组大鼠最大核心体温之间差异有统计学意义(P<0.05),S-HS组总热负荷和严重热负荷均显著低于NS-HS组大鼠(P<0.05)。

图2 热应激核心体温调节反应Fig.2 Core thermoregulatory responses of S-HS and NS-HS groups of rats in heat stress
2.3 体重丢失情况 与正常对照组比较,NS-HS组和S-HS组大鼠体重丢失明显,NS-HS组体重丢失占总体重的9.1%,S-HS组占9.8%,而NS-HS组和S-HS组大鼠的体重丢失差异无统计学意义(P>0.05,图3)。
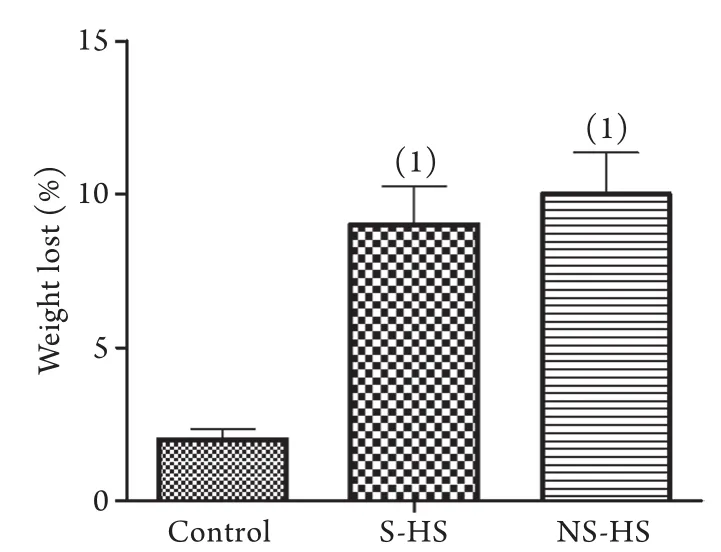
图3 各组大鼠体重丢失情况Fig.3 Body weight loss (dehydration) in each group of rats
2.4 影响HS大鼠预后的因素 将大鼠体重丢失情况、热暴露时间、热负荷、严重热负荷、最高核心体温、最低核心体温、低体温持续时间、低体温转换时间及发生迟发性高热的时间作为协变量,采用向后消除回归并Wald检验进行单因素Cox模型分析,结果显示最高核心体温、最低核心体温的差异具有统计学意义(P<0.05)。将这些可能的危险因素放入Cox比例风险回归模型,采用进入法分析影响HS大鼠预后的危险因素,结果显示,HS大鼠最高核心体温(P=0.000,HR=102.386)、恢复期最低核心体温(P=0.001,HR=0.134)为影响HS大鼠预后的独立危险因素。
3 讨 论
HS为致命性中暑,是一种全身炎症反应综合征(SIRS),其病理生理过程类似于重症脓毒血症[5]。临床对于HS的诊断标准包括核心体温超过41℃,皮肤干热、潮红,同时伴有神经系统功能障碍[1-2,6]。不同于临床,动物实验很难通过上述症状来诊断HS。以往研究已经表明,动脉收缩压从峰值开始下降那一刻已经开始出现中暑或重症中暑的症状,如感觉缺失、肌张力降低和意识丧失等[7],因此在本研究中,HS的诊断以动脉收缩压开始下降为标准。如图1所示,低体温是热应激恢复过程中的主要反应,热诱导的低体温被定义为核心体温降低到基线水平以下的温度。Leon等[4]在中暑小鼠的实验中报道,小鼠在热打击后115min发生低体温,24h后发生迟发性高热。在本研究中大鼠发生低体温和迟发性高热的时间均较以往小鼠的研究提前,可能与动物的种属或实验设计差异有关。但不管实验条件如何,在中暑患者和动物模型及变温动物中均可观察到体温低于正常范围1℃以上的自发性低体温[8]。在本研究中,大鼠达到HS时的核心体温越高,其发生低体温的程度越深,预后越差,提示恢复期的低体温可作为热损伤严重程度的敏感指标。
在中暑小鼠的研究中,体温降低可能是动物从中暑中恢复并存活的重要生理变化[9]。S-HS大鼠恢复期体温的降低和升高可能与体温调定点的调节作用有关,虽然NS-HS组死亡大鼠也发生了自主性低热,但其低体温程度深,仅比室温略高。尽管缺乏下丘脑和中枢神经系统细胞损害的证据,但是NS-HS组体温调节功能出现障碍,不能从自主性低体温中恢复,往往是致命的。HS存在多种并发症,在HS恢复过程中可检测到多种细胞因子升高,有学者认为低体温的发生可能与细胞因子升高有关[10]。
中暑后的发热被称为迟发性高热,这种HS后的体温调节反应提示,迟发性高热是机体应对应激反应的发热,主要由热暴露后的并发症导致,而不是直接由热损伤所致。HS时组织损伤和内毒素血症的存在提示热暴露后的体温升高可能是系统性炎症反应的结果[10]。在本研究中热暴露后6h,S-HS组大鼠出现“发烧”样核心体温升高,NS-HS组中没有从低体温恢复过来或未出现迟发性高热的大鼠都发生了死亡。值得注意的是,在热打击后第2天,6只NS-HS组大鼠在发生迟发性高热后出现死亡,目前还不清楚造成这种类型死亡的具体原因。
S-HS组和NS-HS组大鼠在热打击后发生了8%~10%的脱水,与正常对照组相比明显升高。正常对照组2%的脱水可能是由于在实验中缺少食物和水所致。早前研究报道,脱水、低血糖、组织损伤都是中暑的典型表现[11]。本研究结果表明,脱水与中暑大鼠的预后不相关,由此可见脱水并不是导致动物死亡的主要原因。
综上所述,HS大鼠恢复期可发生低体温和迟发性高热,虽然其发生的机制尚未完全阐明,但对中暑的预后有重要影响。本研究结果提示热应激期和恢复期核心体温水平可作为HS大鼠预后的敏感指标,尤其是低体温,对中暑患者从中暑中恢复并改善生存率有重要的临床指导意义。
[1] Bouchama A, Knochel JP. Heat stroke[J]. N Engl J Med, 2002, 346(25): 1978-1988.
[2] Su L. Review on prevention and treatment of severe heat stroke[J]. Med J Chin PLA, 2011, 36(9): 883-885. [苏磊. 重症中暑防治回顾与启示[J]. 解放军医学杂志, 2011, 36(9): 883-885.]
[3] Su L, Guo ZH, Qian HJ. Epidemiological study and key-point analysis of severe heatstroke patients[J]. Med J Chin PLA, 2006, 31(9): 909-911. [苏磊, 郭振辉, 钱洪津. 重症中暑住院病人流行病学调查与分析[J]. 解放军医学杂志, 2006, 31(9): 909-911.]
[4] Leon LR, DuBose DA, Mason CW. Heat stress induces a biphasic thermoregulatory response in mice[J]. Am J Physiol Regul Integr Comp Physiol, 2005, 288(1): R197-R204.
[5] Ji J, Song Q, Yue H,et al. The protective role of Xuebijing injection to heat stroke in rats[J]. Med J Chin PLA, 2011, 36(6): 578-581. [纪筠, 宋青, 岳慧, 等. 血必净注射液对热射病大鼠保护机制的研究[J]. 解放军医学杂志, 2011, 36(6): 578-581.]
[6] Chen GM, Lu JF, Wang WR,et al. Effect of continuous hemofiltration on internal environment and survival rate of severe heatstroke dogs with shock[J]. Med J Chin PLA, 2011, 36(8): 828-832. [陈光明, 卢金福, 王文睿, 等. 连续性血液滤过对重症中暑休克犬内环境和生存率的影响[J]. 解放军医学杂志, 2011, 36(8): 828-832.]
[7] Shih CJ, Lin MT, Tsai SH. Experimental study on the pathogenesis of heat stroke[J]. J Neurosurg, 1984, 60(6): 1246-1252.
[8] Leon LR. Heat stroke and cytokines[J]. Prog Brain Res, 2007, 162: 481-524.
[9] Leon LR, Gordon CJ, Helwig BG,et al. Helwig, thermoregulatory, behavioral, and metabolic responses to heatstroke in a conscious mouse model[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 299(1): R241-R248.
[10] Leon LR. Hypothermia in systemic inflammation: role of cytokines[J]. Front Biosci, 2004, 9: 1877-1888.
[11] Ibuka N, Fukumura K. Unpredictable deprivation of water increases the probability of torpor in the Syrian hamster[J]. Physiol Behav, 1997, 62(3): 551-556.
Relationship between core temperature change during recovery and prognosis in classic heat stroke rat models
LIU Ya-nan1, GENG Yan1, FU Wei2, PENG Na1, GU Zheng-tao2, SU Lei1*
1Department of ICU, Guangzhou General Hospital of Guangzhou Command, Guangzhou 510010, China
2Graduate Institute, Southern Medical University, Guangzhou 510015, China
*
, E-mail: slei_icu@163.com
This work was supported by the National Natural Science Foundation of China (81071529, 81101406)
ObjectiveTo construct classic heat stroke rat models, and observe the changes of body temperature in the recovery period after heat stress to explore its relationship with prognosis.MethodsSixty male SD rats were randomly divided into heat stroke group (HS group,n=50) and control group (C group,n=10). Rats in HS group were exposed to 39℃ heat stress. Core temperature and systolic blood pressure (SBP) of rats were monitored until it reached diagnostic criteria of heat stroke. The core body temperature and survival were continuously monitored until 72h. The risk factors of survival were analyzed by univariate and multivariate Cox regression analyses.ResultsDuring the recovery, compared with the control group, the body temperature of the HS rats represented a biphasic change that consisted of an initial hypothermia and a delayed hyperthermia. Univariable analysis showed that both the highest and lowest core body temperatures were correlated with prognosis in the heat stroke rats (P<0.05). Multivariate analysis revealed that both the highest core body temperature (P=0.000,HR=102.386) and lowest core body temperature in the recovery period (P=0.001,HR=0.134) were the independent risk factors for heat stroke.ConclusionIn heat stroke rats, the higher the core body temperature and the deeper the depth of hypothermia, the poorer the prognosis. Core body temperature in heat stress and recovery period could serve as prognostic indexes in heat stroke.
heat stroke; body temperature regulation; prognosis
R594.12
A
0577-7402(2013)10-0818-04
10.11855/j.issn.0577-7402.2013.10.007
2013-06-26;
2013-08-30)
(责任编辑:熊晓然)
国家自然科学基金(81071529,81101406)
刘亚楠,硕士研究生。主要从事中暑的基础研究
510010 广州 广州军区广州总医院重症医学科(刘亚楠、耿焱、彭娜、苏磊);510515 广州 南方医科大学研究生学院(付炜、古正涛)
苏磊,E-mail: slei_icu@163.com