低温厌氧氨氧化生物滤池细菌群落沿层分布规律
2013-07-31曾涛涛李冬刘涛邱文新蔡言安许达张杰
曾涛涛,李冬,刘涛,邱文新,蔡言安,许达,张杰,
(1.哈尔滨工业大学 城市水资源与水环境国家重点实验室,黑龙江 哈尔滨,150090;2.北京工业大学 水质科学与水环境恢复工程北京市重点实验室,北京,100124)
厌氧氨氧化工艺(Anaerobic ammonia oxidation,ANAMMOX)是目前最简捷和最经济的生物脱氮途径,是指在厌氧的条件下,以亚硝酸氮为电子受体,氨氮作为电子供体生成氮气的过程[1]。反应式如下:

与传统硝化-反硝化工艺相比,厌氧氨氧化具有需氧量低、运行费用低、污泥产量低和无需外加碳源等优点[2],已成为废水生物脱氮研究中的热点。厌氧氨氧化菌是一群分支很深的浮霉状菌,迄今为止,通过分子生物学检测手段已经在不同地点的人工或天然生态系统中鉴定了 5种不同的“Candidatus”ANAMMOX 菌属,分别为Brocadia,Kuenenia,Jettenia,Anammoxoglobus和Scalindua[3]。氨氧化细菌(AOB)也是通过氧化氨来获取能量的自养菌,有研究发现 AOB能够在厌氧氨氧化反应器内生存[4];Nitrosomonas eutropha菌属AOB能在氧受限的条件下,发生以亚硝酸氮为电子受体的厌氧氨氧化反应[5]。这些报道表明,关于厌氧氨氧化菌与好氧氨氧化菌之间关系的研究有助于提高生物脱氮反应器的性能。目前,关于ANAMMOX工艺的研究主要是针对污泥消化回流液和垃圾渗滤液等高氨氮废水方面,最适温度通常在30~40 ℃之间[6],对较低温度下的厌氧氨氧化报道较少。关于ANAMMOX微生物方面的研究,主要是厌氧氨氧化菌在反应器的富集以及对该菌的分子生物学鉴定,对ANAMMOX反应器不同部位微生物群落分布进行系统研究比较少。本研究中厌氧氨氧化反应温度在 14.9~16.2 ℃之间,用低温厌氧氨氧化表示[7-8]。本文作者通过对低温稳定运行的上流式厌氧氨氧化生物滤池沿层取样,利用扫描电镜(SEM)、变性梯度凝胶电泳技术(DGGE)和克隆测序等方法对细菌、ANAMMOX和AOB群落结构进行系统分析,探索生物滤池微生物群落沿层分布特征,以便为提高反应器效能研究提供便利。
1 材料与方法
1.1 反应器
试验装置为有效容积 45 L的圆柱形密闭有机玻璃生物滤柱,内径185 mm。柱内装填粒径为4~6 mm的火山岩填料,填料高度为190 cm。反应器通过接种厌氧氨氧化污泥启动成功,通过添加硫酸铵与亚硝酸钠配置实验用水,使得-N与的摩尔比(n(-N)∶n(-N))约为 1∶1.31,以符合厌氧氨氧化反应基质比例要求,氨氮质量浓度约为200 mg/L。另外添加1.5%的生活污水A/O(厌氧/好氧)除磷工艺的二级处理出水[9]。采用上向流进水方式,进水pH为7.2,温度为冬季室温(14.9~16.2 ℃),水力停留时间(HRT)为1.2 h,进水总氮负荷为4.8 kg/(m3·d),水力负荷为3.0 m3/(m2·d)。
1.2 生物膜形态观察
在反应器上、中、下3部位分别收集厌氧氨氧化生物膜,按Wang等[10]介绍的方法处理样品,通过扫描电镜 (HITACHI S-4300) 观察生物膜微观结构。
1.3 变性凝胶梯度电泳
1.3.1 总DNA提取
在反应器上、中、下3部位各取200 mL含红色污泥的生物膜水样,于转速为12 000 r/min、温度为4℃的条件下离心10 min,收集沉淀。沉淀加入10 mL,浓度为0.1 mol/L的PBS (pH8.0)重悬2次。参考Zhou等[11]给出的细菌总DNA提取方法提取细菌总DNA。
1.3.2 PCR扩增
采用通用引物 BSF338-GC和 BSR518扩增细菌16S rDNA V3区片断[12]。采用特异性引物amx368-GC和amx820扩增厌氧氨氧化16S rRNA基因[13]。对于AOB细菌,采用引物amoA-1F-GC与amoA-2R扩增AOB功能基因amoA[14]。3种引物信息如表1所示。PCR产物按 DNA纯化回收试剂盒(天根)操作说明进行纯化回收。
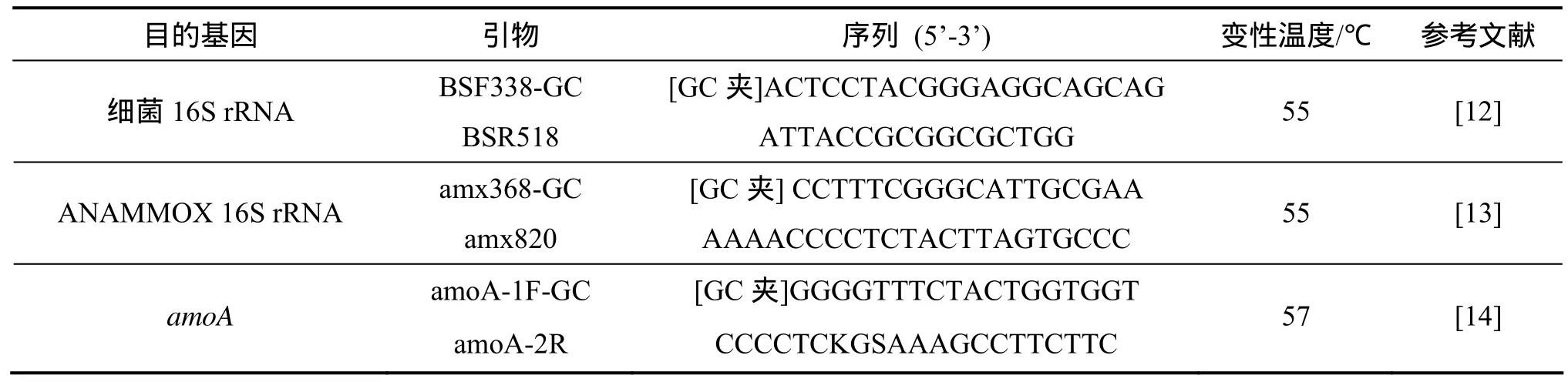
表1 PCR-DGGE所用引物信息Table 1 Summary of primer information for PCR-DGGE
1.3.3 DGGE及其结果分析
采用美国Bio-Rad公司DcodeTM的基因突变检测系统对PCR反应产物进行电泳分离,电泳条件如下: 凝胶变性梯度为30%~60%,聚丙烯酰胺质量分数分别为8% (BSF338-GC/BSR518)和 6%(amx368-GC/amx820,amoA-1F-GC/amoA-2R),电压为 120 V,缓冲液为1×TAE,温度为 60 ℃,电泳时间分别为 5 h(BSF338-GC/BSR518),8 h(amx368-GC/amx820)和 10 h(amoA-1F-GC/amoA-2R)。电泳结束后对凝胶进行银染[15],染色图谱通过数码相机获取。
对 DGGE图谱通过软件 Quantity One 4.6.0(Bio-Rad,USA)进行分析,其中微生物群落多样性用Shannon-Weaver指数(H)表示[16],其计算公式为:H=-∑PilnPi(其中Pi表示每个峰面积占总面积的比值)。而相关性分析主要分析反应器不同部位微生物种群相似性。
1.4 ANAMMOX菌与AOB系统发育分析
对于ANAMMOX菌与AOB DGGE凝胶上条带进行切胶溶于100 μL 1×TE中,在4 ℃ 冰箱中放置24 h。以此为模板,相应不带 GC夹的 amx368/amx820与amoA-1F/amoA-2R为引物,扩增厌氧氨氧化菌16S rRNA基因与 AOB 功能基因amoA。将回收的 PCR产物连接到载体 pMD19-T (TaKaRa)上,并转化到感受态细胞Escherichia coliDH5α(天根)中去。通过蓝白斑筛选阳性克隆并送交生工生物公司进行测序。获得的序列通过NCBI网站的 BLAST工具在GenBank中搜索相近序列。将该序列与已发表的相关序列进行比对,通过MEGA 5.0软件,以bootstrap-NJ法构建系统进化树[17]。本研究所得的ANAMMOX菌16S rRNA基因序列与 AOB细菌amoA基因序列已提交至GenBank,登录号分别为JN659913与JN659914。
2 结果与讨论
2.1 生物滤池沿层脱氮效果
反应器出水平均pH为8.2,比进水pH (7.2)高,原因是ANAMMOX过程中主要消耗氢离子从而造成pH 升高。目前关于低温(<20 ℃)厌氧氨氧化报道尚少, Dosta等[18]研究了温度对厌氧氨氧化的影响,发现温度<20 ℃条件下,厌氧氨氧化总氮去除负荷<0.5 kg/(m3·d)。Winkler等[19]研究了在温度(18±3) ℃条件下厌氧氨氧化颗粒污泥反应器脱氮效果,发现总氮去除负荷为 0.9 kg/(m3·d)。在本研究中,反应器在较低温度下(14.9~16.2 ℃)总氮去除负荷达 2.4 kg/(m3·d),表明火山岩生物滤池反应器即使在低温下也具有极高的厌氧氨氧化脱氮效果。
为了更清楚地了解反应器沿层氮素变化情况,对生物滤柱沿进水方向每隔 10 cm取样,对反应器上(140~190 cm)、中(60~140 cm)、下(10~60 cm) 3 部分氮素变化进行分析,结果如图1所示。从图1可见:沿滤层进水方向,氨氮和亚氮成比例消耗,总氮去除负荷也不断提高。经计算,发现在反应器下部即进水端,消耗的n(-N)∶n(-N)=1∶1.02,大于厌氧氨氧化反应理论消耗n(-N)∶n(-N)(1∶1.31)。推测其原因是生物滤柱下部存在 AOB,能够氧化一部分N。进水中的-N和-N 去除集中在生物滤柱中部(60~140 cm),且中部n(-N)∶n(-N)为 1∶1.31,符合厌氧氨氧化反应基质消耗的摩尔比,表明生物滤柱中部微生物以ANAMMOX菌为主。而在反应器上部,消耗的n(-N)∶n(-N)=1∶1.33,小于厌氧氨氧化反应理论消耗n(N)∶nN)(1∶1.31);同时,反应器上部积累了一定量的硝氮(20 mg/L),硝氮产生量与氨氮消耗量之摩尔比n(Δ3N)∶n(Δ-N)=0.23,小于理论n(Δ-N)∶n(Δ-N)(0.26),表明在反应器上部有一部分亚氮和硝氮以非厌氧氨氧化方式损失,推测反应器上部存在反硝化微生物,负责小部分亚氮和硝氮的去除。
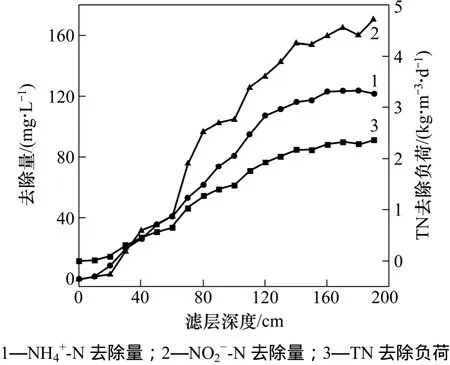
图1 生物滤柱沿层脱氮情况Fig.1 Nitrogen removal along biofilter layer
2.2 微生物形态分析
在反应器运行过程中,观察到生物膜上ANAMMOX菌所特有的红色沿水流方向存在明显的深浅变化,下部分生物膜呈暗褐色,中部分生物膜呈桃红色,上部分生物膜逐渐转为暗红色,这反映ANAMMOX 生物量并不是均匀分布的。为了更详细了解生物滤柱沿层生物膜微观结构,对上、中、下 3部分生物膜通过扫描电镜进行观察,结果如图2所示。上部分微生物形态不一,种类比较多,存在球形、杆形、弧形细菌及较多的丝状菌;中部分微生物几乎全是直径1 μm的球形细菌,分布密集;下部分微生物存在球状、椭球状和杆状细菌。
已报道的厌氧氨氧化细菌形态主要为球形,直径在0.8~1.1 μm之间[20]。通过扫描电镜对中部球形细菌放大10 000倍(图2(d)),能更清楚地观察这种球形细菌的特征:球形细胞表面并不十分光滑,存在一些细点状凸起;细胞之间存在细丝状连接,可能是细菌的分泌物,有助于细菌在填料表面附着生长。这些特征与已报道的厌氧氨氧化菌特征非常吻合[21]。这从微观上证实了 ANAMMOX 生物主要分布在反应器中部的推测,这也是氮素大部分在反应器中部被去除的原因。
2.3 细菌群落结构沿层分析
细菌DGGE 上、中、下3条泳道上共观察到12条不同的条带,见图3(a);对DGGE图谱经过Quantity One 4.6.0分析绘制示意图,见图3(b),其中12条横线位置及横线颜色深浅,可以反映各条带的分布与相对强度,也得到反应器内中,下部与上部细菌种群的相似性分别为 80.2%和 62.6%。另外,计算出微生物群落Shannon-Weaver指数H上,H中与H下分别为1.30,0.83和0.67。
DGGE凝胶上的条带与细菌群落结构密切相关,不同位置的条带代表着不同的细菌种类,条带的数量反映了群落的多样性。由图 3(a)可知:反应器内共只有12条不同位置的条带,表明细菌多样性不是很高,这可能与反应器进水采用无机配水有关。条带5,8,9和10在反应器上、中、下部分都出现,这些条带代表的4类细菌在反应器上、中、下3部分都存在,分布比较均匀;上、中、下3部分DGGE条带数目分别为10,7和6, Shannon-Weaver指数也是H上>H中>H下,这表明生物滤柱上部分细菌多样性最高,中部其次,下层细菌多样性最低。推测其原因是在生物滤柱进水端(下部),氨氮、亚氮浓度及水力负荷都很高,能够适应这种条件的细菌比较少。同时,这些细菌会消耗进水中的微量溶解氧,为反应器创造厌氧环境。在生物滤柱中部,氨氮、亚氮质量浓度降低,厌氧环境适宜,因而会形成以ANAMMOX菌为主的微生物群落结构。在生物滤柱上部存在反硝化现象,因而反应器上部可能存在反硝化微生物;同时,下、中部的一些微生物也会随水流到达上部,使得上部微生物种类较多。微生物群落结构沿层变化是适应生物滤柱沿层氮素变化的结果。

图2 厌氧氨氧化生物滤池沿层微观结构观察Fig.2 Microstructure of different parts in ANAMMOX biofilter
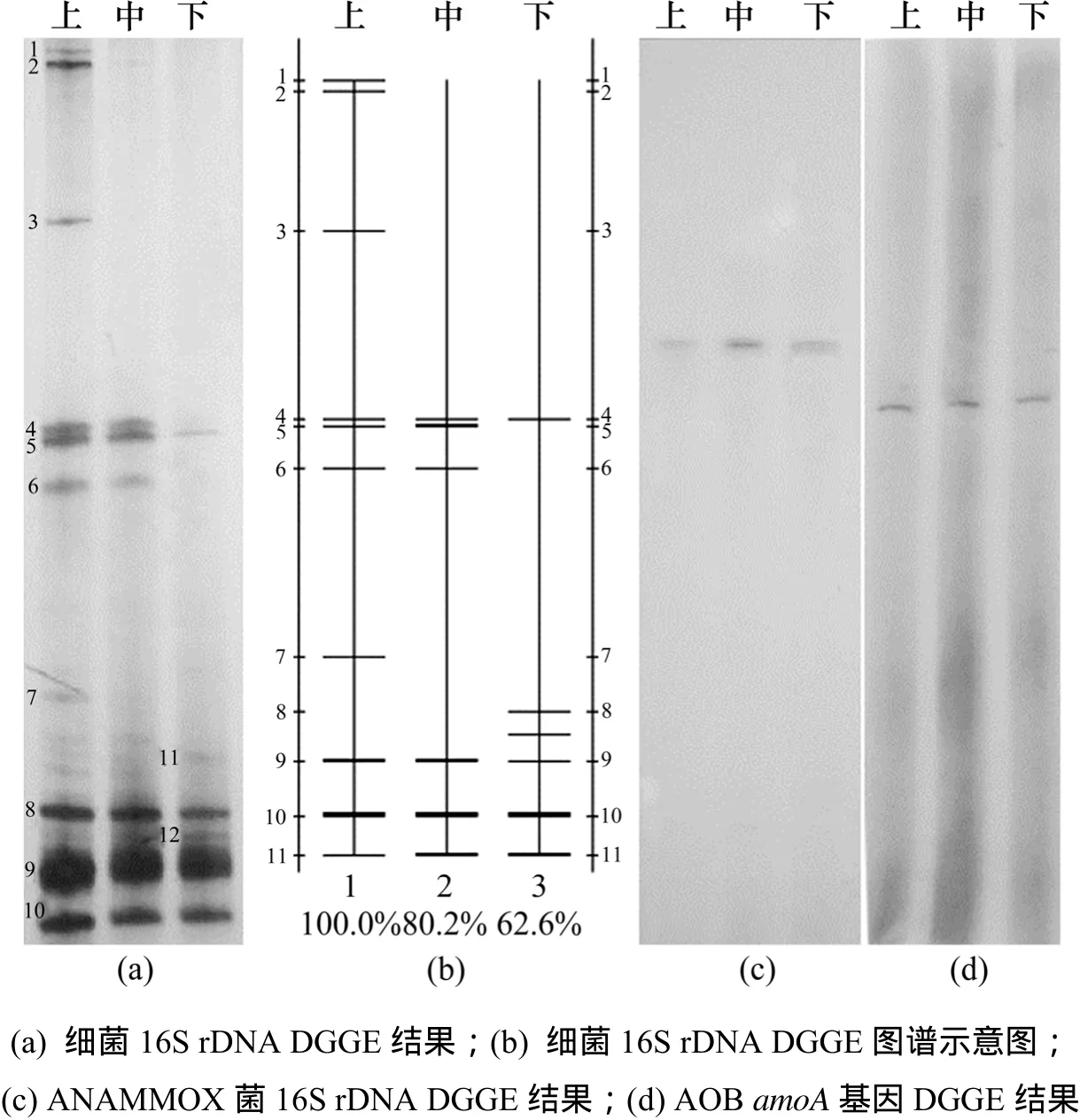
图3 厌氧氨氧化生物滤池上、中、下部位微生物DGGE结果Fig.3 DGGE results of upper, middle, and lower parts in ANAMMOX biofilter
2.4 ANAMMOX与AOB群落结构及系统发育分析
上、中、下3部分ANAMMOX的 DGGE结果(见图3(c))与AOB的DGGE结果(见图3(d))都分别只有1个条带,表明生物滤池沿层中 ANAMMOX与 AOB都分别只有1个种类,这与其他有关ANAMMOX在反应器内种类分布的研究结果一致[22]。在同一生态系统中,很少发现2个厌氧氨氧化种群同时出现,表明每一种厌氧氨氧化菌都有自己独特的特性与特定的生态系统[23]。
对ANAMMOX菌进行菌属鉴定,并构建系统发育树(见图 4),发现反应器内存在的 ANAMMOX 菌(JN659913 anammox bacteria)为Candidatus Kuenenia stuttgartiensis。这种 ANAMMOX 菌最早发现于生物滤池中[24],菌体呈球状,直径为1 μm左右,化能自养型,本研究中ANAMMOX菌与这些特征相吻合。一般文献报道厌氧氨氧化工艺都是在较高的温度(30~40 ℃)下运行,本实验中厌氧氨氧化生物滤池在低温下(14.9~16.2 ℃)也有很高的总氮去除负荷,显示Candidatus Kuenenia stuttgartiensis能够在低温下稳定生长并保持较高的生物活性,因而,可以通过富集Candidatus Kuenenia stuttgartiensis来维持厌氧氨氧化工艺在较低温度下(16 ℃左右)稳定运行。
在生物滤柱运行过程中,并没有把进水中的溶解氧去除,进水中存在较低的溶解氧,因而,反应器出现能够利用氨氮来获取能量的自养需氧菌AOB。但反应器处于低温、低溶解氧的环境,不具备 AOB适宜的生长繁殖条件,因而,反应器内 AOB种类单一,只有1种。通过克隆测序鉴定AOB菌属,并构建系统发育树,结果见图5。图5中JN659914 AOB amoA代表生物滤池中 AOB和已知氨氧化细菌的系统发育关系。发现生物滤池中 AOB与Nitrosomonas sp.ENI-11(AB079055.1)同源性最高,相似度达 98%。Nitrosomonas sp.ENI-11属于亚硝化单胞菌属(Nitrosomonas),Nitrosomonas为污水生物脱氮系统中比较常见 AOB菌属,其能够在低溶解氧环境下生存[5]。此类 AOB的存在能够消耗进水中的微量溶解氧,为反应器创造厌氧环境,有利于生物滤柱中部富集较多的ANAMMOX菌,发挥厌氧氨氧化脱氮效果。

图4 基于16S rDNA序列构建的厌氧氨氧化细菌系统发育树Fig.4 Phylogenetic tree of ANAMMOX bacteria based on 16S rDNA sequences

图5 基于amoA基因氨氧化细菌的系统发育树分析Fig.5 Phylogenetic tree of AOB based on amoA gene sequences
3 结论
(1) 大部分氨氮与亚氮在反应器中部以厌氧氨氧化脱氮方式去除,反应器即使在低温(14.9~16.2 ℃)条件下也具有很好的脱氮效果,总氮去除负荷达 2.4 kg/(m3·d)。
(2) 反应器中部微生物以类似 ANAMMOX菌的球形细菌为主。生物滤柱上部分细菌多样性最高,中部其次,下层细菌多样性最低。细菌群落结构沿层变化是适应生物滤柱沿层氮素变化的结果。
(3) 在反应器上、中、下部位存在同一种厌氧氨氧化菌(ANAMMOX)与好氧氨氧化菌(AOB)。反应器内存在的 ANAMMOX菌为Candidatus Kuenenia stuttgartiensis,AOB为Nitrosomonas sp.ENI-11。
[1]Jetten M S M, Strous M, van de Pas-Schoonen K T, et al.The anaerobic oxidation of ammonium[J].Fems Microbiology Reviews, 1998, 22(5)∶ 421-437.
[2]Jetten M S M, Horn S J, Vanloosdrecht M C M.Towards a more sustainable municipal wastewater treatment system[J].Water Science and Technology, 1997, 35(9)∶ 171-180.
[3]Jetten M S M, van Niftrik L, Strous M, et al.Biochemistry and molecular biology of anammox bacteria[J].Crit Rev Biochem Mol, 2009, 44(2/3)∶ 65-84.
[4]Li X R, Du B, Fu H X, et al.The bacterial diversity in an anaerobic ammonium-oxidizing (anammox) reactor community[J].Systematic and Applied Microbiology, 2009,32(4)∶ 278-289.
[5]Schmidt I, Sliekers O, Schmid M, et al.Aerobic and anaerobic ammonia oxidizing bacteria-competitors or natural partners?[J].FEMS Microbiol Ecol, 2002, 39(3)∶ 175-181.
[6]Zhang L, Zheng P, Tang C J, et al.Anaerobic ammonium oxidation for treatment of ammonium-rich wastewaters[J].Journal of Zhejiang University∶ Science B, 2008, 9(5)∶ 416-426.
[7]Isaka K, Date Y, Kimura Y, et al.Nitrogen removal performance using anaerobic ammonium oxidation at low temperatures[J].Fems Microbiology Letters, 2008, 282(1)∶ 32-38.
[8]杨朝晖, 徐峥勇, 曾光明, 等.不同低温驯化策略下的厌氧氨氧化活性[J].中国环境科学, 2007(3)∶ 300-305.YANG Zhaohui, XU Zhengyong, ZENG Guangming, et al.Anaerobic ammonia oxidation activity under different low temperature domestication strategy[J].China Environmental Science, 2007(3)∶ 300-305.
[9]田智勇, 李冬, 杨宏, 等.上向流厌氧氨氧化生物滤池的启动与脱氮性能[J].北京工业大学学报, 2009(4)∶ 509-515.TIAN Zhiyong, LI Dong, YANG Hong, et al.Start-up and nitrogen removal performance of anaerobic ammonium oxidation bio-filter[J].Journal of Beijing University of Technology, 2009(4)∶ 509-515.
[10]Wang T, Zhang H M, Gao D W, et al.Enrichment of Anammox bacteria in seed sludges from different wastewater treating processes and start-up of anammox process[J].Desalination,2011, 271(1/2/3)∶ 193-198.
[11]Zhou J, Bruns M A, Tiedje J M.DNA recovery from soils of diverse composition[J].Appl Environ Microbiol, 1996, 62(2)∶316-322.
[12]Ovreas L, Forney L, Daae F L, et al.Distribution of bacterioplankton in meromictic Lake Saelenvannet, as determined by denaturing gradient gel electrophoresis of PCR-amplified gene fragments coding for 16S rRNA[J].Appl Environ Microbiol, 1997, 63(9)∶ 3367-3373.
[13]Schmid M, Walsh K, Webb R, et al.Candidatus “Scalindua brodae”, sp.nov., Candidatus “Scalindua wagneri”, sp.nov., two new species of anaerobic ammonium oxidizing bacteria[J].Syst Appl Microbiol, 2003, 26(4)∶ 529-538.
[14]Nicolaisen M H, Ramsing N B.Denaturing gradient gel electrophoresis (DGGE) approaches to study the diversity of ammonia-oxidizing bacteria[J].J Microbiol Methods, 2002,50(2)∶ 189-203.
[15]Bassam B J, Caetano-Anolles G, Gresshoff P M.Fast and sensitive silver staining of DNA in polyacrylamide gels[J].Anal Biochem, 1991, 196(1)∶ 80-83.
[16]Shannon C E.The mathematical theory of communication.1963[J].MD Comput, 1997, 14(4)∶ 306-317.
[17]Tamura K, Peterson D, Peterson N, et al.MEGA5∶ molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance, and maximum parsimony methods[J].Mol Biol Evol, 2011, 28(10)∶ 2731-2739.
[18]Dosta J, Fernandez I, Vazquez-Padin J R, et al.Short- and long-term effects of temperature on the anammox process[J].Journal of Hazardous Materials, 2008, 154(1/2/3)∶ 688-693.
[19]Winkler M K, Kleerebezem R, van Loosdrecht M C.Integration of anammox into the aerobic granular sludge process for main stream wastewater treatment at ambient temperatures[J].Water Res, 2012, 46(1)∶ 136-144.
[20]van Niftrik L, Geerts W J, van Donselaar E G, et al.Linking ultrastructure and function in four genera of anaerobic ammonium-oxidizing bacteria∶ cell plan, glycogen storage, and localization of cytochrome C proteins[J].J Bacteriol, 2008,190(2)∶ 708-717.
[21]Jetten M S M, Wagner M, Fuerst J, et al.Microbiology and application of the anaerobic ammonium oxidation (‘anammox’)process[J].Current Opinion in Biotechnology, 2001, 12(3)∶283-288.
[22]秦玉洁, 周少奇, 朱明石.厌氧氨氧化反应器微生态的研究[J].环境科学, 2008, 29(6)∶ 1638-1643.QIN Yujie, ZHOU Shaoqi, ZHU Mingshi.Microecology of the anaerobic ammonium oxidation reactor[J].Environmental Science, 2008, 29(6)∶ 1638-1643.
[23]Kartal B, Rattray J, van Niftrik L A, et al.Candidatus“anammoxoglobus propionicus” a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria[J].Syst Appl Microbiol, 2007, 30(1)∶ 39-49.
[24]Schmid M, Twachtmann U, Klein M, et al.Molecular evidence for genus level diversity of bacteria capable of catalyzing anaerobic ammonium oxidation[J].Syst Appl Microbiol, 2000,23(1)∶ 93-106.
