水位对小叶章湿地CO2、CH4排放及土壤微生物活性的影响
2013-07-13万忠梅
万忠梅
吉林大学地球科学学院,吉林 长春 130061
湿地是陆地生态系统碳循环的重要组成部分,对全球碳平衡和气候变化起着极其重要的作用。水文条件是湿地重要的生态属性,水分条件变化如土壤含水量、水位波动等都会影响湿地大气-植被-土壤之间碳的生物地球化学过程各环节的方向与强度[1-2]。湿地独特的水文、土壤与生物特征,使土壤有机质得到累积。人为干扰对湿地水文过程的负面作用是导致湿地退化和丧失的最主要因素[3]。近年来,由于人类垦殖活动及气候变化导致湿地水位波动较大,这必然引起湿地土壤微生物活性变化,进而引起土壤有机碳储量的变化并造成温室气体排放量的变化。
三江平原分布着大面积湿地,是我国面积最大,分布连片的淡水湿地分布区,小叶章湿地是三江平原典型湿地之一。大量的野外实验表明湿地土壤呼吸和CH4通量具有非常明显的季节变化形式,并且这种变化与土壤湿度和温度的季节变化显著相关[4-5],而有关水位波动对三江平原小叶章湿地温室气体排放及微生物活性的研究较少,因此,本文采用小叶章野外盆栽控制实验,研究水位变化对小叶章湿地CO2、CH4排放及土壤微生物活性的影响,可为深入揭示湿地水分变化对其土壤生态过程的影响机理提供理论依据,对区域气候变化研究具有重要意义。
1 研究区自然概况及研究方法
1.1 试验地点及自然概况
野外盆栽培养试验区布置在黑龙江省建三江市洪河农场中科院三江平原沼泽湿地生态试验站试验区内。该地属温带湿润半湿润季风气候,年平均气温1.9 ℃,年降雨量为550~600 mm,主要集中在6—9月,占全年降水量的70%,无霜期为125 d左右。试验场内主要植被有小叶章(Calamagrostis angustifolia)、毛苔草(Carex lasiocarpa)、漂筏苔草(Carex pseudocuraica)等植物群落。小叶章群落一般分布在地势相对较高土壤过湿、常年无地表积水或短时间季节性薄层地表积水生境中。
1.2 实验设计及样品采集
2008年5月初,在试验场挖取小叶章草甸沼泽土,于阴凉处自然风干,剔除石块、植物残体等杂物充分混匀过筛,土壤分别装到直径30 cm,高35 cm的塑料培养桶中,每桶装土9 kg,装土时尽量保持桶内的土壤容重一致。在试验场内选取群落组成、结构、密度、长势相对一致的小叶章群落,挖取幼苗均匀的移栽到培养桶中(尽量不破坏其根系结构),并使其在桶内适应生长一段时间。植物生长稳定后,根据野外小叶章的实际生长密度定植,使植入株数与当地实际生长的小叶章疏密程度相当(实际生境每m2约100簇小叶章)。于6月6日进行水位处理,设置非淹水和淹水4个水分梯度分别为T1: -5 cm,T2: 0 cm,T3: 5 cm,T4: 10 cm。T1和T2模拟小叶章湿地非淹水的水分状况,T3和T4模拟淹水状况。每个处理3次重复,随机排列。
8月末采集气体,通过在盆栽桶上方罩PVC箱收集气体。PVC箱高60 cm,长宽均为30 cm。采样时上部PVC箱罩住盆栽植物,下方水封,防止PVC箱内外气体流通。PVC箱上端安装有塑料细导气管,导气管上用三通阀控制气体进出。于扣箱后的0、10、20和30 min时用注射器通过三通阀抽取箱内气体50 mL,带回实验室备测CO2和CH4的浓度。然后收获植物采集土样,采用混合采样法垂直采集土样。土样充分混匀后,四分法取出适量鲜土,一部分鲜土过2 mm筛,于4 ℃保存,1周内测定土壤微生物量碳、微生物量氮;另一部分室内风干,过1 mm筛用于测定土壤蔗糖酶和淀粉酶活性。
1.3 分析方法
1.3.1 CO2和CH4通量的测定
采用静态箱—气相色谱法[6],气体样品在24 h内用HP4890进行分析,CO2、CH4采用单阀单柱进样、分离系统,用离子火焰化检测器(FID)检测;N2O采用的是双阀双柱自动进样、反吹、分离和切换气路,单独使用ECD检测器,载气为高纯氮气检测器工作温度200 ℃,计算气体通量公式见参考文献[7]。
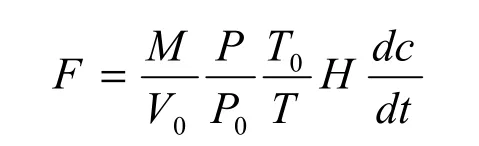
式中:F为CO2排放通量,单位为mg·m-2·h-1;M为气体的摩尔质量;P0和T0为理想气体标准状态下的空气压力和气温,分别为1013.25 hPa和273.15 K;V0为目标化合物在标准状态下的摩尔体积,即22.41 L·mol-1;H为采样箱内气体高度,单位为cm;P和T为采样时箱内的实际气压和气温,单位分别为hPa 和℃;dc/dt为箱内目标气体浓度随时间变化的回归曲线斜率,c为气体浓度,单位为g·m-3
1.3.2 土壤微生物量碳和微生物量氮测定
采用氯仿熏蒸-K2SO4浸提法[8]。
1.3.3 蔗糖酶和淀粉酶活性测定 采用3,5二硝基水杨酸比色法[9]。
1.4 实验数据统计
所有数据采用SPSS 11.5和Origin 7.5软件进行数据统计分析与绘图。
2 结果与讨论
2.1 水位对小叶章湿地CO2、CH4排放的影响
图1a反映不同水位处理的CO2排放通量的变化,从图中可以看出,随着水位梯度的增加CO2排放量逐渐降低。-5 cm水位(T1)处理的CO2通量为(643.35±61.89) mg·m-2·h-1,水位增加到0 cm(T2)、5 cm(T3)、10 cm(T4)时,小叶章湿地CO2通量依次降低6.9%,12.1%,40.0%,且水位升高到10 cm时,小叶章湿地CO2排放量显著降低(P<0.05)。Moore等也曾指出土壤呼吸通量是植物根和土壤微生物活性等的综合反映,并随着水位降低线性增加[10]。
水文条件特别是水位,它直接影响氧的可利用率、气体的扩散率及微生物的活性,CH4是厌氧条件下产CH4菌活动的产物[10],水分状况对土壤中CH4的产生起着决定性的作用。由图1b可以看出,水位在-5~10 cm范围内,小叶章湿地系统CH4排放通量为(1.52±0.12)~(5.34±0.61) mg·m-2·h-1,随着水位的增加小叶章湿地CH4排放通量显著增加,说明淹水促进了小叶章湿地生态系统CH4的产生和排放。另有研究表明毛苔草湿地地表水水位深度与CH4排放呈正相关关系[11],说明水位对湿地甲烷排放具有显著影响,本研究与该研究结论一致。
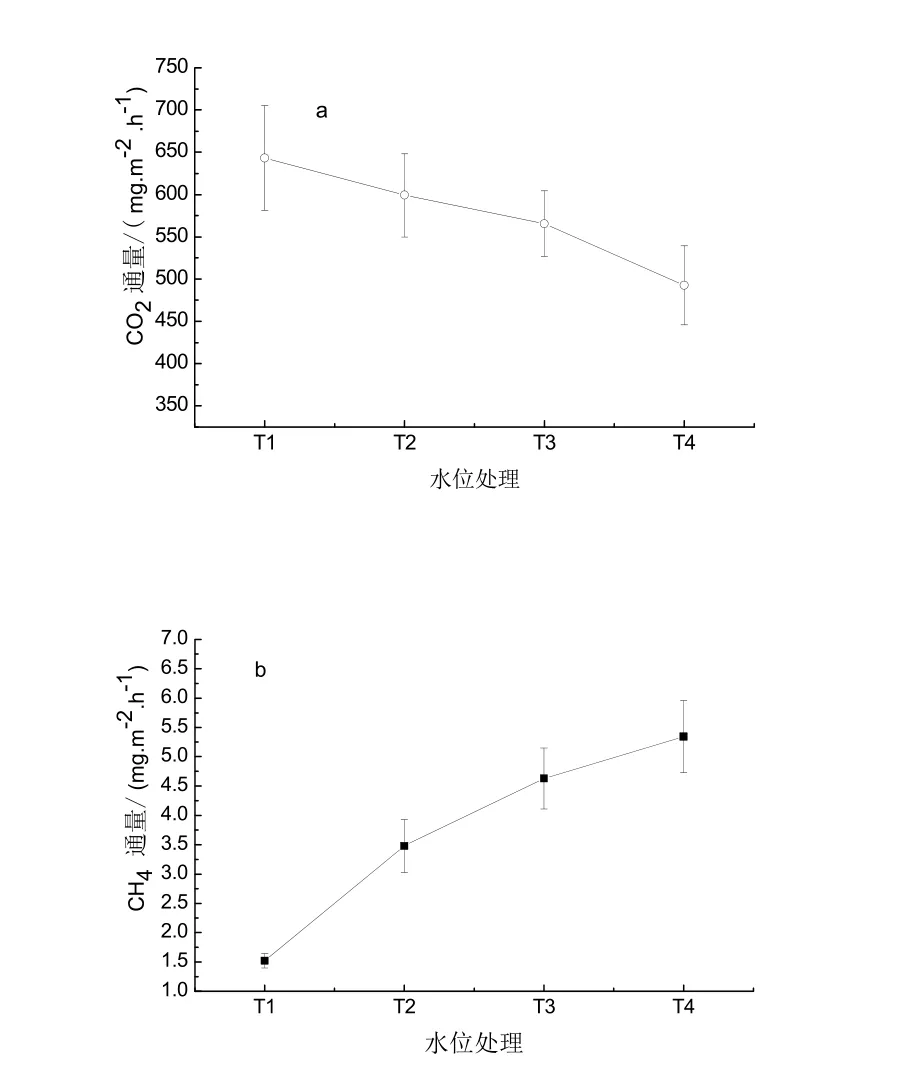
图1 不同水位处理小叶章湿地CO2与CH4通量 Fig. 1 Fluxes of CO2 and CH4 of Calamagrostis angustifolia marsh under different water table treatment
2.2 水位对小叶章湿地土壤微生物量碳、氮的影响
土壤微生物量比土壤有机质周转更快,能敏感地反映土壤过程的变化[12],由于土壤微生物量碳能够敏感且及时地反映或预示土壤的变化,因而被越来越多用作土壤质量的生物指示[13-16]。由图2a可见,不同水分处理小叶章湿地土壤微生物量碳含量有较大差异,总体表现为T2>T1>T3>T4,且T2处理的土壤MBC含量显著高于其他3个处理(p <0.05),随着淹水位上升,土壤MBC含量下降明显,淹水达10 cm时,土壤MBC质量分数为(419.58±31.66) mg∙kg-1,分别比0、5 cm水位条件下的土壤MBC质量分数降低了46.55%、32.10%。杨桂生等人的研究也表明随积水位升高小叶章湿地土壤微生物量碳明显下降[16]。由图2b可见,非淹水条件下(T1与T2)小叶章湿地土壤微生物量氮w(MBN)含量高于淹水条件下(T3与T4)的w(MBN)含量。水位-5 cm时,MBN质量分数为(66.34±6.39) mg·kg-1,随着水位增加到0、5、10 cm时,土壤w(MBN)分别降低14.8%、45.6%、61.2%。由此可见,非淹水条件下的土壤MBC、MBN均高于淹水条件,说明淹水抑制了微生物的活性,并随着水位上升,抑制作用显著。
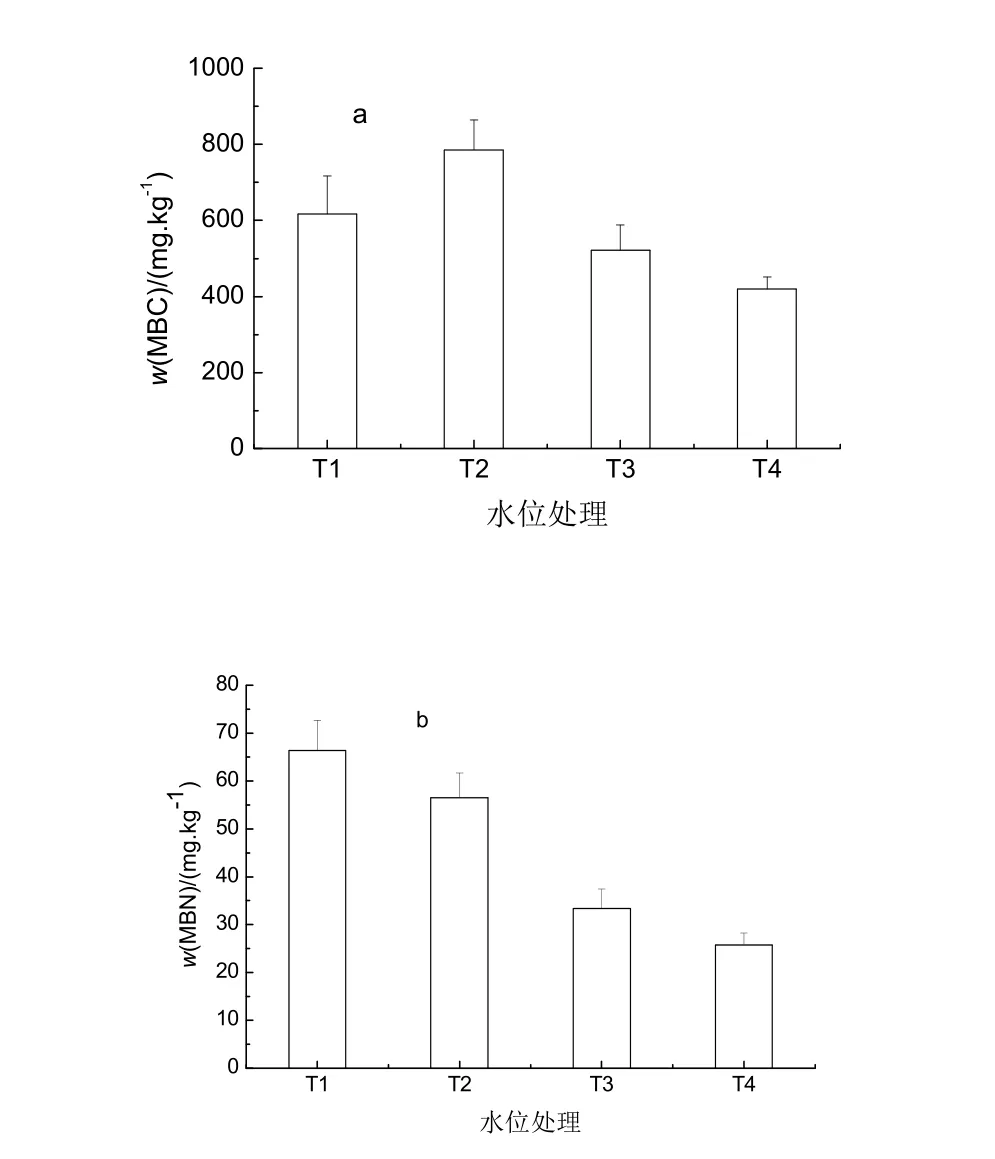
图2 不同水位处理小叶章湿地土壤MBC、MBN的变化 Fig. 2 Soil MBC and MBN of Calamagrostis angustifolia marsh under different water table treatment
2.3 水位对小叶章湿地土壤蔗糖酶和淀粉酶活性的影响
土壤蔗糖酶、淀粉酶是参与湿地土壤碳生物化学循环的重要酶。由图3a可见,不同水位条件下土壤蔗糖酶活性表现为T1>T2>T3>T4,即随水位的增加土壤蔗糖酶活性不断降低,这与毛苔草湿地蔗糖酶活性随水位变化规律一致[17]。水位在-5 cm时,土壤蔗糖酶活性为(2.69±0.28) mg·g-1·d-1,随水位增加该酶活性依次降低2.2%、23.8%、30.9%。由图3b可见,不同水位处理下,小叶章湿地土壤淀粉酶活性的变化趋势与土壤蔗糖酶活性略有差异,表现为T2>T1>T3>T4,即0 cm水位的土壤淀粉酶活性最高,为(169.43±12.70) μg·g-1·d-1,而水位为-5、5、10 cm时,土壤淀粉酶活性依次比0 cm水位降低2.4%、6.0%、18.0%。由此表明,小叶章湿地土壤蔗糖酶、淀粉酶在非淹水条件下即水位在-5和0 cm时,两种酶活性较高,则水解相应有机化合物的能力强,表明这两种水分条件有利于土壤有机碳的分解转化,同时,适宜的氧气和水分条件有利于植物和微生物的生长,二者分泌的土壤酶数量增加,也会提高土壤酶活性。随着淹水位的增加,酶活性下降明显,当水位达到10 cm时,这两种酶活性均显著降低(P<0.05)。有研究表明,积水可改变微生物群落,影响土壤酶的释放,并在还原条件下增加了诸如Fe2+等抑制因子的浓度而影响土壤酶活性[11-13]。因此,本研究表明湿地水位下降,可使参与分解转化有机碳的酶活性提高,加速土壤有机质的分解速率,因此保护湿地,维持湿地的水文环境对维持湿地碳汇功能具有重要意义。
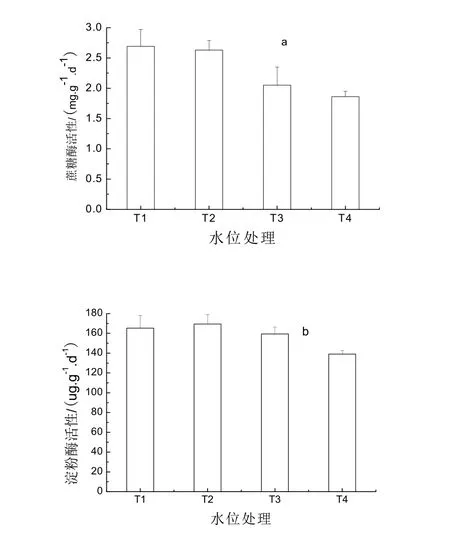
图3 不同水位处理小叶章湿地土壤蔗糖酶和淀粉酶活性变化 Fig. 3 Soil invertase and amylase activity of Calamagrostis angustifolia marsh under different water table treatment
3 结论
(1)在-5~10 cm水位波动时,小叶章湿地系统CO2排放呈现出随着水位增加排放通量降低,而CH4排放通量则呈现不断增加的趋势。
(2)小叶章湿地水分状况对土壤MBC、MBN有显著影响,非淹水土壤MBC、MBN含量高于淹水土壤,且随着淹水位增加土壤MBC、MBN含量显著降低。
(3)小叶章湿地土壤蔗糖酶、淀粉酶对水位波动的动态响应与微生物量具有相似的规律,非淹水条件下土壤蔗糖酶、淀粉酶活性高于淹水条件下的酶活性,并且淹水位增加对这两种酶活性抑制作用增强。
[1] Ström L, Christensen T R. Below ground carbon turnover and greenhouse gas exchanges in a sub-arctic wetland[J]. Soil Biology and Biochemistry, 2007, 39: 1689-1698.
[2] 侯翠翠, 宋长春, 李英臣, 等. 不同水分条件下小叶章湿地表土有机碳及活性有机碳组分季节动态[J]. 环境科学, 2011, 32(1): 290-297.
[3] 崔保山, 刘兴土. 黄河三角洲湿地生态特征变化及可持续性管理对策[J]. 地理科学, 2001, 21(3): 6-10.
[4] Haraguchi A, Kojima H, Hasegawa C. Decomposition of organic matter in peat soil in a minerotrophic mire[J]. European Journal of Soil Biology, 2002, 38: 89-95.
[5] Elberling B. Seasonl trends of soil CO2dynamics in a soil subjcet to freezing[J]. Journal of Hydrology, 2003, 276: 159-175.
[6] Wang Y S, Wang Y H. Quick measurement of CH4, CO2and N2O emissions from a short-plant ecosystem[J]. Advances in Atmospheric Sciences, 2003, 20 (5): 842-844.
[7] Wichland K P. Carbon gas exchange at a southern Rochy Mountain wetland, 1996—1998[J].Global Biogeochemical Cycles, 2001, 15(2): 677-682.
[8] 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,2000.
[9] 关松荫. 土壤酶及其研究法[M]. 北京:农业出版社, 1986:274-323.
[10] Moore T R, Roulet N T, Waddington J M. Uncertainty in predicting the effect of climatic change on the carbon cycling of Canadian peatlands[J]. Climate Change, 1998, 40: 229-245.
[11] 宋长春, 阎百兴, 王跃思, 等. 三江平原沼泽湿地CO2和CH4通量及影响因子[J]. 科学通报, 2003, 48(23): 2473-2477.
[12] Anderson T H. Microbial eco-physiological indicators to asses soil quality[J]. Agriculture, Ecosystems and Environment, 2003, 98: 285-293.
[13] 孙波, 赵其国, 张桃林, 等. 土壤质量与持续环境Ⅲ: 土壤质量评价的生物学指标[J]. 土壤, 1997, 29(5): 225-234.
[14] 任天志, Stefano G. 持续农业中的土壤生物指标研究[J]. 中国农业科学, 2000, 33 (1): 68-75.
[15] Nsabimana D, Haynes R J, Wallis F M. Activity and catabolic diversity of the soil microbial biomass as affected by land use[J]. App lied Soil Ecology, 2004, 26: 81-92.
[16] 杨桂生, 宋长春, 王丽, 等. 水位梯度对小叶章湿地土壤微生物活性的影响[J]. 环境科学, 2010, 31(2): 444-449.
[17] 万忠梅, 宋长春, 郭跃东, 等. 毛苔草湿地土壤酶活性及活性有机碳组分对水分梯度的响应[J]. 生态学报, 2008, 28(12): 5980-5986.
[18] Kang H, Freeman C. Phosphatase and arylsulphatase activities in wetland soils: annual variation and controlling factors[J]. Soil Biology and Biochemistry, 1999, 31: 449-454.
[19] Freeman C, Liska G, Ostle N J, et al. Microbial activity and enzymic decomposition processes following peatland water table drawdown[J]. Plant Soil, 1996, 180: 121-127.
[20] Pulford I D, Tabatabai M A. Effect of the waterlogging on enzyme activities in soils[J]. Soil Biology and Biochemistry, 1988, 20: 215-219.
