“氧化还原-沉淀-超滤”法处理含铬放射性废水
2013-07-09郭宁博贾铭椿董兴泰
郭宁博 贾铭椿 董兴泰
(海军驻葫芦岛431厂军事代表室1) 葫芦岛 125004) (海军工程大学动力工程学院2) 训练部3) 武汉 430033)
0 引 言
某些核设施检修或退役时会产生一定量的含铬放射性废水,其放射性水平极低,从放射性废水排放的角度而言,可以满足国标规定的近海排放标准[1],但是其中Cr(VI)的含量却达到300mg/L以上,远远高于国家规定的向天然水体中排放的标准(0.5mg/L以下)[2].因此,对于此类废水,处理的目的主要是除铬而不是去放射性.但是除铬过程中产生的二次废物属于放射性废物,为实现放射性废物最小化,必须在工艺设计中考虑如何减少二次废物的产生量.因此除铬的效率和二次废物的产生量是处理这种废水需要特别关注的问题.
目前处理含铬废水的方法很多,有化学法、离子交换法、生物法、电解法、光催化法[3-4]等.离子交换法工艺成熟、除铬效率高,一度得到大规模应用,但含铬废水一般质量浓度较高,需要消耗大量的离子交换树脂,且树脂吸附后再生困难,因此目前工业上采用此法较少.生物法、电解法和光催化法都是除铬新方法,这些方法因能耗低或无二次污染而获得越来越多的关注,国内外研究较多,但大多技术尚不成熟而未得到广泛应用.化学法工艺简单,技术成熟,是工程上最常用的方法,但污泥量大是化学法中常遇到的问题,这使其在处理放射性含铬废水的应用中受到限制.过氧化氢是一种环境友好型氧化还原剂,其分解产物仅为水和氧气.超滤(UF)[5-6]是一种以膜为过滤介质的分离技术,因其高效、操作方便的特点近年来在污水处理中的应用日益广泛.本文选用过氧化氢作还原剂,改絮凝沉淀为超滤膜处理,采用“氧化还原-沉淀-超滤”的工艺处理模拟含铬放射性废水,旨在探索出一种高效且二次废物产生量少的处理方法.
1 实验部分
为减缓设备腐蚀,某些核设施屏蔽水箱和冷却管路的水中加入了重铬酸钾作为缓蚀剂,其Cr(VI)质量浓度从80~400mg/L不等.反应堆检修或退役时这些水排出成为废水,需处理达标后排放.取样测量其放射性活度仅为几十Bq/L,Cr(VI)质量浓度大于300mg/L.因此本实验配制含Cr(VI)300mg/L的重铬酸钾溶液作为模拟废水(以下简称废水).
实验分为3个步骤:(1)用过氧化氢将废水中的Cr(VI)还原为Cr(III);(2)除去残留过氧化氢并加碱液,将Cr(III)转化为氢氧化铬;(3)用超滤膜截留氢氧化铬,实现铬与废水的分离.
实验工艺流程见图1.其中超滤膜组件采用天津膜天膜工程技术有限公司生产的MIF-1A型超滤膜,膜孔径0.1μm,面积0.2m2,PVDF材质;供水泵为杭州新西山实业有限公司生产的MP-70RZ型磁力驱动循环泵,流量20L/min,扬程12m.
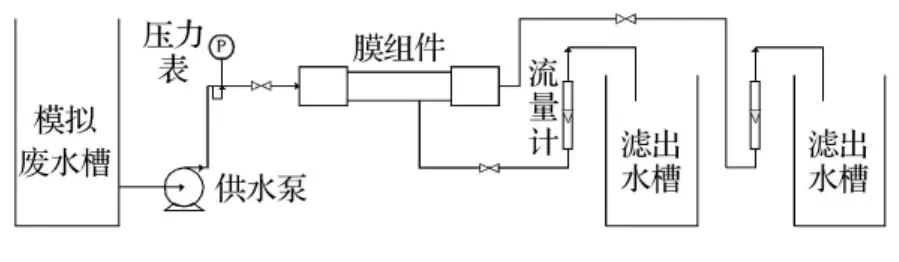
图1 实验工艺流程图
仪器采用北京普析通用仪器有限责任公司TU-1900双光束紫外可见分光光度计,上海精密科学仪器有限公司PHS-3D型pH计,梅特勒-托利多仪器有限公司的电子天平.
铬浓度测定中部分药品按国家标准采用优级纯试剂,其余药品均为分析纯试剂.总铬的测定方法为高锰酸钾氧化-二苯碳酰二肼分光光度法[7].六价铬的测定方法为二苯碳酰二肼分光光度法[8].
2 结果与讨论
2.1 过氧化氢还原Cr(VI)的影响因素分析
重铬酸钾在酸性介质中与过氧化氢发生反应[9]
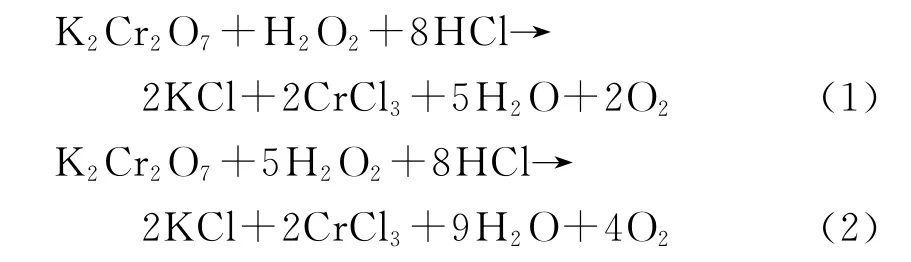
这是重铬酸钾与不等量的过氧化氢发生的2种氧化还原反应.可以看出,在过氧化氢和盐酸共同作用下,Cr(VI)被还原为 Cr(III).过氧化氢最终转化为对环境无害的水和氧气,不产生二次废物,有利于放射性废物的处理.
为了研究废水初始pH值对还原效果的影响,量取废水50mL,用盐酸调节废水样品的初始pH 值至1.61,1.66,1.72,1.78,1.87,均加入过氧化氢2mmol,2h后测量残留Cr(VI)质量浓度并计算转化率,结果见图2.
可以看出,初始pH值对Cr(VI)的转化率影响很大,初始pH值越低,转化率越高.从式(1)和式(2)来看,酸作为反应物,其质量浓度的提高能直接促进反应向右进行,使更多的Cr(VI)转化为Cr(III).
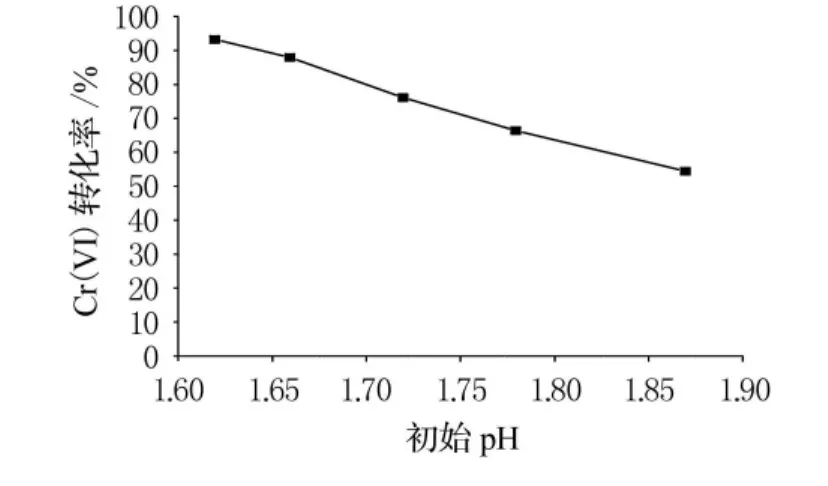
图2 初始pH值对Cr(VI)转化率的影响
处理含铬废水所用过氧化氢量应该适当控制.如果投加不足,则Cr(VI)反应不充分,废水达不到排放要求;如果投加过量,则会造成浪费,使处理成本增加.量取废水50mL,过氧化氢加入量与Cr(VI)转化率之间的关系见图3.
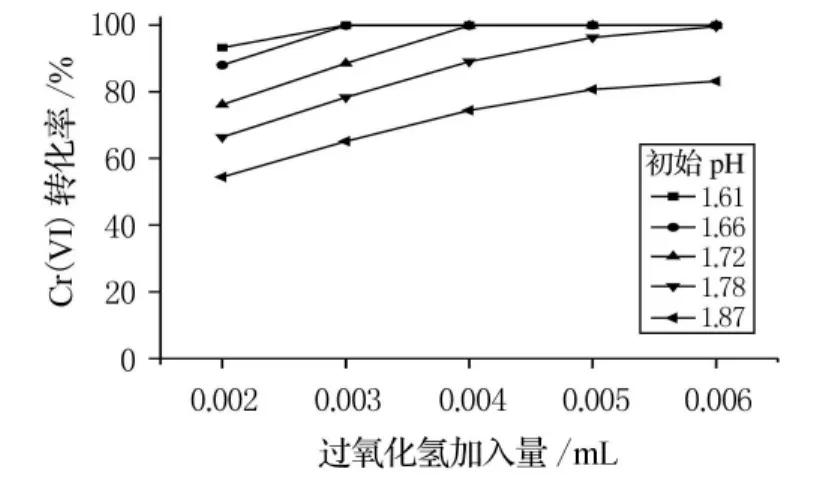
图3 过氧化氢加入量对还原效果的影响
从图3可以看出,当初始pH值大于1.78时,Cr(VI)转化率随着过氧化氢加入量的增加而增大;当初始pH值不大于1.78时,Cr(VI)转化率在实验区间内有极限值(Cr(VI)几乎完全反应),初始pH 值为1.78和1.72时极限值在6mmol/(50mL 废 水)和4mmol/(50mL 废水)时出现,初始pH值为1.61和1.66时极限值在3mmol/(50mL废水)时出现.因此将初始pH值调至1.66以下可以大大减少过氧化氢的用量.
根据式(1)和式(2)可以确定过氧化氢的理论用量,即0.144mmol/(50mL废水)至0.720m mol/(50mL废水).但实验发现过氧化氢过量时Cr(VI)才能较充分地被还原,在初始pH值为1.61~1.87范围内,要达到较高的还原率,过氧化氢加入量至少为3mmol/(50mL废水),即理论用量的4倍以上.根据周红敏等[10]的研究,过氧化氢是一种二元弱酸,在强酸性条件下不易离解生成,而能够作还原剂的自由基则要通过反应+H2O2→HO2·+HO·+OH-生成,这就造成强酸性条件下过氧化氢活性不足.但Cr(VI)的氧化性又要通过强酸性条件表现,因此只能用过量的过氧化氢来保证Cr(VI)的充分还原.
Cr(VI)转化率随时间变化规律见图4.
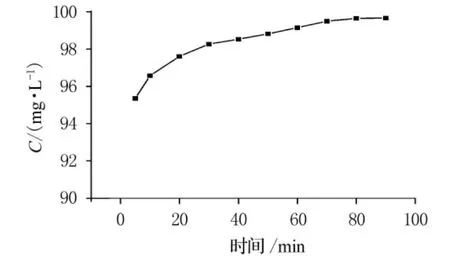
图4 Cr(VI)转化率随时间变化规律
开始时,反应物充足,反应迅速进行,5min内Cr(VI)转化率即达到95%以上.随着过氧化氢和酸的不断消耗,二者浓度下降,反应动力减小,反应速度减缓.30~80min时进入缓慢反应阶段.80min后Cr(VI)几乎反应完全,转化率达到最大.因此最佳反应时间为80~90min.根据实验数据进行零级、一级和二级反应动力学方程的归纳分析,通过以质量浓度C,lnC和1/C对时间t作图(如图5~7),依次得出零级、一级和二级反应速率常数分别为-0.111 89,-0.031 71和0.013 56,相关系数分别为0.848 49,0.979 1和0.770 79.从反应动力学方程的相关系数可知,此反应对于Cr(VI)应为一级反应.
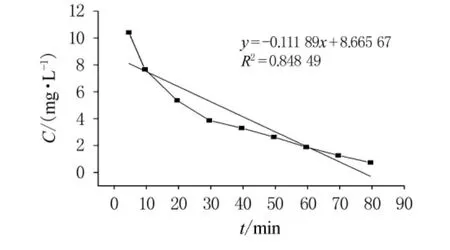
图5 零级反应动力学方程分析(C-t图)
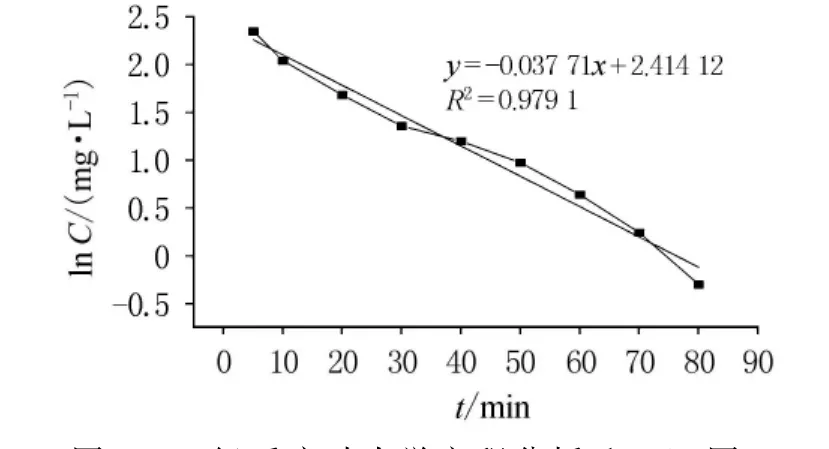
图6 一级反应动力学方程分析(ln C-t图)
2.2 残留过氧化氢的去除和Cr(III)沉淀
调节废水pH值至中性或碱性,Cr(III)与氢氧根离子结合生成氢氧化铬沉淀,才能实现铬与废水分离.在碱的作用下,Cr(III)又非常容易被残留的过氧化氢氧化为铬酸根离子,因此在加碱沉淀Cr(III)之前,要先除去废水中残留的过氧化氢.
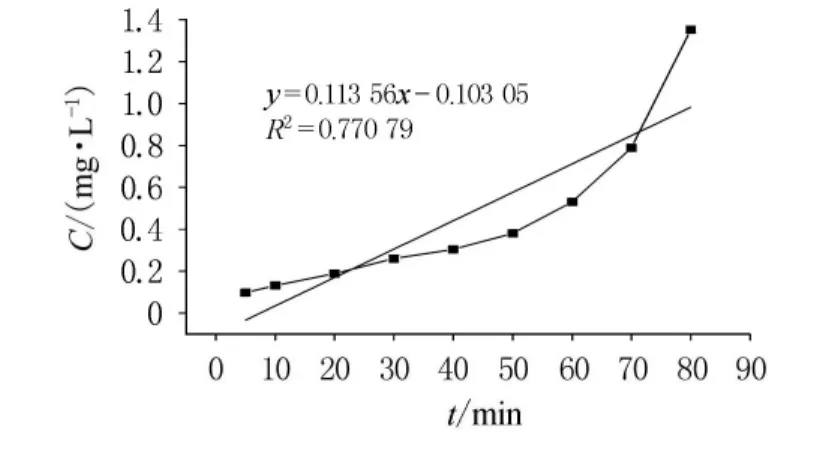
图7 二级反应动力学方程分析(1/C-t图)
2.2.1 金属离子催化分解残留过氧化氢的比较
文献[11-12]中报道,某些金属离子能够催化分解过氧化氢.本实验选取研究较多的Fe(III)和Mn(II)作为催化剂,研究其分解残留过氧化氢的效果.因为Cr(VI)和Cr(III)的存在,高锰酸钾法或碘量法不适于测定溶液中过氧化氢的浓度,本实验用加碱前后Cr(VI)浓度的变化表征金属离子对过氧化氢的催化分解效果.取废水100mL,调节初始pH值至1.66,加入6mmol过氧化氢.1.5h后加入5mmol/L的 Fe(III)或 Mn(II)5mL,去离子水作参比.1h后加碱液调节各溶液pH值至7.溶液中Cr(VI)转化率变化见图8.
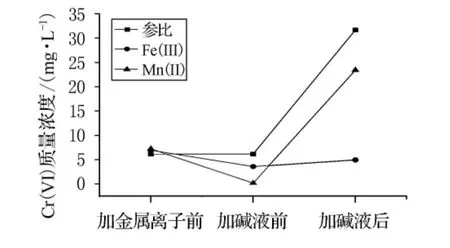
图8 金属离子催化分解过氧化氢的比较
由图8可知,加碱液后参比溶液和含Mn(II)溶液中的Cr(VI)质量浓度大幅升高,说明Mn(II)催化分解残留过氧化氢的效果较差,溶液中仍存在的大量过氧化氢与Cr(III)作用生成了铬酸根离子.加碱液后含Fe(III)溶液的Cr(VI)浓度只有小幅上升,说明加碱液前溶液中只剩下微量过氧化氢,Fe(III)催化分解过氧化氢效果显著.
2.2.2 氢氧化钠与氨水沉淀Cr(III)的比较 量取100mL废水,调节初始pH 为1.66,加入6mmol过氧化氢,用5mmol/L的Fe(III)催化分解过量过氧化氢,用0.1mol/L的氢氧化钠和0.1mol/L的氨水调节溶液pH,使 Cr(III)成为氢氧化铬沉淀,测得Cr(VI)转化率见表1.
从表1可见,氨水作沉淀剂时,Cr(VI)转化率总是高于同质量浓度的氢氧化钠作沉淀剂时的Cr(VI)转化率,这是因为氨水碱性较弱,不利于过氧化氢与Cr(III)作用生成铬酸根.因此与氢氧化钠相比,氨水更适合做Cr(III)沉淀剂.氨水作沉淀剂时,7为最佳沉淀pH值.
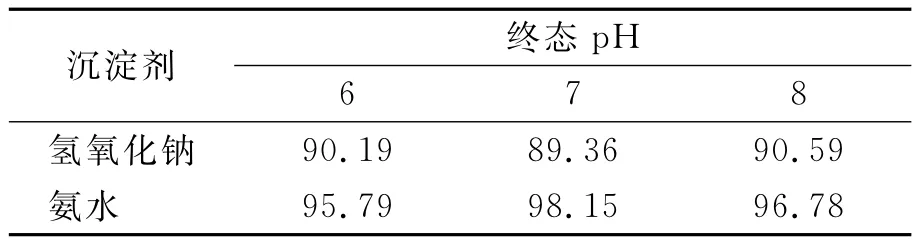
表1 不同条件下Cr(VI)总转化率 %
2.3 “氧化还原-沉淀-超滤”法除铬效果分析
配制模拟废水20L,调节pH值至1.66,加入30%过氧化氢120mL,充分搅拌,静置2h,使反应完全.加入0.28gFe(III)催化分解残留过氧化氢.1h后分别用0.1mol/L和0.01mol/L的氨水调节模拟废水pH值至7,向前者加去离子水使二者体积相等.
分别对上述废水进行超滤实验.启动超滤装置,调节操作压力至0.08MPa,起始透过水流量25L/h,浓缩水流量20L/h.开机5min后,开始取透过水样并测量Cr(VI)和总铬浓度,10min取样一次.测量结果见表2.
每组实验后,用去离子水对超滤膜反洗10 min,正洗10min,使超滤膜纯水通量恢复到90%以上;若恢复率小于90%,用浓度为0.3%的盐酸溶液低压循环清洗直至恢复率达到90%以上.
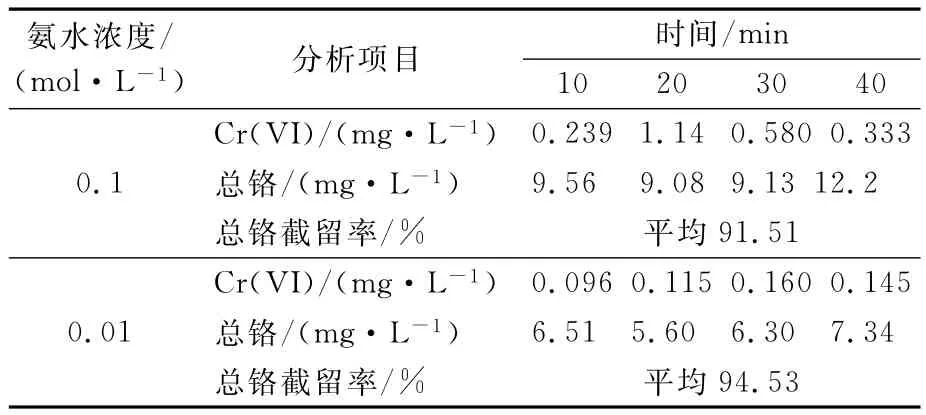
表2 超滤实验结果
从表2可以看出,用浓度为0.1mol/L或0.01mol/L的氨水调节pH值时,总铬平均截留率分别为91.51%和94.53%,配制300mg/L的Cr(III)溶液替代模拟废水进行对比实验,总铬平均截留率分别为99.919%和99.955%.比较发现,用0.01mol/L的氨水调节废水pH值能有效提高总铬截留率,其可能的原因是氢氧化铬更容易溶解于高浓度的氨水形成Cr(NH3)3+6铬离子,从而降低了超滤膜对总铬的截留率.用0.1mol/L的氨水调节pH值时,透过水中Cr(VI)平均浓度为0.573mg/L,略高于国家污水综合排放标准(0.5mg/L 以下),用0.01mol/L 的氨水调节pH值时,透过水中Cr(VI)平均质量浓度为0.129mg/L,达到排放标准.
3 结 论
通过研究废水初始pH值、过氧化氢用量和时间对Cr(VI)转化率的影响,确定了初始pH值1.66、过氧化氢用量6mmol/(100mL废水)并反应80min时,Cr(VI)转化率达到99.86%.提高酸度和增加过氧化氢用量,Cr(VI)转化率最高达到99.96%.过氧化氢在含铬放射性废水的处理中具有良好的应用前景.
在沉淀Cr(III)阶段,用0.25mmol/(1L废水)的 Fe(III)催化分解残留过氧化氢,用0.01mol氨水沉淀Cr(III),能有效地减少Cr(III)重新转化为Cr(VI),提高最终Cr(VI)转化率.
实验条件下,“氧化还原-沉淀-超滤”法处理模拟含铬放射性废水,出水总铬平均浓度6.44 mg/L,截留率达到94.53%.其中Cr(VI)平均浓度为0.129mg/L,达到国家污水综合排放标准.
本文选用过氧化氢作还原剂,对“氧化还原-沉淀-超滤”法处理模拟含铬放射性废水的效果进行了初步探索.过氧化氢在酸性条件下还原Cr(VI)效果很好,但在pH值较高时表现出较强的氧化性,对Cr(III)的沉淀造成了不利影响,下一步将选择氧化性较弱的还原剂如亚硫酸盐等进行研究.
[1]中华人民共和国国家质量监督检验检疫总局.GB14500-2002放射性废物管理规定[S].北京:标准出版社,2002.
[2]中华人民共和国国家质量监督检验检疫总局.GB8978-1996污水综合排放标准[S]..北京:标准出版社,1996.
[3]胡 涛,李亚云.含铬废水的治理研究[J].污染防治技术,2005,18(4):5-7.
[4]汪德进,何小勇.含铬废水处理的研究进展[J].安徽化工,2007,33(1):12-15.
[5]任建新.膜分离技术及其应用[M].北京:化学工业出版社,2003.
[6]王 湛.膜分离技术基础[M].北京:化学工业出版社,2000.
[7]中华人民共和国国家质量监督检验检疫总局.GB7466-87水质 总铬的测定 高锰酸钾氧化-二苯碳酰二肼分光光度法[S].北京:标准出版社,1987.
[8]中华人民共和国国家质量监督检验检疫总局.GB7467-87水质 六价铬的测定 二苯碳酰二肼分光光度法[S].北京:标准出版社,1987.
[9]陈寿椿.重要无机化学反应[M].2版.上海:上海科学技术出版社,1994.
[10]周红敏,石双群.Fe(III)、Cr(III)对过氧化氢分解作用再研究[J].河北化工,1995(2):22-24.
[11]姜成春,旁素艳,江进,等.Fe(Ⅲ)催化过氧化氢分解影响因素分析[J].环境科学学报,2007,27(7):1197-1202.
[12]张健扬,史淑凤,崔海香.金属离子对过氧化氢的催化分解作用研究[J].唐山师范学院学报,2005,27(5):10-13.
