调控酿酒酵母类异戊二烯合成途径强化芳樟醇合成
2013-06-30孙明雪刘继栋堵国成周景文陈坚
孙明雪,刘继栋,堵国成,2,周景文,陈坚,2
1 江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡 214122
2 江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡 214122
芳樟醇属于非环单萜醇,是一种植物次级代谢产物[1],在食品、香化、医药、日化等领域均具有重要应用价值[2]。目前,芳樟醇的合成主要采用植物提取和化学合成两种方法。化学合成方法通常比较昂贵,并且由于萜类物质具有特定的亲和性和专一性,通常只能较为经济地合成部分结构简单的萜类[3]。从天然芳香植物中提取单萜因产量和提取效率较低、易受各种自然因素影响,导致大部分单萜类化合物的价格居高不下[4]。利用微生物细胞合成单萜,因其原料来源广泛、产物单一且生产周期短,成为替代植物提取和化学合成的方法之一[5]。
目前以酿酒酵母作为合成萜类物质的真核表达系统正日益得到研究者的重视[6-7]。酿酒酵母通过内源类异戊二烯代谢途径提供香叶基二磷酸(GPP),可作为单萜生物合成的前体物质(图1)[8]。2007年,Oswald 等在酿酒酵母中引入仙女扇Clarkia breweri 来源的芳樟醇合成酶基因,但是由于异源芳樟醇合成酶表达量过低,导致检测不到目的产物芳樟醇[9]。2008年,Herrero等在野生型酿酒酵母的类异戊二烯生物合成途径上引入芳樟醇合成代谢支路,成功构建重组菌株并且能够有效分泌芳樟醇[10]。2010年,Rico等在酿酒酵母中成功表达了仙女扇来源的芳樟醇合成酶基因,并通过调节类异戊二烯生物合成途径使芳樟醇产量进一步提高,达到30.19µg/L[11]。
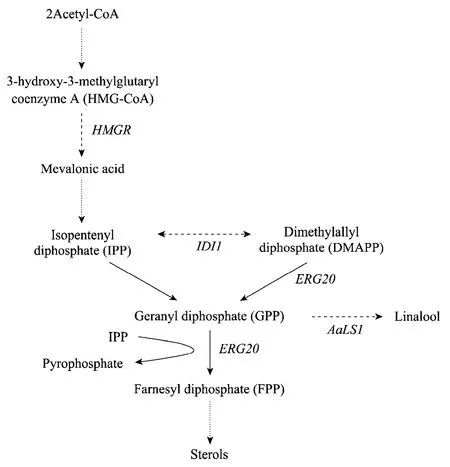
图1 酿酒酵母中类异戊二烯代谢途径(包括芳樟醇合成支路)Fig.1 Isoprenoid pathway in Saccharomyces cerevisiae,including the branch point to (S)-linalool.Dotted arrows indicate that more than one reaction is required to convert the substrate to the product indicated.Dashed arrows indicate the engineered steps.
为了获得高产芳樟醇的酿酒酵母工程菌株,本研究在已经成功表达来源于软枣猕猴桃Actinidia arguta 的芳樟醇合成酶基因的基础上[12],进一步调控类异戊二烯生物合成途径,增加芳樟醇合成前体的供给,实现了对tHMG1与IDI1基因的调控,使芳樟醇的产量提高了1.3倍,从(59.85±4.05)µg/L 增加至(127.71±7.68)µg/L。本研究在酿酒酵母工程菌中获得较高的芳樟醇产量,为实现芳樟醇的工业化生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 工具酶及试剂
芳樟醇(97%)购自Sigma-Aldrich 公司。限制性内切酶、T4 DNA 连接酶、ExTaq DNA 聚合酶、pMD18-T Simple Vector、感受态制备试剂盒、胶回收、片段回收试剂盒均购自宝生物工程(大连)有限公司。各种化学试剂均为分析纯。
1.1.2 菌株与质粒
本研究所用菌株及质粒如表1所示。
1.1.3 培养基
LB 培养基:蛋白胨10 g/L,酵母膏5 g/L,氯化钠10 g/L,需要时加入氨苄青霉素至终浓度为100µg/mL;YNB 液体培养基:硫酸铵5 g/L,YNB 1.7 g/L,葡萄糖20 g/L,pH 调至5.6,115℃灭菌15 min,灭菌后加入过滤除菌的卡那霉素至终浓度为100µg/mL。根据需要选择添加亮氨酸、组氨酸、色氨酸、尿嘧啶等,使其在培养基中终浓度为50µg/mL,氨基酸溶液在105℃灭菌10 min;YPD 液体培养基:蛋白胨20 g/L,酵母膏10 g/L,葡萄糖20 g/L,115℃灭菌15 min,在灭菌后加入过滤除菌的卡那霉素至终浓度为100µg/mL。固体培养基均在液体培养基中添加2%的琼脂粉。

表1 本研究中所用的菌株及质粒Table 1 Strains and plasmids used in this study
1.1.4 摇瓶培养条件
种子液的制备:将重组菌从氨基酸缺陷型平板上刮取一单菌落至20 mL YNB 液体培养基中,30℃、200 r/min 培养24 h 后,即为种子液。重组菌发酵实验:转接种子液至50 mL 新鲜YPD液体培养基,使OD600达到0.05,在30℃、200 r/min 培养48 h。
1.2 方法
1.2.1 DNA 片段的扩增与重组
以酿酒酵母CEN.PK2-1C 基因组为模板,用引物IDI1-R 和IDI1-F 扩增IDI1基因序列(引物序列见表2),获得基因长度867 bp 的IDI1基因。PCR 程序:94℃预变性5 min;94℃30 s,55℃30 s,72℃1 min,30个循环;72℃延伸10 min。PCR 产物经胶回收纯化后,与载体连接pMD18-T Simple,阳性克隆小量抽提质粒酶切鉴定,并进行DNA 测序。将序列正确并纯化的PCR 产物经过NotⅠ和SacⅡ双酶切,连接至经相同限制性内切酶酶切的双启动子表达载体pYLIS 中,获得AaLS1基因与IDI1基因共表达载体pYLIS-IDI1。
tHMG1基因是HMG-CoA 还原酶具有催化作用的蛋白C 末端编码区域[15]。以酿酒酵母CEN.PK2-1C 基因组为模板,用HMG1-R 和HMG1-F 进行PCR 扩增tHMG1基因(引物序列见表2),获得基因长度1578 bp 的tHMG1基因。PCR 程序:94℃预变性5 min;94℃30 s,55℃30 s,72℃2 min,30个循环;72℃延伸10 min。PCR 产物经胶回收纯化后,连接 pMD18-TSimple,小量抽提质粒酶切鉴定,进行DNA 测序。将序列正确并纯化的PCR 产物经过SpeⅠ和BamHⅠ双酶切,连接至经相同限制性内切酶酶切的酿酒酵母整合表达载体pRS305-TEF1中,获得tHMG1基因整合表达载体pRS305-tHMG1。
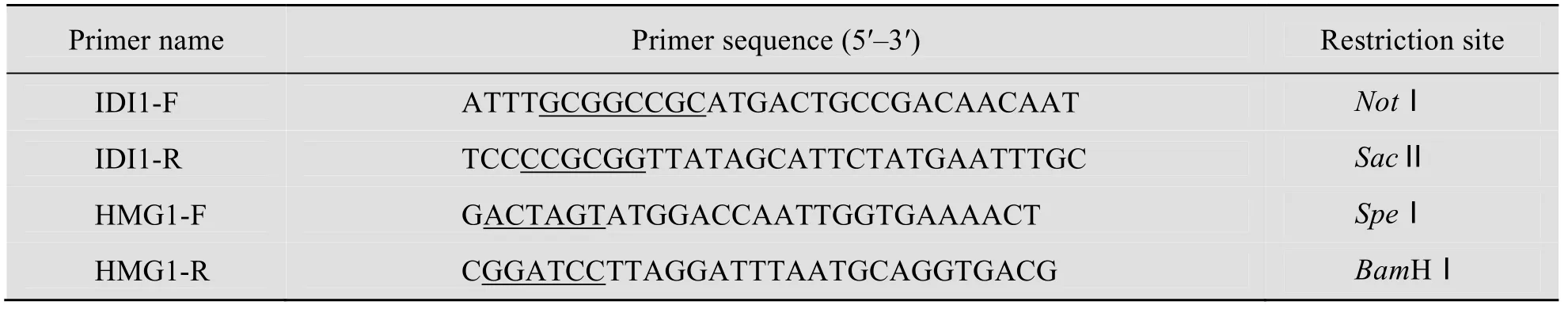
表2 PCR 扩增所需引物Table 2 Primers used for PCR amplification
1.2.2 重组菌株的构建
酿酒酵母转化均采用醋酸锂化学转化方法[16]。转化后涂布于相对应的氨基酸缺陷YNB平板,挑选转化子,菌落PCR 验证。
1.2.3 气相色谱与质谱(GC-MS)分析与检测
在20 mL 顶空进样瓶中,加入2 g NaCl,注入5 mL 预冷的发酵溶液样品,加盖密封垫和铝帽,压紧。顶空吸附温度95℃保温30 min。使用Shimadzu GCMS-QP2010气相色谱-质谱联用仪检测。色谱条件:Rax-Wax 色谱柱(30 m×0.25 mm ×0.25μm);程序升温条件:初始温度60℃,保持30 s,以8℃/min升温至100℃,立即以30℃/min升温至200℃,保持3 min;进样口温度为240℃,载气(氦气)流速为1 mL/min;不分流。质谱条件:EI 电离源,电子能量70 eV;质量扫描方式:选择离子扫描:m/z 71,93和121;定量离子71。
采用外标法测定芳樟醇样品的浓度,计算结果取3个平行发酵实验的平均值;配制4个浓度梯度的标准溶液,分别为10、100、1000、10000μg/L,分别测定在GC-MS 上的响应值,绘制标准曲线。
1.2.4 麦角固醇测定方法
采用吸光度法测定酿酒酵母菌株麦角固醇含量,具体测定方法见参考文献[17]。其中菌体干重(Dry cell weight)测定方法,首先收集发酵液,4000 r/min 离心10 min,蒸馏水洗涤菌体1~2次后取沉淀,60℃烘至恒重,称重。
2 结果与分析
2.1 IDI1基因的克隆和表达载体构建
以酿酒酵母CEN.PK2-1C 基因组DNA 为模板,采用PCR 法扩增IDI1基因,扩增出特异性谱带,大小约为867 bp。对PCR 产物进行测序,将序列正确PCR 产物经NotⅠ和SacⅡ酶切并纯化后,与经相同酶切的载体pYLIS 连接。在含有氨苄抗性的LB 平板上筛选阳性克隆,并通过菌落PCR 鉴定阳性克隆(图略)。抽提重组克隆菌株质粒经NotⅠ和SacⅡ酶切得到相应大小片段(图2),验证 IDI1基因与载体相连,载体pYLIS-IDI1构建成功。
2.2 tHMG1基因克隆和整合表达载体构建
以酿酒酵母CEN.PK2-1C 基因组DNA 为模板,采用PCR 法扩增tHMG1基因,扩增出特异性条带,大小约为1578 bp。PCR 产物进行测序,将序列正确PCR 产物经SpeⅠ和BamHⅠ酶切并纯化后,与经相同酶切的载体pRS305-TEF1连接。在含有氨苄的LB 平板上筛选阳性克隆,并通过菌落PCR 鉴定阳性克隆(图略)。抽提重组质粒经SpeⅠ和BamHⅠ酶切得到相应大小片段(图3),验证tHMG1基因与载体相连,载体pRS305-tHMG1构建成功。

图2 pYLIS-IDI1质粒的酶切验证Fig.2 Identification of plasmid pYLIS-IDI1 by enzyme digestion.M:DNA marker DL10000;1:pYLIS-IDI1 digested with NotⅠand SacⅡ.
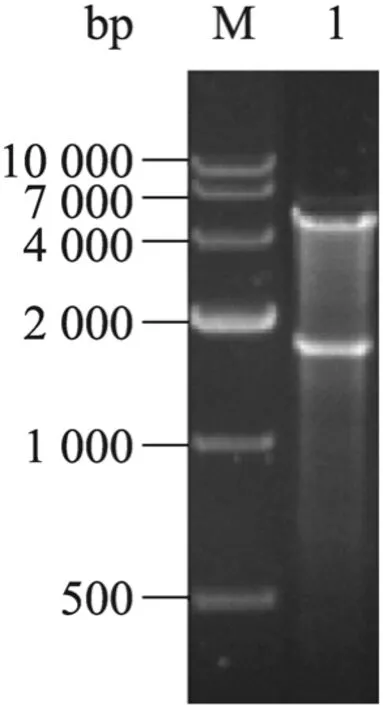
图3 pRS305-tHMG1质粒的酶切验证Fig.3 Identification of plasmid pRS305-tHMG1 by enzyme digestion.M:DNA marker DL10000;1:pRS305-tHMG1 digested with BamHⅠand SpeⅠ.
2.3 酿酒酵母工程菌株构建
将整合表达质粒pRS305-tHMG1导入酿酒酵母CEN.PK2-1C,成功构建酿酒酵母tHMG1基因整合表达菌株LS01。将IDI1基因表达载体pYLIS-IDI1导入酿酒酵母CEN.PK2-1C 和LS01中,分别构建工程菌株LS02和LS03。
2.4 调控类异戊二烯合成途径对麦角固醇含量的影响
麦角固醇是类异戊二烯合成途径终产物甾醇的主要前体,同时也是酿酒酵母细胞膜的重要组成部分。因此,类异戊二烯合成途径代谢流的变化可能会伴随麦角固醇合成的增加或减弱,而麦角固醇含量微小变化能够反应代谢途径上的重要改变[18]。通过测定酿酒酵母工程菌株麦角固醇含量(图4),发现在表达两基因后麦角固醇合成量从(14.26±1.11) mg/g DCW 增加至(17.68±1.44) mg/g DCW。结果表明,调控IDI1和tHMG1基因可以增加麦角固醇合成量。
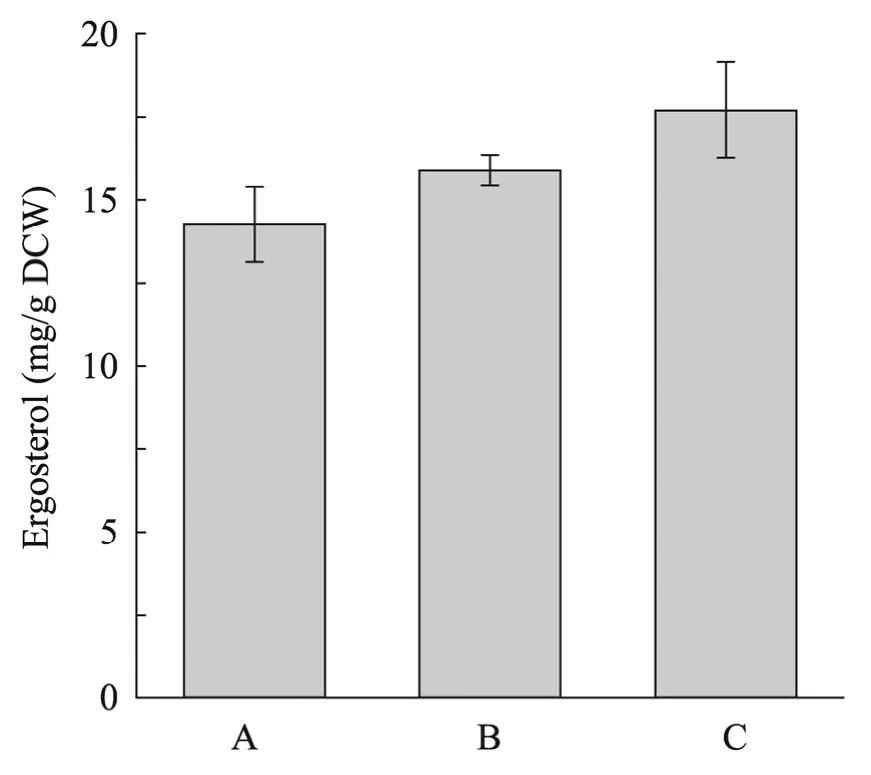
图4 调控类异戊二烯合成途径对麦角固醇含量的影响Fig.4 Effect on the content of ergosterol by regulating the isoprenoid pathway in S.cerevisiae.A:the control strain expressing the gene of AaLS1;B:the strain LS02 expressing the genes of AaLS1 and IDI1;C:the strain LS03 expressing the genes of AaLS1,IDI1 and tHMG1.
2.5 类异戊二烯合成途径的调控
为了进一步提高芳樟醇产量,必须消除代谢途径的限制因素,提高限制酶的表达水平。IDI1基因编码类异戊二烯基焦磷酸异构酶,该酶参与可逆的异构化反应实现IPP 与DMAPP 的相互转化,是控制所有萜类生物合成的第一步,调控该酶的表达水平对单萜化合物合成具有重要作用[19]。在酿酒酵母中,调节IDI1基因表达量,表达质粒 pYLIS-IDI1,使芳樟醇含量提高了69.6%,达到(101.46±3.45)μg/L,单位细胞芳樟醇含量从8.61µg/g DCW 提高至15.24µg/g DCW。HMG-CoA 还原酶是类异戊二烯合成途径上的关键限速酶,它催化HMG-CoA 合成甲羟戊酸的反应为不可逆的,其活性的不足会导致该途径代谢通量降低。因此,我们进一步提高HMG-CoA 还原酶水平,构建tHMG1基因整合表达菌株,并在该菌株中表达质粒pYLIS-IDI1,使芳樟醇产量提高至(127.71±7.68)μg/L,单位细胞芳樟醇含量提高9.4%,增加至16.66µg/g DCW (图5)。通过对工程菌株生长曲线进行检测,发现表达tHMG1基因使菌体生长有一定程度提高,可能由于代谢流增加对菌体生长有促进作用,表达IDI1基因后菌体生长有减弱趋势。总体来说,在酿酒酵母工程菌合成芳樟醇过程中,产物芳樟醇未对菌株生长造成致命影响(图6)。
3 讨论
在酿酒酵母工程菌株成功表达软枣猕猴桃来源的芳樟醇合成酶基因的基础上,本研究强化类异戊二烯合成途径,调控IDI1与tHMG1基因表达水平,使芳樟醇产量达到(127.71±7.68)μg/L,是Rico 等[11]报道在酿酒酵母工程菌中获得的芳樟醇最高产量的3倍。
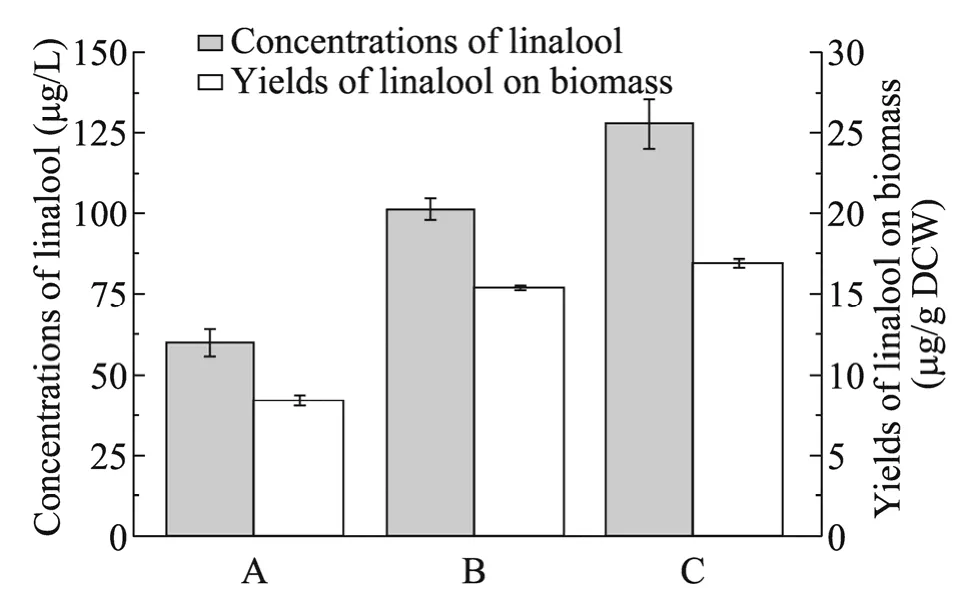
图5 调控类异戊二烯途径芳樟醇产量和单位细胞芳樟醇含量Fig.5 Final concentrations of linalool and yields of linalool on biomass after regulating the isoprenoid pathway.A:the control strain LS04 expressing the gene of AaLS1;B:the strain LS02 expressing the genes of AaLS1 and IDI1;C:the strain LS03 expressing the genes of AaLS1,IDI1 and tHMG1.
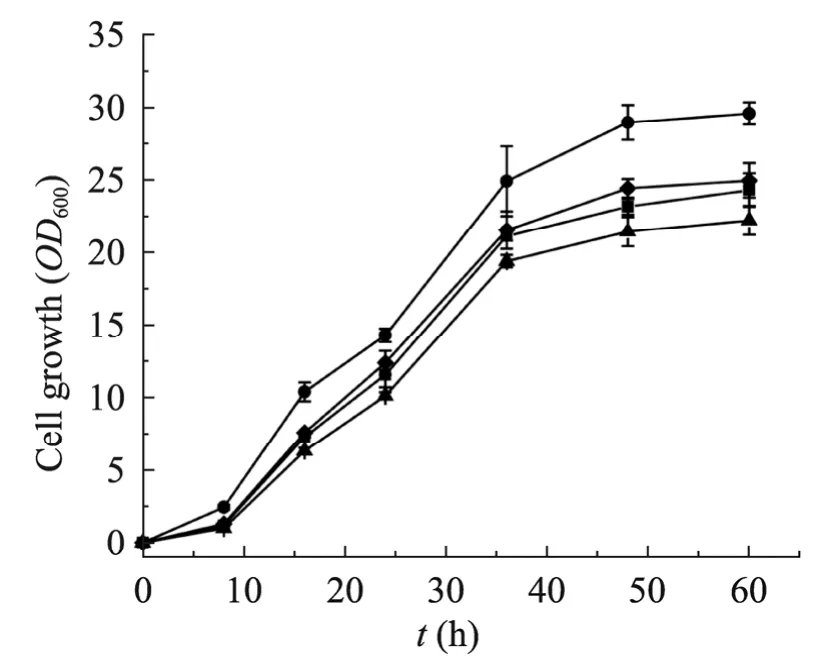
图6 酿酒酵母工程菌生长曲线的测定Fig.6 Growth curves of engineered strains.() the control strain transformed with the empty vector of pY26-TEF1-GPD in CEN.PK2-1C;() the strain LS02 expressing the genes of AaLS1 and IDI1;() the strain LS03 expressing the genes of AaLS1,IDI1 and tHMG1;() the strain LS04 expressing the gene of AaLS1.
酿酒酵母能够通过内源类异戊二烯合成途径合成GPP,但是水平较低,限制了芳樟醇合成量,因此提高胞内GPP 供给是增加芳樟醇产量的关键。对 IDI1基因的调控能够调节 IPP/DMAPP 比例,将代谢流平衡转向对GPP 生产有利的方向,进而增加单萜物质的合成[20]。过量表达IDI1基因后使芳樟醇产量从(59.84±4.05)μg/L提高至(101.46±3.45)μg/L。在类异戊二烯合成途径中,研究证实HMG-CoA 还原酶是关键限速酶,解除该酶的限制作用对促进类异戊二烯化合物积累起重要作用[21]。Verwaal 等[22]在酿酒酵母中过量表达该酶活性区域tHMG1基因使胡萝卜素产量显著提高。Rico 等[11]通过提高tHMG1基因表达水平,使芳樟醇产量从(21.92±1.75)μg/L提高至(30.19±3.88)μg/L。我们在改造IDI1基因的基础上,进一步表达tHMG1基因,使芳樟醇产量提高1.3倍,达到(127.71±7.68)μg/L。
本研究通过调控类异戊二烯合成途径代谢流,提高GPP 合成前体供给,构建芳樟醇高产的酿酒酵母工程菌。继续对培养基和培养条件等进行优化,将获得更高芳樟醇产量,为进一步实现工业化生产奠定基础。
[1]Chang MCY,Keasling JD.Production of isoprenoid pharmaceuticals by engineered microbes.Nat Chem Biol,2006,2(12):674−681.
[2]Mahmoud SS,Croteau RB.Strategies for transgenic manipulation of monoterpene biosynthesis in plants.Trends Plant Sci,2002,7(8):366−373.
[3]Dudareva N,Pichersky E.Metabolic engineering of plant volatiles.Curr Opin Biotechnol,2008,19(2):181−189.
[4]Siddiqui MS,Thodey K,Trenchard I,et al.Advancing secondary metabolite biosynthesis in yeast with synthetic biology tools.FEMS Yeast Res,2012,12(2):144−170.
[5]Nevoigt E.Progress in metabolic engineering of Saccharomyces cerevisiae.Microbiol Mol Biol R,2008,72(3):379−412.
[6]Huang BB,Guo J,Yi B,et al.Heterologous production of secondary metabolites as pharmaceuticals in Saccharomyces cerevisiae.Biotechnol Lett,2008,30(7):1121−1137.
[7]Kong JQ,Zhi XH,Wang W,et al.Synergistic effect of amorpha-4,11-diene synthase gene in engineered Saccharomyces cerevisiae.Chin J Biotech,2011,27(2):196−202(in Chinese).孔建强,支晓慧,王伟,等.紫穗槐-4,11-二烯合酶基因在酵母工程菌中具有协同.生物工程学报,2011,27(2):196−202.
[8]Kirby J,Keasling JD.Biosynthesis of plant isoprenoids:perspectives for microbial engineering.Ann Rev Plant Biol,2009,60:335−355.
[9]Oswald M,Fischer M,Dirninger N,et al.Monoterpenoid biosynthesis in Saccharomyces cerevisiae.FEMS Yeast Res,2007,7(3):413−421.
[10]Herrero Ó,Ramón D,Orejas M.Engineering the Saccharomyces cerevisiae isoprenoid pathway for de novo production of aromatic monoterpenes in wine.Metab Eng,2008,10(2):78−86.
[11]Rico J,Pardo E,Orejas M.Enhanced production of a plant monoterpene by overexpression of the 3-hydroxy-3-methylglutaryl coenzyme A reductase catalytic domain in Saccharomyces cerevisiae.Appl Environ Microb,2010,76(19):6449−6454.
[12]Chen XY,Yauk Y,Nieuwenhuizen NJ,et al.Characterisation of an (S)-linalool synthase from kiwifruit (Actinidia arguta) that catalyses the first committed step in the production of floral lilac compounds.Funct Plant Biol,2010,37(3):232−243.
[13]Sikorski RS,Hieter P.A system of shuttle vectors and yeast host strains designed for efficient manipulation of DNA in Saccharomyces cerevisiae.Genetics,1989,122(1):19−27.
[14]Li AM,Liu ZS,Li QX,et al.Construction and characterization of bidirectional expression vectors in Saccharomyces cerevisiae.FEMS Yeast Res,2008,8(1):6−9.
[15]Munoz-Bertomeu J,Sales E,Ros R,et al.Up-regulation of an N-terminal truncated 3-hydroxy-3-methylglutaryl CoA reductase enhances production of essential oils and sterols in transgenic Lavandula latifolia.Plant Biotechnol J,2007,5(6):746−758.
[16]Gietz RD,Schiestl RH,Willems AR,et al.Studies on the transformation of intact yeast cells by the LiAc/SS-DNA/PEG procedure.Yeast,1995,11(4):355−360.
[17]Asadollahi MA,Maury J,Moller K,et al.Production of plant sesquiterpenes in Saccharomyces cerevisiae:effect of ERG9 repression on sesquiterpene biosynthesis.Biotechnol Bioeng,2007,99(3):666−677.
[18]Fischer MJC,Meyer S,Claudel P,et al.Metabolic engineering of monoterpene synthesis in yeast.Biotechnol Bioeng,2011,108(8):1883−1892.
[19]Berthelot K,Estevez Y,Deffieux A,et al.Isopentenyl diphosphate isomerase:a checkpoint to isoprenoid biosynthesis.Biochimie,2012,94(8):1621−1634.
[20]Ignea C,Cvetkovic I,Loupassaki S,et al.Improving yeast strains using recyclable integration cassettes,for the production of plant terpenoids.Microb Cell Fact,2011,10(1):4.
[21]Ohto C,Muramatsu M,Obata S,et al.Overexpression of the gene encoding HMG-CoA reductase in Saccharomyces cerevisiae for production of prenyl alcohols.Appl Microbiol Biot,2009,82(5):837−845.
[22]Verwaal R,Wang J,Meijnen J,et al.High-level production of beta-carotene in Saccharomyces cerevisiae by successive transformation with carotenogenic genes from Xanthophyllomyces dendrorhous.Appl Environ Microbiol,2007,73(13):4342−4350.
