健康志愿者氯沙坦钾片的生物等效性研究
2013-06-23金杰*
金 杰*
(阿特维斯(佛山)制药有限公司,广东 佛山 528000)
健康志愿者氯沙坦钾片的生物等效性研究
金 杰*
(阿特维斯(佛山)制药有限公司,广东 佛山 528000)
目的 建立人血浆中氯沙坦及其代谢物氯沙坦羧酸(EXP3174)浓度的测定方法,并评价 2 种氯沙坦钾片在健康志愿者体内的生物等效性。方法 23 例男性健康志愿者随机双周期交叉给药,口服受试制剂和参比制剂 50mg,清洗期 1 周,HPLC-MS/MS 法测定血浆中氯沙坦和 HPLC-荧光法测定血浆中氯沙坦代谢物 EXP3174 浓度。所得数据经 WinNonlin 6.0 软件分析,计算氯沙坦及 EXP3174 在人体内的药代动力学参数。结果 口服受试制剂和参比制剂后,志愿者的氯沙坦和 EXP3174 主要药代动力学参数如下:氯沙坦 Cmax分别为(244.8561±86.9741)ng/mL,(266.8621± 115.5986)ng/mL;AUC0-t分别为(451.4±151.8)ng/(h ·mL),(459.4±163.7)ng/(h ·mL);AUC0-∞分别为(469.8±155.1)ng/(h ·mL),(477.9 ±166.2)ng/(h ·mL);t1/2分别为(1.55±0.32)h,(1.65±0.37)h;Tmax 分别为:(1.09±0.62)h,(1.25±0.75)h。EXP3174 Cmax分别为(399.4 ±100.5)ng/mL,(426.8±132.6)ng/mL;AUC0-t分 别 为(3231±1064)ng/(h ·mL),(3152±1058)ng/(h ·mL);AUC0-∞分 别 为(3458± 1152)ng/(h ·mL),(3408±1061)ng/(h ·mL);t1/2分别为(6.86±2.25)h,(5.77±1.47)h;Tmax分别为:(3.48±0.89)h,(3.13±0.69)h。结论氯沙坦钾受试制剂与参比制剂在人体内具有生物等效性。
氯沙坦;EXP3174;高效液相色谱 -串联质谱;高效液相色谱 -荧光检测;生物等效性
氯沙坦钾是全球第一个上市的口服非肽类血管紧张素Ⅱ受体拮抗药,可以阻断内源性及外源性的血管紧张素所产生的各种药理作用,具有良好的抗高血压疗效。氯沙坦钾口服吸收良好,经首过代谢后形成羧酸型活性代谢物EXP3174及其他无活性代谢物[1]。主要活性代谢物EXP3174的降压作用为氯沙坦的10倍[2]。因此在研究氯沙坦生物等效性和药代动力学时,同时测定氯沙坦和EXP3174是十分必要的。体内外研究表明:氯沙坦及EXP3174可以阻断任何来源或任何途径合成的血管紧张素Ⅱ所产生的相应的生理作用,与其他肽类的血管紧张素Ⅱ拮抗剂相比,氯沙坦钾无激动作用。本文用HPLC-MS/MS法测定人体内氯沙坦的血浆浓度及用HPLC-FLU法测定EXP3174的血浆浓度,对2种氯沙坦钾片进行生物等效性评价,为临床合理用药提供依据。
1 材料与方法
1.1 药品与试剂
氯沙坦钾片(规格:50mg/片,批号:124864),阿特维斯(佛山)制药有限公司提供;氯沙坦钾片(商品名:科素亚®,规格:50mg/片,批号:100520),杭州默沙东制药有限公司生产;氯沙坦钾对照品(批号:100597-200501,含量:100%),中国药品生物制品检定所;缬沙坦对照品(批号:100651-200902,含量:98.9%),中国药品生物制品检定所;氯沙坦羧酸(EXP3174)对照品(批号:6023,含量:95%),Ramidus AB公司;坎地沙坦对照品(批号:4-ARP-147-1,含量:98%),Toronto Research Chemicals Inc.;甲酸、乙腈、甲醇、甲基叔丁基醚和三乙胺为色谱纯;磷酸二氢钾和磷酸为分析纯;纯净水为杭州娃哈哈集团有限公司生产;空白血浆由中国人民解放军第二〇八医院提供。
1.2 仪器
API-2000串联四极杆质谱仪(配有电喷雾离子源,Analyst® 1.5.1质谱工作站,美国AB SCIEX公司);Ultimate 3000型高效液相色谱仪(含DCMS Link 2.7.0 for Analyst液相工作站、在线脱气机、自动进样器、柱温箱,美国戴安公司);LC-10ATvp型高效液相色谱仪(日本岛津公司);Agilent 1200 G1321A荧光检测器(含Agilent ChemStation for LC工作站,美国安捷伦公司);XW-80A微型旋涡混合仪(上海沪西仪器厂有限公司);KS康氏振荡器(江苏省金坛市荣华仪器制造有限公司);TGL-16M/TGL-20M高速台式冷冻离心机(长沙湘仪离心机仪器有限公司);TGL-16G台式离心机(上海安亭科学仪器厂);AUW120D分析天平(日本岛津公司);JA2003N电子天平、PHS-3E型PH计(上海精密科学仪器有限公司);MTN-2800W型氮吹浓缩仪(天津奥特塞恩斯仪器有限公司)。
1.3 方法
1.3.1 试验设计
所有志愿者在试验前签署知情同意书,临床试验方案经辽宁中医药大学附属第二医院伦理委员会批准,试验在辽宁中医药大学附属第二医院药物临床试验机构进行。试验前对志愿者进行一般的体格检查,包括生命体征、血尿常规、血生化(肝肾功能、K+、Na+等)及12导联心电图检查等。体检合格的24例健康男性志愿者入组参加试验,其中1例由于个人原因于第一周期服药前退出试验,故最终23例志愿者完成了本试验。
本试验采用开放随机的双周期双交叉试验设计。每个周期志愿者禁食过夜至少10h后,次日晨空腹以250mL温开水送服50mg受试制剂或参比制剂,服药后要检查志愿者口腔和盛药容器,以确保药物的正确服用,同时进行必要的安全性评价。经过一周的清洗期后交叉服药。于每周期服药前及服药后0.25、0.50、0.75、1.00、1.50、2.00、3.00、3.50、4.00、4.50、5.00、6.00、8.00、12.00、24.00、36.00、48.00h采集静脉血5mL。采集后的血样以肝素抗凝,离心分离血浆后于-70℃冰箱中保存备用。
每周期服药后2h方可按需饮水,服药后4h、10h统一进标准餐,志愿者至少从服药前10d到最后一次采血前,禁服葡萄柚及其任何加工品;至少从服药前7d到最后一次采血前,禁服任何维生素补充剂和天然产品(包括草药,大蒜补充剂和圣约翰草);在试验期间至少从服药前24h到最后一次采血前,禁服任何含黄嘌呤的食品和饮料,并禁止吸烟;至少从服药前48h到最后一次采血前,禁服任何含酒精的食品和饮料。
1.3.2 血浆样品中氯沙坦浓度的测定
1.3.2.1 色谱-质谱条件
分析柱:Platisil ODS(150mm×4.6mm,5μm);预柱:琛航C18保护柱;流动相:0.2%甲酸-乙腈(30∶70);流速:梯度流速;柱温:30℃;自动进样器温度:10℃;进样量:5μL。
质谱条件:离子源为电喷雾离子源(ESI源);气帘气:10 Psi;碰撞气:4 Psi;Gas1:70 Psi;Gas2:50 Psi;雾化温度:450 ℃;喷雾电压:4500 V;正离子方式检测;扫描方式为多反应离子监测(MRM),用于定量分析的离子分别为氯沙坦(m/z)422.9→206.9和缬沙坦(m/z)436.1→291.2。
1.3.2.2 血浆样品处理
精密量取血浆样品200μL,置10mL离心管中,加入甲醇-水(1∶1)溶液20μL,加入内标溶液(20.2400μg/mL缬沙坦)20μL,加入5%甲酸溶液100μL,混合均匀后,加入甲基叔丁基醚3mL,涡旋混合60s,振荡混合10min,离心6min(10000 rpm),转移有机层至5mL离心管中,于40℃水浴中空气流吹干,加入流动相400μL复溶,涡旋混合60s,将溶液转移至1.5 mL离心管中,离心3min(15000rpm),取上清液5μL进样分析。
1.3.2.3 方法学验证结果
采用HPLC-MS/MS法测定血浆中氯沙坦的浓度,结果表明,氯沙坦与内标缬沙坦及血浆杂质分离良好,在4.9950~599.4000ng/mL范围内线性关系良好,定量下限为4.9950ng/mL。氯沙坦提取回收率为74.9%~77.0%,批内和批间精密度与准确度均符合相关规定,基质效应不影响分析方法的准确度和精密度。
1.3.3 血浆样品中氯沙坦羧酸(EXP3174)浓度的测定
1.3.3.1 色谱条件
分析柱:Hypersil BDS C18柱(250mm×4.6mm,5μm);预柱:琛航C18保护柱;流动相:0.05mol/L磷酸二氢钾缓冲溶液(pH =3.00±0.02)-乙腈-甲醇(50∶30∶20);荧光波长:激发波长(Excitation):250nm,发射波长(Emission):375nm;流速:1.2mL/min;柱温:30℃;进样量:50μL。
1.3.3.2 血浆样品处理
精密量取血浆样品500μL,置10mL离心管中,加入甲醇-水(1∶1)溶液50μL,加入内标溶液(1.0170μg/mL坎地沙坦)50μL,加入10%磷酸溶液100μL,混合均匀后,加入甲基叔丁基醚3mL,涡旋混合60s,振荡混合10min,离心6min(10000 rpm),转移有机层至5mL离心管中,于40℃水浴中空气流吹干,加入复溶溶剂乙腈-水(45∶55)150μL复溶,涡旋混合60s,将溶液转移至1.5mL离心管中,离心3min(15000 rpm),取上清液50μL进样分析。
1.3.3.3 方法学验证结果
采用HPLC-荧光法测定血浆中EXP3174的浓度,结果表明,EXP3174与内标坎地沙坦及血浆杂质分离良好,在4.8~958.0 ng/mL范围内线性关系良好,定量下限为4.8ng/mL。EXP3174提取回收率为67.2%~71.3%,批内和批间精密度与准确度均符合相关规定。
1.4 统计方法
采用WinNonlin 6.0数据统计软件计算完成试验的23例志愿者血浆中的氯沙坦及EXP3174的主要药动学参数,并对AUC0-t、AUC0-∞和Cmax经对数转换后进行方差分析,双单侧t检验。Tmax采用非参数检验[3]。
1.5 安全性评价
临床试验医师进行必要的安全性评价,采血期间定期监测生命体征,保证每天至少2次询问志愿者是否有任何不良事件,询问时避免使用诱导性语言,监护医师应保证志愿者的安全。
2 结 果
2.1 数据计算和分析结果
23例志愿者口服受试制剂(T)和参比制剂(R)后氯沙坦、EXP3174的平均血药浓度(Concentration)-时间(Time)曲线均数对比图见图1和图2。
药动参数使用WinNonlin 6.0数据统计软件进行计算。Tmax和Cmax均为实测值,血药浓度-时间曲线下面积(AUC)按梯形面积法计算。计算得到的相应药动学参数见表1。
对主要药动学参数对数转换后进行方差分析,并进一步采用双单侧t检验和[1-2α]置信区间法进行生物等效性评价,其中Tmax采用非参数检验法。结果表明,Cmax、AUC0-t、AUC0-∞均拒绝生物不等效假设,结果见表2。Tmax在受试制剂与参比制剂间无显著性差异(P >0.05),结果见表3。根据以上结果,受试制剂参数AUC的90%置信区间落在了参比制剂相应参数的80 %~125 %范围内,受试制剂参数Cmax的90 %置信区间落在了参比制剂相应参数的75 %~133 %范围内,因此受试制剂和参比制剂具有生物等效性[4]。

图1 氯沙坦平均血药浓度-时间曲线均数对比图(n=23)
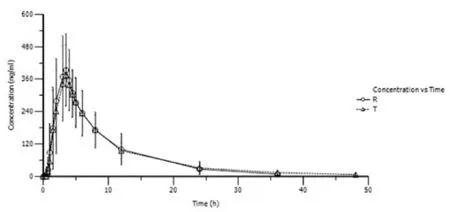
图2 EXP3174平均血药浓度-时间曲线均数对比图(n=23)

表1 氯沙坦、EXP3174主要药动学参数[3]

表2 氯沙坦、EXP3174置信区间和个体内变异结果(n=23)

表3 氯沙坦、EXP3174 Tmax的非参数检验结果(n=23)
2.2 安全性评价结果
两个周期服药后共有8例志愿者报告了不良事件,所有不良事件均为血压下降,级别为轻度,并均在未经任何医学处理的情况下于该周期采血结束前恢复正常。试验结束后再次对志愿者进行一般的体格检查,项目与入组体检项目相同,检查结果均正常。
3 讨 论
有报道,氯沙坦钾可引起高钾血症[5]和低钠血症[6],为了保证志愿者的安全,在入、出组血生化检查中增加了血钾和血钠,从而避免入选血钾或血钠紊乱的志愿者。氯沙坦钾作为降血压的药物,在本试验期间仅发生8例血压下降的不良事件,由此可见,氯沙坦的安全性很好,与众多一线降血压药物相比有着明显的优势。
从表2的数据可见,氯沙坦及EXP3174的个体内变异系数均<30%,故氯沙坦及EXP3174不属于高变异药物,因此23例志愿者可以满足等效试验的统计学要求。氯沙坦钾在肝内经细胞色素P450酶(CYP3A4、2C9)转化产生活性代谢产物氯沙坦羧酸[7],本试验受试制剂与参比制剂氯沙坦及EXP3174的药动学参数分别与文献[8-10]报道基本一致,而与非亚洲人种试验的文献[11,12]数据结果比较,代谢物EXP3174 Cmax和AUC结果相差较大,猜测这种差异可能源于不同人种体内P450酶的差别。
[1]陈欣,王茜,赵立波,等.进食或空腹口服国产氯沙坦钾片对健康志愿者药动学及血压的影响研究[J].中国药房,2011,22(22): 2059-2060.
[2]叶穗雯,李秋菊.血管紧张肽Ⅱ受体拮抗剂氯沙坦钾的临床应用及其发展现状[J].实用药物与临床,2005,8(5):48-49. 国家药典委员会.化学药物制剂人体生物利用度和生物等效性研究技术指导原则[S].2005.
[4]国家药典委员会.药物制剂人体生物利用度和生物等效性试验指导原则(中华人民共和国药典二部2010年版)[M].北京:化学工业出版社,2010:195-199.
[5]李帼姬,李力任,陈画虹.氯沙坦引起糖尿病肾病患者高钾血症1例[J].今日药学,2011,21(9):578-579.
[6]Kinoshita H,Kobayashi K,Yaguramaki T,et al.Losartan potassium/ hydrochlorothiazide (Preminent®) and hyponatremia: case series of 40 patients[J].Hum Exp Toxicol,2011,30(9): 1409-1414.
[7]张瑾,陈绍行.血管紧张肽Ⅱ受体拮抗剂的药动学与临床用药[J].中国新药与临床杂志,2004,23(2):111-115.
[8]Jia JY,Zhang MQ,Liu YM,et al.Pharmacokinetics and Bioequivalence Evaluation of Two Losartan Potassium 50-mg Tablets: A Single-Dose, Randomized-Sequence, Open-Label, Two-Way Crossover Study in Healthy Chinese Male Volunteers[J].Clin Ther, 2010,32(7):1387-1395.
[9]Ohtawa M,Takayama F,Saitoh K,et al.Pharmacokinetics and biochemical efficacy after single and multiple oral administration of losartan, an orally active nonpeptide angiotensin Ⅱ receptor antagonist, in humans[J].Br J Clin Pharmacol,1993,35(3): 290-297.
[10]韦阳,黄慧芳,邵庆翔,等.国产氯沙坦钾片的生物等效性研究[J].中国临床药理学杂志,2000,16(2):106-110.
[11]Oliveira CH,Medeiros Silva R,Santagada V,et al.Comparative bioavailability of two losartan formulations in healthy human volunteers after a single dose administration[J].Int J Clin Pharmacol Ther,2006,44(3):142-148.
[12]Tamimi JJI,Salem II,Mahmood Alam S,et al.Comparative Pharmacokinetics of Two Tablet Formulations of Losartan: Bioequivalence Assessment[J].Biopharmac Drug Dispositin,2005,26(5):205-210.
Studies on Bioequivalence of Losartan Potassium Tablet in Healthy Volunteers
JIN Jie*
(Actavis (Foshan) Pharmaceuticals Co Ltd, Foshan 528000, China)
ObjectiveTo establish a method for determination of losartan and its metabolite EXP3174 in human plasma.To evaluate the bioequivalence of 2 kinds of losartan potassium tablets in healthy volunteers.MethodsA single oral dose of 50 mg test or reference preparation was adminidtrated to 23 healthy male volunteers in a randomized cross-over study with 1 week washout interval.The plasma concentrations of losartan and EXP3174 were determined by HPLC-MS/MS and HPLC-FLU.The pharmacokinetic parameters were calculated and statistically analyzed by WinNonlin 6.0 software.ResultsThe pharmacokinetic parameters of losartan and EXP-3174 of test and reference preparation were as fllows: For losartan, Cmaxwere (244.8561±86.9741) ng/mL, (266.8621 ±115.5986) ng/mL; AUC0-twere (451.4±151.8) ng/(h·mL), (459.4±163.7) ng/(h·mL); AUC0-∞were (469.8±155.1) ng/(h·mL), (477.9±166.2)ng/(h·mL); t1/2were (1.55 ±0.32) h, (1.65±0.37) h; Tmaxwere (1.09±0.62) h, (1.25±0.75) h.For EXP3174, Cmaxwere (399.4±100.5) ng/mL, (426.8±132.6) ng/mL; AUC0-twere (3231± 1064) ng/(h·mL), (3152±1058) ng/(h·mL); AUC0-∞were (3458±1152) ng/(h·mL), (3408±1061) ng/(h·mL); t1/2were (6.86±2.25)h, (5.77±1.47) h; Tmaxwere (3.48±0.89) h, (3.13±0.69) h.ConclusionTest and reference drugs of losartan potassium are bioequivalent.
Losartan; EXP3174; HPLC-MS/MS; HPLC-FLU; Bioequivalence
R917
:B
:1671-8194(2013)02-0003-03
*通讯作者:E-mail:jjin@actavis.cn
