2型糖尿病合并微量蛋白尿患者颈动脉CDFI超声表现与实验室检查的相关性
2013-06-12张宗华
张宗华
(天津市中医药研究院附属医院功能检查科,天津 300121)
合并微量蛋白尿(microalbuminuria,MA)的2型糖尿病(type2 diabetes mellitus,T2DM)患者是早期糖尿病肾病的表现[1],不仅局限于肾脏的微血管改变,同时对全身血管造成损害,尤以动脉粥样硬化明显[2]。糖尿病人群中动脉粥样硬化的患病率较高,病情进展快[3],了解其易患因素尤为重要。笔者重点研究T2DM合并MA患者颈动脉粥样硬化的彩色多谱勒(CDFI)超声表现与实验室检查的关系。
1 对象与方法
1.1 研究对象
选择2011年6月至2012年10月在天津市中医药研究院附属医院糖尿病科住院的T2DM患者178例,均符合1999年WHO糖尿病诊断标准。排除1型糖尿病、高血压、心脏瓣膜病、冠心病、心功能不全、肾功能不全者。将178例患者按尿白蛋白排泄率(UAER)分为2组,UAER≥30~300 mg·24 h-1者为合并MA组(T2DM1组,104例),男49例,女55例,年龄43~82(59.16±11.87)岁,病程0.4~28.6(8.64±3.65)年;UAER<30 mg·24 h-1者为不合并MA组(T2DM2组,74例),男38例,女36例,年龄31~79(57.65±9.93)岁,病程0.2~26.4(7.42±3.57)年。2组性别、年龄及病程等方面比较差异均无统计学意义(均P>0.05)。
1.2 主要仪器及检测方法
应用PHILIPS IE33彩色多普勒超声诊断仪,线阵宽频探头频率为3~12 MHz,选择仪器预设的颈动脉为检查条件。患者取仰卧位,静息状态下,横纵结合扫查颈动脉,二维观察测量管腔内径、内-中膜厚度(IMT)、管壁斑块情况(有无、位置、大小、回声等)。
颈动脉IMT测量方法:在颈总动脉(距分叉前1 cm处)、分叉部、颈内动脉(窦部末端1 cm处)分别测量后壁IMT值,为内膜交界面与外膜交界面间垂直的距离,均测量3次,取其平均值,测量时避开斑块。颈总动脉IMT>1.0 mm、分叉处>1.2 mm为增厚。斑块标准:局部IMT增厚>1.5 mm,突入管腔,范围清晰。据斑块声学特性将其分为低/等回声(低于/等于周围的胸锁乳突肌)、强回声(斑块钙化产生的强反射,可伴后方声影)及混合回声斑块(回声高低不等,杂乱不均匀)。
CDFI检测:观察血流充盈情况、方向及色彩,测量血流速度。
实验室检查:包括餐后2 h血糖(2 hPG)、空腹血糖(FPG)、UAER、尿酸(URIC)、血肌酐(CREA)、糖化血红蛋白(HbA1c)、血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)等指标。
1.3 统计学方法
2 结果
2.1 2组IMT测量结果的比较
2组患者颈动脉斑块检出数目及斑块回声比较差异均无统计学意义(χ2=0.645,P>0.05)。斑块检出率排序为低/等回声>混合回声>强回声(P<0.05)。T2DM1组IMT厚度高于T2DM2组(P<0.05)。见表1。
2.2 2组实验室各项指标的比较
T2DM1组BMI、UAER、2 hPG、CREA、HbA1c、TC均高于T2DM2组(均P<0.05)。2组FPG、URIC、TG、LDL、HDL比较差异均无统计学意义(均P>0.05)。见表2。
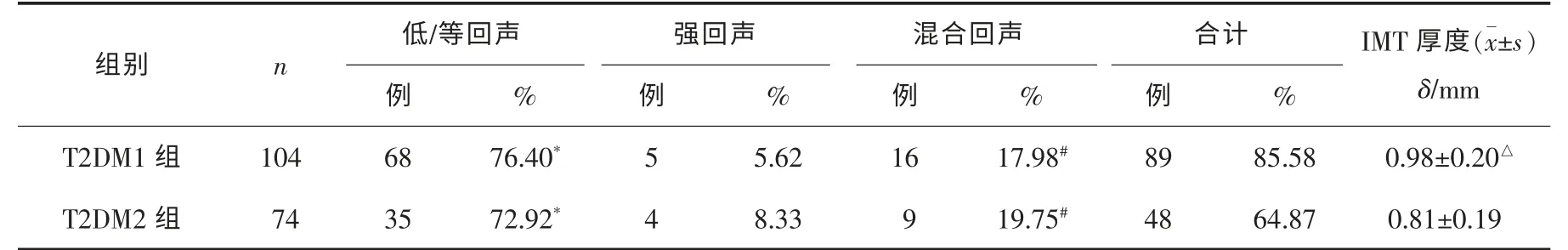
表1 2组患者斑块情况的比较
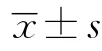
表2 2组实验室指标的比较
2.3 Pearson相关分析
Pearson相关分析结果:IMT与UAER、CREA、HbAlc及病程呈正相关(r=0.315、0.320、0.463及0.354,均P<0.05)。多元线性回归分析结果:病程、UAER、HbAlc是IMT增厚的独立预测因子(r=0.362,0.240、0.395,均P<0.05)。
3 讨论
T2DM出现微量蛋白尿,即UAER为30~300 mg·24 h-1,是糖尿病肾病早期改变,难用常规方法检测出来。肾脏血流动力学异常是T2DM合并MA早期的重要特点,表现为高灌注状态,肾血管内皮损伤及肾小球损伤。在肾脏微血管损害的同时,也预示着全身性血管的破坏,增加了动脉管壁对脂质微粒的通透性,使血管IMT增厚、粥样斑块形成。T2DM合并动脉硬化时,主要侵犯主动脉、冠状动脉、脑动脉、肾动脉及肢体动脉等[4]。在全身动脉系统中,颈动脉粥样硬化斑块最容易观察,CDFI超声是评价颈动脉斑块最方便且无创的方法。颈动脉分叉处至颈内外起始部是斑块好发部位。低回声斑块含有大量脂类物质的纤维脂肪,含细胞较少,使高低密度脂蛋白血症、斑块溃疡和脑缺血风险加大;等回声斑块是以胶原蛋白为主的纤维斑块,颈总动脉的斑块多为等回声纤维斑块;强回声斑块是斑块钙化所致;混合回声斑块回声杂乱,纤维帽存在蜕变可能,易引起血小板凝聚、血栓形成,有造成栓塞的潜在风险,发生暂时性脑缺血或脑卒中的概率较均值回声斑块高[5]。本研究结果显示,T2DM合并MA患者颈动脉斑块检出以低/等回声斑块为主,有学者认为,低/等回声斑块和混合回声斑块是不稳定斑块,是引起脑出血及脑梗死等脑血管病变的主要危险因素[6]。
本研究结果表明,合并MA的T2DM患者颈动脉IMT增厚更明显,具有更高的IMT值及动脉粥样硬化斑块数。T2DM本身是动脉硬化的危险因素,当合并MA时更使动脉硬化的危险性加大[7]。实验室检查中,T2DM1组2 hPG、UAER、CREA、HbAlc及TC指标均高于T2DM2组(均P<0.05),表明合并MA的T2DM患者血糖及血脂控制不理想,血管内皮损伤更明显,血管通透性增加,更容易出现动脉粥样硬化及斑块形成。HbAlc反映的是体内糖基化的终末产物,可以反映中长期血糖水平,是微血管硬化病变的重要病理因素[8]。当HbAlc及TC增高时,机体可发生多种代谢异常,导致蛋白质非酶糖化终产物不可逆性地增高,随着病程延长,蛋白质非酶糖化终产物在组织中聚集,使糖尿病患者发生大血管病变。本研究中的Pearson相关分析结果显示:UAER、CREA及病程与IMT呈正相关,表明当病程越长,UAER、CREA指标越高时,IMT增厚越明显,发生颈动脉粥样硬化及斑块形成的可能性越大。
综上所述,CDFI超声能准确地检出T2DM患者颈动脉IMT及粥样斑块,当合并MA时,提示糖尿病肾病的早期病变;在肾脏微血管损害的同时,也预示着全身性血管的破坏;颈动脉IMT增厚与UAER、CREA、HbAlc及病程呈正相关。可指导临床对糖尿病肾病患者及颈动脉粥样硬化做到早诊断、早治疗。
[1]赵建国.脑梗死[M].北京:人民卫生出版社,2006:53-65.
[2]陆再英,钟南山.内科学[M].北京:人民卫生出版社,2008:770-793.
[3]唐杰,温朝阳.腹部和外周血管彩色多普勒诊断学[M].北京:人民卫生出版社,2007:143-168.
[4]孙峰雷.糖尿病与心血管疾病[M].2版.济南:山东科学技术出版社,2007:262.
[5]Dinneen S F,Gerstein H C.The association of microalbuminuria and mortality in non-insulin-dependent diabetes mellitus.A systematic overview of the literature[J].Arch Intern Med,1997,157(13):1413-1418.
[6]杨毅军.颈动脉粥样硬化斑块与相关因素的探讨[J].临床超声医学杂志,2009,11(1):34-36.
[7]韩玲玲,张翠玲.2型糖尿病患者颈动脉内膜增厚及其危险因素[J].中国实验诊断学,2004,2(1):61-62.
[8]欧阳娟,姜傥.肾脏的损伤性诊断[J].中华检验医学杂志,2005,28(8):877-880.
