胃癌组织和循环miR-21与胃癌伊立替康敏感性关系的初步研究
2013-06-09徐登诚刘宝瑞沈洁
徐登诚刘宝瑞沈洁
1.解放军第452医院内科,四川 成都 610021;
2.南京大学医学院附属鼓楼医院肿瘤中心,江苏 南京 210008
胃癌组织和循环miR-21与胃癌伊立替康敏感性关系的初步研究
徐登诚1,2刘宝瑞2沈洁2
1.解放军第452医院内科,四川 成都 610021;
2.南京大学医学院附属鼓楼医院肿瘤中心,江苏 南京 210008
背景与目的:肿瘤组织和细胞中的miR-21先后被证实与肿瘤对化疗药物的敏感性有关,高表达miR-21提示肿瘤对多种化疗药物不敏感。外周血蕴含丰富的肿瘤信息,为个体化药物治疗提供了新的检测来源。本研究初步探讨胃癌组织和血浆循环miR-21表达水平与胃癌铂类药物和伊立替康敏感性之间的关系。方法:系统收集35例经病理确诊的新鲜人胃癌标本,采用三维微组织块培养法行两种药物的体外敏感试验;实时荧光定量PCR检测血浆和对应胃癌石蜡组织中miR-21表达水平。结果:血浆miR-21与对应肿瘤组织miR-21呈正相关(rho=0.736, P<0.001)。血浆miR-21水平与性别、年龄、病理类型、分化程度、淋巴结转移、TNM分期、肿瘤部位无统计学相关性,但是Ⅱ期和Ⅲ期的miR-21水平较Ⅰ期有偏高的趋势。铂类药物敏感组与耐药组肿瘤组织miR-21相对表达量分别为1.32(95%CI:0.73~1.90)和4.06(95%CI:1.71~6.41),差异无统计学意义(P=0.004);铂类药物敏感组与耐药组血浆miR-21相对表达量分别为5.25(95%CI:0.14~10.64)和5.82(95%,差异无统计学意义CI:2.27~9.37),差异无统计学意义(P=0.19)。伊立替康敏感组与耐药组肿瘤组织miR-21相对表达量分别为1.09(95%CI:0.65~1.54)和4.94(95%CI:2.44~7.44),差异无统计学意义(P<0.001);伊立替康敏感组与耐药组血浆miR-21相对表达量分别为1.86(95%CI:1.08~2.64)和12.42(95%CI:3.14~21.70)差异无统计学意义(P=0.001)。结论:血浆循环miR-21与对应肿瘤组织miR-21水平呈显著正相关,在一定程度上能反映肿瘤组织miR-21的水平。血浆miR-21水平与新鲜胃癌组织对伊立替康的敏感性呈负相关,肿瘤组织miR-21水平与新鲜胃癌组织对伊立替康和铂类药物的敏感性呈负相关。
胃癌;三维微组织块培养法;循环miR-21;铂类;伊立替康
微小RNA(microRNA,miRNA)是一类长约19~24 nt的非编码单链小RNA分子,在转录后通过降解mRNA或者抑制mRNA翻译而调控蛋白的表达。miRNA调控细胞周期、分化等细胞基本功能,并参与调控生物体的生长发育及多种疾病发生、发展过程。研究发现,miRNA的表达谱具有明显的组织特异性及阶段特异性,肿瘤组织具有特殊的miRNA表达谱[1]。在肿瘤组织,紊乱的miRNA表达包括抑癌miRNA的下调与促癌miRNA的上调等,参与了肿瘤发生、发展[2]。
通过对肿瘤miRNA表达谱的研究发现,miR-21在多种肿瘤中高表达。miR-21是肿瘤领域研究最为成熟的小RNA,被认为是oncomiR。胃癌相关研究也提示,miR-21在胃癌组织不仅表达较正常组织升高,同时也是预后的指标之一[3-4]。在药物敏感性方面,肿瘤组织和细胞中的miR-21先后被证实与肿瘤对健择、紫杉类、蒽环类和氟尿嘧啶类等药物敏感性有关[5-6],miR-21高表达提示肿瘤对多种化疗药物不敏感。大样本研究提示,肿瘤组织miR-21高表达结肠腺癌患者从化疗获益可能性较小[7]。
近年来的研究也证实肿瘤患者与健康人群循环miRNA表达谱不同。这为循环miRNA作为无创性诊断和预后的肿瘤标志物提供了依据。循环肿瘤相关miRNA在血液中的状态包括游离miRNA、外泌小体exosomes、微囊(microvesicles,MVs),并在一定程度上能反映肿瘤的信息。2010年,日本学者研究发现胃癌患者循环miR-21表达显著升高(P=0.006)[8],循环miR-21在胃癌中具有肿瘤指标的潜在价值。
因此,本研究以胃癌患者组织和循环miR-21作为主要研究对象,同步分析循环miR-21和对应胃癌组织中miR-21之间的相关性,并初步分析胃癌组织和循环miR-21与胃癌新鲜组织对铂类药物和伊立替康敏感性之间的关系,为循环miR-21作为药物敏感性预测生物标志提供初步理论依据。
1 资料和方法
1.1 研究对象
收集2011年1月—2011年12月在南京大学医学院附属鼓楼医院普外科手术切除的新鲜胃癌标本(35例)和对应术前血样(35例)共70份,肿瘤经病理确诊为胃癌。具体收集方法为:①从手术室取得新鲜胃癌标本,并将肿瘤组织分为2部分,一部分置入含有100 U/mL青霉素和100 U/mL链霉素的0.9%NaCl溶液中,另一部分置入4%的中性甲醛溶液中。在4 ℃条件下,30 min内将标本送至实验室并立即进行体外药敏实验;用4%的甲醛溶液固定标本24 h后,按常规石蜡包埋技术进行胃癌石蜡标本的制作,用于病理学观察和miR-21基因检测。②麻醉前采集新鲜血样4 mL,置于紫色抗凝管中。将标本放入冰盒中尽快运到肿瘤实验室。二步离心法分离血浆,加入TRIzol LS,-80 ℃保存,用于后续循环miR-21基因检测。
1.2 新鲜胃癌组织药物敏感实验
采用Furukawa等[9]创建的模拟体内实体瘤生长情况的三维微组织块培养法(histoculture drug response assay,HDRA)对新鲜胃癌组织进行药物敏感实验。药物测试浓度(test drugconcentration,TDC)参考其在人体内的血浆峰浓度设定:铂类浓度为20 μg/mL[10],伊立替康浓度为20 μg/mL[10]。每个标本加入不同受试药物设有8个复孔和8个对照孔。药物对肿瘤组织的抑制率=(1-T/C)×100%,其中T为实验组每克肿瘤组织的A540nm,C为对照组每克肿瘤组织的A540nm。定义每种受试药物8孔抑制率的平均值为该药的最终抑制率。以抑制率的平均值作为敏感组与耐药组分界点,铂类抑制率>52.02%定义为敏感,≤52.02%定义为耐药;伊立替康抑制率>47.67%定义为敏感,≤47.67%定义为耐药。
1.3 胃癌石蜡标本miRNA的提取及逆转录
将4%的甲醛溶液固定后的胃癌标本按常规石蜡包埋技术进行肿瘤石蜡标本的制作。每个标本切取7 μm厚度的石蜡切片7张,行常规HE染色,在高倍显微镜下圈划出肿瘤细胞区域,确保肿瘤细胞占80%以上。刮取圈定的肿瘤细胞入600 μL的无酶离心管中,加入200 μL的裂解液(10 mmol/L Tris/HCl,0.1 mmol/L EDTA,2%SDS),60 ℃过夜。加入20 mg/L蛋白酶K,60 ℃,震荡15 min;300 μL酚:氯仿(V∶V=6∶1)抽提;等体积异丙醇和3 mol/L醋酸钠沉淀;70%乙醇洗涤RNA;空气干燥后,加无RNA酶水溶解;取1 μL在核算定量仪上进行定量后,将剩余RNA反转录成cDNA(采用ABI公司的TaqMan MicroRNA逆转录试剂盒进行逆转录,具体步骤见说明书)。RNA提取与逆转录均设有阳性及阴性对照。
1.4 血浆miR-21的提取及逆转录
血浆和TRIzol LS的混合体系用力震荡均匀后,室温静置15 min,加入1/5体积的氯仿抽提,两倍体积异丙醇和3 mol/L醋酸钠沉淀;用70%乙醇洗涤RNA;空气干燥后,加入无RNA酶水溶解;取1 μL在核酸定量仪上进行定量后,将剩余RNA反转录成cDNA(采用ABI公司的TaqMan MicroRNA逆转录试剂盒进行逆转录,具体步骤见说明书)。RNA提取与逆转录均设有阳性及阴性对照。
1.5 实时荧光定量RT-PCR进行miR-21定量
PCR反应体系总体积为12.5 μL,含cDNA 2.5 μL,Taqman Universal Master MixⅡ(ABI产品号:4440038) 6.25 μL,引物和探针Mix 0.625 μL,用灭菌双蒸水定容至12.5 μL。在ABI7900型实时荧光定量PCR仪上进行检测,PCR循环参数为:50 ℃,2 min;95 ℃预变性10 min,95 ℃变性15 s、60 ℃退火、延伸60 s,共40个循环,分析其Ct值。每个样本、每个基因设有3个复孔,以U6为内参,以商品化的阳性对照作为校正(calibrator),以灭菌双蒸水为阴性对照。MiR-21和U6引物和探针均购自ABI公司(序列号如下:miR-21:ABI000387; U6;001093)。采用2-△△Ct公式计算miR-21相对表达量[11]。
1.6 统计学处理
采用SPSS 16.0 (SPSS Inc,Chicago,Illinois,USA)统计软件对数据进行分析。使用Mann-Whitney U检验比较患者不同性别、年龄、淋巴结转移与铂类药物、伊立替康抑制率、肿瘤miR-21、循环miR-21水平的相关性,使用Kruskal-Wallis H检验比较患者不同病理类型、分化程度、肿瘤部位、TNM分期与铂类药物、伊立替康抑制率、肿瘤miR-21、循环miR-21水平的相关性。采用Student-t检验(方差齐性)和Mann-Whitney U检验(方差非齐性)分析铂类和伊立替康敏感组与耐药组的miR-21水平的差异。P<0.05为差异有统计学意义。
2 结 果
2.1 患者资料
35例患者平均年龄为63岁,年龄范围32~80岁,其中男性28例(80%),女性7例(20%)。病理类型以胃腺癌为主,共29例(83%);中分化7例(20%),低分化16例(46%),中低分化12例(34%)。26例(74%)有淋巴结转移。Ⅰ、Ⅱ期患者分别为4例(11%)和8例(23%),Ⅲ期患者为23例(66%),无Ⅳ期患者。具体临床病例参数(表1)。
2.2 35例新鲜胃癌组织的铂类和伊立替康的药敏结果
铂类药物平均抑制率为52.02%(11.25%~86.23%),伊立替康平均抑制率为47.67% (2.34%~89.42%)。新鲜肿瘤组织对铂类药物的敏感性均与年龄(P=0.59)、性别(P=0.18)、病理类型(P=0.87)、分化程度(P=0.12)、淋巴结转移(P=0.05)、肿瘤部位(P=0.05)无显著相关性,但与肿瘤TNM分期相关(P=0.01),分期越早对铂类药物越敏感(54.25% vs 41.01% vs 38.93%)。新鲜肿瘤组织对伊立替康的药物敏感性均与年龄(P=0.86)、性别(P=0.34)、病理类型(P=0.57)、分化程度(P=0.30)、淋巴结转移(P=0.32)、肿瘤部位(P=0.51)、TNM分期(P=0.28)无显著相关性。
2.3 肿瘤石蜡组织miR-21定量
35例标本的石蜡组织中均成功检测出miR-21表达。miR-21相对于内参U6的平均表达量为2.41(0.01~16.12),且与性别、年龄、病理类型、分化程度、淋巴结转移、TNM分期、肿瘤部位无显著相关性(表1)。但是Ⅱ期和Ⅲ期的miR-21水平较Ⅰ期有偏高的趋势。
2.4 血浆miR-21定量
35例标本的血浆中均成功检测出miR-21表达。miR-21相对于内参U6的平均表达量为5.48(0.03~52.41),且血浆miR-21与对应肿瘤组织miR-21呈正相关(rho=0.736, P<0.001,图1)。血浆miR-21水平与性别、年龄、病理类型、分化程度、淋巴结转移、TNM分期、肿瘤部位无显著相关性(表1),但是Ⅱ期和Ⅲ期的miR-21水平较Ⅰ期有偏高的趋势。
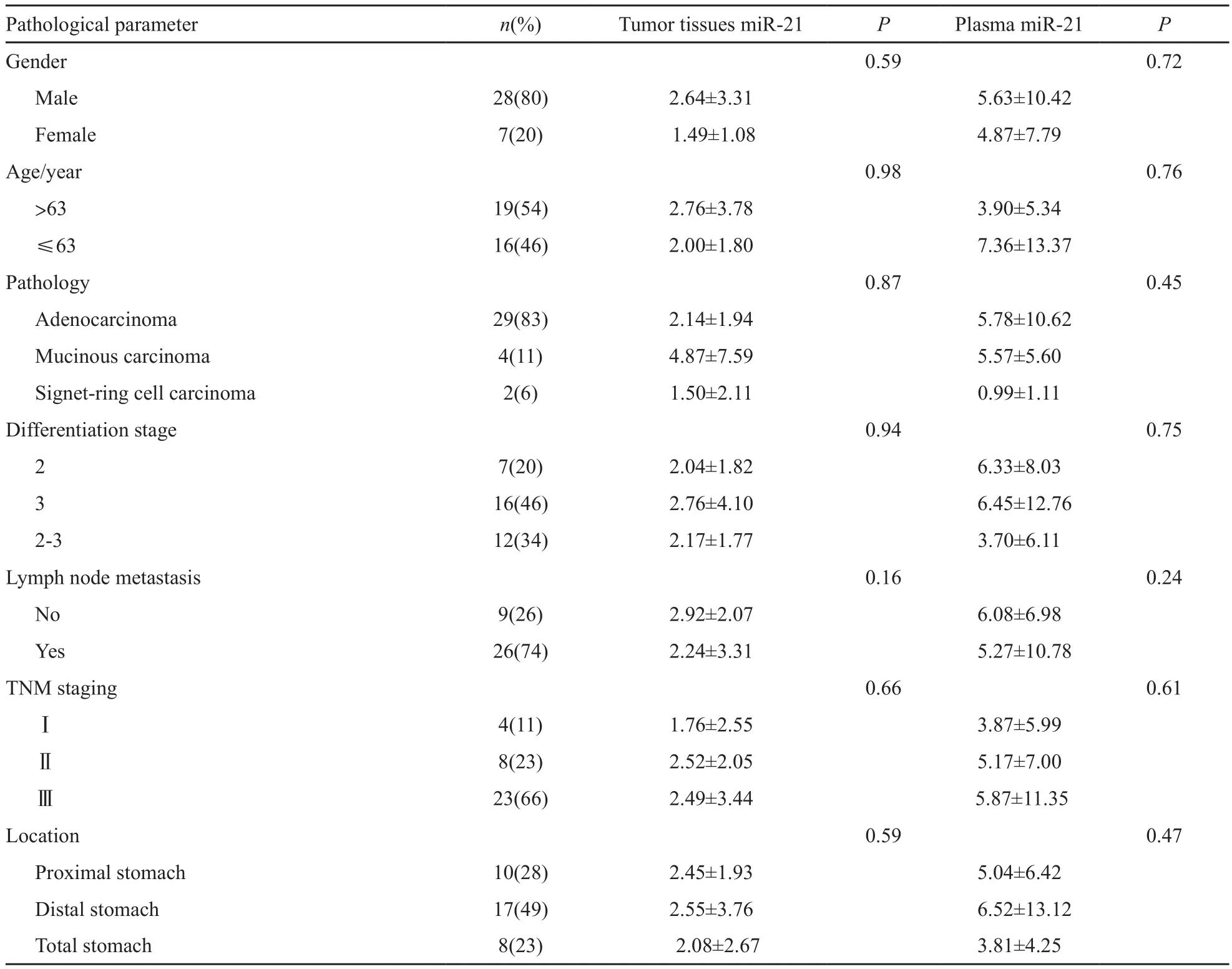
表 1 35 例患者临床病理参数与miR-21水平关系Tab. 1 The expression of miR-21 and clinical characteristics
2.5 血浆和肿瘤组织miR-21水平与新鲜胃癌组织对铂类药物和伊立替康敏感性关系
按照所划分的界限,铂类药物敏感组为21例,耐药组为14例;伊立替康敏感组为23例,耐药组为12例。铂类药物敏感组与耐药组肿瘤组织miR-21相对表达量分别为1.32(95% CI:0.73~1.90)和4.06(95%CI:1.71~6.41) (P=0.004,图2A);铂类药物敏感组与耐药组血浆miR-21相对表达量分别为5.25(95%CI:0.14~10.64)和5.82(95%CI:2.27~9.37) (P=0.19)。伊立替康敏感组与耐药组肿瘤组织miR-21相对表达量分别为1.09(95%CI:0.65~1.54)和4.94(95%CI:2.44~7.44) (P<0.001,图2B);伊立替康敏感组与耐药组血浆miR-21相对表达量分别为1.86(95%CI:1.08~2.64)和12.42(95%CI:3.14~21.70) (P=0.001,图2C)。血浆miR-21水平与新鲜胃癌组织对伊立替康的敏感性呈负相关,肿瘤组织miR-21水平与新鲜胃癌组织对伊立替康和铂类药物的敏感性呈负相关。

图 1 血浆miR-21与对应肿瘤组织miR-21表达水平呈正相关Fig. 1 Circulating miR-21 was positively correlated with tumor miR-21 in corresponding samples

图 2 肿瘤组织和血浆miR-21水平与新鲜胃癌组织对铂类药物和伊立替康敏感性关系Fig. 2 The expression of tumor and circulating miR-21 and the chemosensitivity of platinum and irinotecan
3 讨 论
分子标志指导下的个体化疗是当前恶性肿瘤药物治疗的主流方向[12]。由于肿瘤进展及治疗过程中新的遗传学、表观遗传学等的改变将使恶性肿瘤生物学发生变化,从而使得药物敏感性改变,导致肿瘤治疗的困难性增加。实时检测个体化化疗相关标志并据此选择化疗方案是未来个体化疗研究方向。循环miRNA是外周血肿瘤标志物新秀,能够用于肿瘤诊断与预后,但是作为药物疗效预测指标鲜有相关报道。本项目选择在肿瘤研究领域较为公认的具有诊断、预后价值并与化疗预后相关的miR-21,通过同步分析循环miR-21与对应肿瘤组织miR-21之间的相关性,初步探讨循环miR-21与胃癌铂类药物和伊立替康药物敏感性的相关性。
目前对肿瘤miRNA表达谱的研究发现,miR-21在多种肿瘤中高表达,包括乳腺癌、胶质瘤、前列腺癌、肝细胞癌、胃癌和肠癌等,而且在肿瘤组织的研究中发现,高表达miR-21提示肿瘤对多种化疗药物不敏感。本研究也发现,肿瘤组织中miR-21高表达的标本出现铂类药物和伊立替康的抵抗。其潜在机制可能为miR-21能够负性调控PTEN、PDCD4和hMSH2等抑癌基因的表达,从而调控细胞周期以及增殖相关信号通路,并能促进细胞迁移;miR-21能够下调Cdc25A,负性调控细胞周期G1/S期转变,并且参与了DNA损伤修复相关的G2/M期检查点19,从而表现为对引起DNA损伤的药物抵抗。潜在具体机制正在进一步研究中。
在临床实践操作中,很多肿瘤在确诊时已经无法接受手术治疗,无法获得肿瘤标本。穿刺活检虽能提供部分标本,但获得的肿瘤组织量少,要确保待检标本为肿瘤细胞占70%以上,有一定难度。同时穿刺活检虽然创伤性较手术小,也存在出血及组织损伤等风险,因而难以多次反复进行,不适合作为实时个体化疗待测标本。血液标本简便易获取,是临床最常用的标本。循环肿瘤细胞、血清和血浆均携带肿瘤组织信息,并可实时获取,为实时个体化检测提供了新的检测来源。Lawrie等[13]首次采用荧光定量PCR的方法发现大B细胞淋巴瘤患者血清miR-21、miR-155和miR-210表达水平上升。Mitchell等[14]与Chen等[15]分别对循环miRNA进行了系统的研究发现循环miRNA普遍存在于健康个体与肿瘤患者,但表达谱不同,采用荧光定量PCR检测能在血清或血浆中对miRNA进行定量研究,为循环miRNA作为诊断和预后的无创性肿瘤标志物提供了依据。本研究通过肿瘤标本和外周血样品的同步比较,证实miR-21在外周血和对应肿瘤组织中的表达水平呈显著正相关,在一定程度上能反映肿瘤组织的信息。这为肿瘤标本不足的患者提供了新的检测来源。
目前循环miRNA在肿瘤诊断和预后判断方面已显示出卓越的敏感性及特异性,如血浆miR-106a/let-7a表达比值在胃癌诊断中受试者工作特征曲线(ROC)下面积高达0.879[8]。Ng等[16]的研究结果提示,大肠癌患者miR-92 ROC曲线下面积为0.885(敏感度为89%,特异度为70%),另一项研究联合miR-29a与miR-92a在肠癌诊断中ROC曲线下面积达0.883(敏感度为83.0%,特异度为84.7%)[17]。Hu等[18]发现血清miR-486、miR-30d、miR-1和miR-499表达水平是肺癌患者预后指标。然而在循环miRNA与药物敏感性方面,除小样本研究报道发现miR-21在多西他赛耐药的患者血清表达较高外(n=10,P=0.032),未见循环miRNA与化疗药物敏感性的相关报道。本研究首次证实循环miR-21与对应肿瘤组织miR-21水平呈显著正相关;胃癌组织中miR-21在伊立替康耐药和铂类药物耐药的患者中表达显著偏高,循环miR-21在胃癌伊立替康耐药的患者血浆中表达显著偏高,与伊立替康敏感性呈负相关。这为后续大样本临床研究的开展提供了客观的理论依据。当然,本研究未能证实循环miR-21在胃癌铂类耐药的患者血浆中表达显著偏高,这可能是由于血浆中存在的干扰因素较多,比如淋巴细胞分泌miRNA对肿瘤来源的miRNA的干扰、血液的稀释以及血浆miRNA的降解等。此外,本研究只是小样本初步探索,未能充分证实血浆miR-21与铂类药物敏感性的关系。
综上所述,本研究初步证实循环miR-21与对应肿瘤组织miR-21水平呈显著正相关,循环miR-21水平与新鲜胃癌组织对伊立替康敏感性呈负相关,miR-21在胃癌个体化治疗中具有潜在指导价值。
[1] ROSENFELD N, AHARONOV R, MEIRI E, et al. MicroRNAs accurately identify cancer tissue origin[J]. Nat Biotechnol, 2008, 26: 462-469.
[2] SOTIROPOULOU G, PAMPALAKIS G, LIANIDOU E, et al. Emerging roles of microRNAs as molecular switches in the integrated circuit of the cancer cell[J]. RNA, 2009, 15: 1443-1461.
[3] LI X, ZHANG Y, DING J, et al. Survival prediction of gastric cancer by a seven-microRNA signature[J]. Gut, 2010, 59: 579-585.
[4] CHAN S H, WU C W, LI A F, et al. miR-21 microRNA expression in human gastric carcinomas and its clinical association [J]. Anticancer Res, 2008, 28: 907-911.
[5] BAI H, XU R, CAO Z, et al. Involvement of miR-21 in resistance to daunorubicin by regulating PTEN expression in the leukaemia K562 cell line[J]. FEBS Lett, 2011, 585: 402-408.
[6] VALERI N, GASPARINI P, BRACONI C, et al. MicroRNA-21 induces resistance to 5-fluorouracil by downregulating human DNA MutS homolog 2 (hMSH2) [J]. Proc Natl Acad Sci U S A, 2010, 107: 21098-21103.
[7] SCHETTER A J, LEUNG S Y, SOHN J J, et al. MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma[J]. JAMA , 2008, 299: 425-436.
[8] TSUJIURA M, ICHIKAWA D, KOMATSU S, et al. Circulating microRNAs in plasma of patients with gastric cancers[J]. Br J Cancer, 2010, 102: 1174-1179.
[9] FURUKAWA T, KUBOTA T, HOFFMAN R M. Clinical applications of the histoculture drug response assay[J]. Clin Cancer Res, 1995, 1: 305-311.
[10] FUJITA Y, HIRAMATSU M, KAWAI M, et al. Histoculture drug response assay predicts the postoperative prognosis of patients with esophageal cancer[J]. Oncol Rep, 2009, 21: 499-505.
[11] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 2001, 25: 402-408.
[12] ONG F S, DAS K, WANG J, et al. Personalized medicine and pharmacogenetic biomarkers: progress in molecular oncology testing[J]. Expert Rev Mol Diagn, 2012, 12: 593-602.
[13] LAWRIE C H, GAL S, DUNLOP H M, et al. Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma[J]. Br J Haematol, 2008, 141: 672-675.
[14] MITCHELL P S, PARKIN R K, KROH E M, et al. Circulating microRNAs as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci U S A, 2008, 105: 10513-10518.
[15] CHEN X, BA Y, MA L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008, 18: 997-1006.
[16] NG E K, CHONG W W, JIN H, et al. Differential expression of microRNAs in plasma of patients with colorectal cancer: a potential marker for colorectal cancer screening[J]. Gut, 2009, 58: 1375-1381.
[17] HUANG Z, HUANG D, NI S, et al. Plasma microRNAs are promising novel biomarkers for early detection of colorectal cancer[J]. Int J Cancer, 2010, 127: 118-126.
[18] HU Z, CHEN X, ZHAO Y, et al. Serum microRNA signatures identified in a genome-wide serum microRNA expression profiling predict survival of non-small-cell lung cancer[J]. J Clin Oncol, 2010, 28: 1721-1726.
Circulating and tumor miR-21 could predict irinotecan sensitivity in gastric cancer
XU Deng-cheng1,2, LIU Bao-rui2, SHEN Jie2(1. Department of Internal Medicine, The people’s Liberation Army 452thHospital , Chengdu Sichuan 610021, China; 2. Cancer Center, Drum Tower Hospital of Nanjing University, Nanjing Jiangsu 210008, China)
SHEN Jie E-mail: shenjie2008nju@163.com
Background and purpose: Mir-21 has been demonstrated high expressed in many kinds of tumor tissues and cell lines. High expressed miR-21 leads to chemoresistance. Circulating miRNA is a novel biomarker for chemosensitivity prediction. The aim of our study was to investigate the role of plasma and tumor miR-21 levels as predictive biomarkers for irinotecan in gastric cancer. Methods: The histoculture drug response assay (HDRA) was used to determine irinotecan and cisplatin sensitivity on 35 freshly removed gastric tumor specimens. miR-21 expressions in tumor and plasma were determined by quantitative reverse transcription polymerase chain reaction. Results: Plasma miR-21 was closely correlated with corresponding miR-21 mRNA level in tumor tissues (rho=0.736, P<0.001) and was not correlated with sex, age, pathology type, differentiation, lymph node metastasis, TNM stage or tumor location. Patients with stage Ⅱ-Ⅲ had higher miR-21 levels. The tumor miR-21 expressions in cisplatinsensitive group and resistant group were 1.32 (95%CI: 0.73-1.90) and 4.06 (95%CI: 1.71-6.41)(P=0.004), respectively. The plasma miR-21 expressions in cisplatin-sensitive group and resistant group were 5.25 (95% CI: 0.14-10.64) and5.82 (95%CI: 2.27-9.37)(P=0.19). The tumor miR-21 expressions in irinotecan-sensitive group and resistant group were 1.09 (95%CI: 0.65-1.54) and 4.94 (95%CI: 2.44-7.44)(P<0.001), respectively. The plasma miR-21 expressions in irinotecan-sensitive group and resistant group were 1.86 (95%CI: 1.08-2.64) and 12.42 (95%CI: 3.14-21.70)(P=0.001). Conclusion: A significant correlation was observed between plasma and tumor miR-21 level. The low plasma miR-21 level could benefit from treatment with irinotecan. And low tumor miR-21 expression correlated with increased irinotecan and cisplatin response rate.
Gastric cancer; Histoculture drug response assay; Circulating miR-21; Cisplatin; Irinotecan
10.3969/j.issn.1007-3969.2013.09.009
R735.2
:A
:1007-3639(2013)09-0744-07
2013-07-02
2013-08-20)
沈洁 E-mail:shenjie2008nju@163.com
