CD64和T细胞亚群的表达在新生儿败血症中的价值
2013-06-08梁红英刘光辉程邦宁安徽医科大学儿科临床学院新生儿科合肥230051
梁红英,刘光辉,张 健,程邦宁(安徽医科大学儿科临床学院新生儿科,合肥 230051)
新生儿免疫功能尚未发育完善,容易发生感染尤其是败血症,由于新生儿败血症临床症状的多样性与非典型性,使早期诊断新生儿败血症成为难题,新生儿感染与感染途径、致病原及自身免疫力有关。如何能早期准确地诊断新生儿败血症及评价新生儿的细胞免疫功能,将对新生儿败血症的治疗及预后有重大的意义。本研究通过检测败血症新生儿与非感染新生儿CD64及CD3、CD4、CD8的表达情况,探讨新生儿外周血CD64及CD3、CD4、CD8的变化与新生儿败血症的关系,以期明确CD64在诊断新生儿败血症中的价值,并对新生儿细胞免疫功能进行评价,探讨细胞免疫与败血症的关系。
1 资料与方法
1.1 一般资料 以2012年4~9月安徽省立儿童医院新生儿科病房收治的新生儿作为研究对象,其中败血症组共30例(败血症者28例,败血症合并感染性休克者2例),血培养阳性者12例(大肠埃希菌3例、肺炎克雷伯杆菌4例、绿脓杆菌1例、表皮葡萄球菌1例、金黄色葡萄球菌2例、阴沟肠杆菌1例)。同时选取50例非感染患儿(吸入性肺炎、羊水咽下、单纯早产儿等)作为对照组。败血症组患儿胎龄(37.6±1.9)周,体质量(3 110.2±533.7)g,日龄(12.5±3.2)d;非感染组胎龄(38.0±1.6)周,体质量(3 108.1±592.7)g,日龄(12.2±3.0)d,两组胎龄、出生体质量及日龄差异均无统计学意义(P>0.05)。
1.2 纳入标准 新生儿败血症的诊断参考第四版《实用新生儿学》,败血症确诊的诊断指标[1]为:(1)具有临床表现,血培养或无菌体腔内培养出致病菌。(2)具有临床表现,如果血培养培养出条件致病菌,则必须与另一份血或无菌体腔内或导管头培养出同种细菌。满足以上任意一条者,都可以确诊为败血症。临床诊断指标为:对于血培养阴性的感染病例,(1)符合非特异性检查大于或等于2条,(2)血标本病原菌抗原或DNA检测阳性,可以诊断为临床败血症。非特异指标如下等:(1)具有败血症的临床表现,白细胞总数小于5×109/L或出生3d后大于20×109/L,或杆状核白细胞与多形核细胞之比大于或等于0.2。(2)具有易发生败血症的诱因及相应的临床表现,C反应蛋白(CRP)明显升高而无肺炎等其他可使之升高的疾病。排除标准:患有先天性免疫障碍性疾病及除外先天性畸形及遗传代谢性疾病者。
1.3 方法
1.3.1 标本收集 败血症组标本的采集:在确定感染且未用抗生素之前采集上肢静脉血2mL,分别进行CD64、CD3、CD4、CD8、CRP及血常规检测,同时做血培养;非感染组一次性采集上肢静脉血进行血常规及CRP、CD3、CD4、CD8及CD64检测。
1.3.2 CD64检测 全血100μL+20μL CD64-异硫氰酸荧光素标记试剂(美国贝克曼库尔特公司产品)混匀,加1mL溶血素,暗处放置15min后用流式细胞仪(美国贝克曼库尔特公司产品)分别测定淋巴细胞和粒细胞的CD64平均荧光强度(MFI),计算CD64指数。
1.3.3 CD3、CD4、CD8检测 采用美国 Beckman Coulter Epies-XL4型单激光4色流式细胞仪检测CD3、CD4、CD8,试剂及质控品均为Beckman Coulter公司配套产品。
1.3.4 血常规检测 使用Sysmex XE-5000全自动血液分析仪检测血常规。
1.3.5 CRP检测 采用散射比浊法检测CRP,试剂及其配套仪器购于深圳市国赛生物技术有限公司。
1.4 统计学方法 采用SPSS11.0软件进行数据分析,计量资料以±s表示,两组之间比较采用t检验,计数资料采用卡方检验,P<0.05为差异有统计学意义。绘制ROC曲线确定CD64的临界值,计算诊断败血症指标的灵敏度、特异度、阳性预测值和阴性预测值。
2 结 果
2.1 CD64、CRP、白细胞计数(WBC)、血培养在诊断新生儿败血症中的比较 见表1。败血症组的CD64表达明显高于非感染组,差异有统计学意义(P<0.01),败血症组的CRP高于非感染组,差异有统计学意义(P<0.01),两组之间 WBC差异无统计学意义(P>0.05)。
表1 CD64、CRP、WBC在诊断新生儿败血症中的比较(±s)
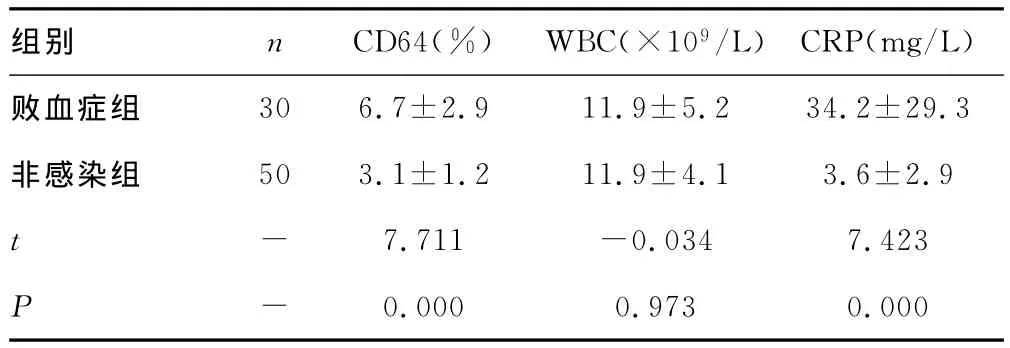
表1 CD64、CRP、WBC在诊断新生儿败血症中的比较(±s)
注:-表示无数据。
组别 n CD64(%) WBC(×109/L) CRP(mg/L)败血症组30 6.7±2.9 11.9±5.2 34.2±29.3非感染组 50 3.1±1.2 11.9±4.1 3.6±2.9 t- 7.711 -0.034 7.423 P - 0.000 0.973 0.000
2.2 CD64与CRP在诊断新生儿败血症中的敏感性和特异性比较 将两组数据作ROC曲线,计算得CD64曲线下面积为0.903,CD64临界值为3.45%,诊断败血症的敏感度为87.0%,特异度为88.0%,阳性预测值为83.9%,阴性预测值91.8%;CRP曲线下面积为0.813,临界值为80mg/L,诊断败血症的敏感度为83.3%,特异度为70.0%,阳性预测值为70.6%,阴性预测值71.4%。
2.3 外周血中性粒细胞CD64与血培养在诊断新生儿败血症中的评估 见表2。30例败血症患儿中,CD64的检测阳性率为86.7%(26/30),血培养中 CRP检测阳性率为40.0%(12/30),CD64与血培养中CRP诊断新生儿败血症比较差异有统计学意义(P<0.01)。
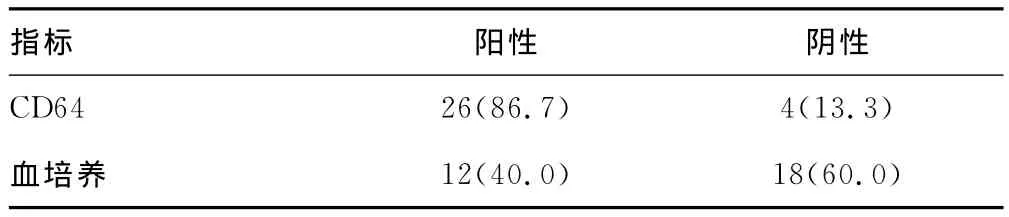
表2 2项检测阳性率比较[n(%)]
2.4 两组新生儿CD3、CD4、CD8的比较 见表3。败血症组的CD3、CD4低于非感染组,差异有统计学意义(P<0.01),两组CD8差异无统计学意义(P>0.05)。
表3 各组间CD3、CD4、CD8的比较(±s,%)
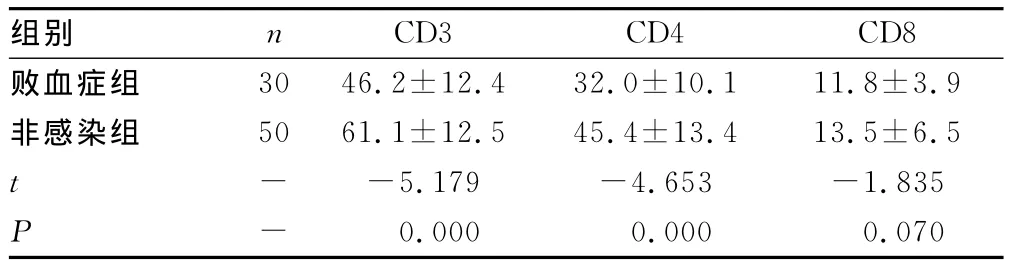
表3 各组间CD3、CD4、CD8的比较(±s,%)
注:-表示无数据。
组别 n CD3 CD4 CD8败血症组30 46.2±12.4 32.0±10.1 11.8±3.9非感染组 50 61.1±12.5 45.4±13.4 13.5±6.5 t- -5.179 -4.653 -1.835 P- 0.000 0.0000.070
3 讨 论
目前感染仍是我国新生儿常见疾病与引起新生儿死亡的重要原因之一[2],其中重症感染,如败血症在新生儿监护室中仍有较高的发生率和病死率,在重症监护室的患者中,至少有1/3~1/2的患者最终被诊断为败血症[3]。血培养虽是诊断败血症的金标准,但阳性率低,且病原分离所需时间长,不能达到早期诊断的目的。因此,需要寻找敏感、可靠、能早期诊断败血症的理想指标[4],若能早期诊断新生儿败血症将有利于改善其预后。近年来,中性粒细胞CD64表达在早期诊断新生儿败血症的价值得到了重视。
CD64即FcrR I,是免疫球蛋白(IgG)的高亲和力受体,正常生理情况下,CD64在中性粒细胞呈低水平表达,但当机体处于感染状态时,CD64的表达可增加5~10倍[5]。CD64可以作为早期诊断新生儿感染的有效指标[6]。研究发现CD64在败血症发生后0~24h内均保持明显升高,这个时间窗有利于早期诊断新生儿败血症,并且有助于判定感染的程度。本研究发现败血症组的CD64表达水平明显高于非感染组,说明CD64的表达与新生儿感染密切相关,并随感染程度的加重而升高,与张金萍等[7]研究结果相符。本研究结果显示,败血症组的CRP高于非感染组,CRP随感染的加重而升高,可以作为判断细菌感染的指标;但CRP是由胎儿肝脏产生的急性时相蛋白,是非特异性指标,对诊断新生儿败血症的临床价值较低[8]。本研究通过ROC曲线得出CD64曲线下面积为0.903,高于CRP,CD64临界值为3.45%时,CD64诊断新生儿败血症的灵敏度为87.0%,特异度为88.0%,阳性预测值83.9%,阴性预测值91.8%,说明CD64与CRP相比较而言,CD64是诊断新生儿败血症的更为敏感的特异性指标,与Choo等[9]研究结果相符。研究显示CD64与CRP相比而言,是早期诊断新生儿败血症更为可靠的单一指标。另外本研究发现两组间WBC的表达差异无统计学意义,说明WBC不能作为诊断新生儿败血症的特异指标。血培养虽然是诊断败血症的金标准,但是血培养阳性率低,本研究显示30例败血症患儿中,CD64的检测阳性率为86.7%,血培养的检测阳性率仅为40.0%,CD64的检测阳性率高于血培养,差异有统计学意义(P<0.01),说明CD64是能早期诊断败血症的敏感性指标。
在抗感染中淋巴细胞可被激活,从而启动免疫抵抗反应,淋巴细胞主要包括T淋巴细胞、B淋巴细胞及自然杀伤细胞。其中T淋巴细胞是最主要的免疫细胞,CD3代表T淋巴细胞总数,CD4代表T辅助细胞,CD8代表T抑制细胞,CD4、CD8细胞是重要的病毒、细菌清除细胞,T淋巴细胞的相互调节维持机体免疫平衡,病原体与宿主免疫系统的相互作用贯穿感染过程始终,并决定感染的发生、发展及结局。但病毒感染和长期反复慢性炎症可使体内CD4、CD8细胞减少,导致免疫功能降低,有研究发现窒息、缺氧导致T淋巴细胞亚群紊乱,不同胎龄的新生儿细胞T淋巴细胞亚群的变化不同,可影响其免疫功能[10-11]。本研究结果显示,新生儿败血症者外周血CD3、CD4较非感染组降低,说明T细胞功能不完善,不能有效辅助免疫细胞,导致重症感染时患儿细胞免疫功能低下,与邱丽影等[12]研究结果一致,说明重症感染患儿细胞免疫功能受到抑制,同时细胞免疫功能低下亦是新生儿发生重症感染的重要原因之一。
综上所述,通过联合测定CD64及T细胞亚群可早期及时准确地诊断新生儿败血症,并能评估患儿的细胞免疫状态,予以有效、合理的抗生素治疗及提高免疫力,将有助于患儿病情的缓解及改善预后。
[1] 邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].4版.北京:人民卫生出版社,2011:341-342.
[2] 魏克伦.我国新生儿感染现状与展望[J].中国实用儿科杂志,2011,26(1):1-2.
[3] Vincent JL,Rello J,Marshall J,et al.International study of the prevalence and outcomes of infection in intensive care units[J].JAMA,2009,302(21):2323-2329.
[4] Ng PC,Lam HS.Diagnostic markers for neonatal sepsis[J].Curr Opin Pediatr,2006,18(2):125-131.
[5] Song SH,Kim HK,Park MH,et al.Neutrophil CD64expression is associated with severity and prognosis of disseminated intravascular coagulation[J].Thromb Res,2008,121(4):499-507.
[6] Genel F,Atlihan F,Gulez N,et al.Evaluation of adhesion molecules CD64,CD11band CD62Lin neutrophils and monocytes of peripheral blood for early diagnosis of neonatal infection[J].World J Pediatr,2012,8(1):72-75.
[7] 张金萍,陈超,杨毅.CD64在新生儿感染诊断中的临床意义[J].中华围产医学杂志,2006,9(5):320-324.
[8] Jaye DL,Waites KB.Clinical applications of C-reactive protein in pediatrics[J].Pediatr Infect Dis J,1997,16(8):735-746.
[9] Choo YK,Cho HS,Seo IB,et al.Comparison of the accuracy of neutrophil CD64and C-reactive protein as a single test for the early detection of neonatal sepsis[J].Korean J Pediatr,2012,55(1):11-17.
[10] 梅花,刘春枝,张亚星.缺氧缺血性脑病新生儿血清细胞因子及T淋巴细胞亚群的变化[J].中国新生儿科,2011,26(6):403-405.
[11] 张金萍,陈超,杨毅.新生儿感染时CD分子变化及临床意义[J].中国实用儿科杂志,2005,20(7):415-417.
[12] 邱丽影,任力群,资捷,等.感染性疾病新生儿淋巴细胞亚群的变化分析[J].中国优生与遗传杂志,2012,20(3):77-78.
