从制备血红蛋白肽的血渣中提取血红素
2013-05-15卫乐红时亚文姜无边陈石良
卫乐红,时亚文,姜无边,陈石良,*
(1.湖北奥彤生物制品科技有限公司,湖北孝感432600:2.湖北宝迪农业科技有限公司,湖北孝感432600)
我国有丰富的猪血资源,从猪血中可以得到超氧化物歧化酶(SOD)、凝血酶、血红素铁、蛋白粉等生化产品,如果能够得到充分的开发利用,将是一笔极其巨大的财富[1]。血红素的原料来源比较窄,一般是从动物的血液中提取,随着动物血液的开发应用,其价格不断上升。从制备超氧化物歧化酶或血红蛋白肽的血渣中提取,如果技术得当,生产血红素的成本可以大大降低。血红素是人体中血红蛋白的活性中心,其核心部位为镶嵌在卟啉环中心的二价铁离子,具有携氧能力[2]。血红素是暗紫色有光泽的细微针状结晶或黑褐到棕色颗粒,颜色随纯化溶剂的不同而略有区别。在干燥的固体状态下血红素比较稳定,但在有光和氧化物的存在下容易被破坏,对热比较稳定。能溶于酸性丙酮、碱性溶液、热醇等溶剂中,不溶于水、稀酸、醚和氯仿[3]。主要存在于动物的血液中,具有重要的生理功能和很高的实用价值,在医药、保健品、食品、精细化工、化妆品等行业有广泛的应用[4]。铁是一种重要的微量元素,血红素是一种重要的膳食铁来源,在西方饮食中,有三分之二的铁是由血红素提的,主要来源于肌红蛋白和血红蛋白[5]。
1 材料与方法
1.1 材料与仪器
新鲜红血球 宝迪农业科技有限公司恩彼事业部取来,通过水溶胀法溶血后用复合酶水解,上清液脱色喷雾干燥后即为血红蛋白肽,下层沉淀作为提取血红素的原料于4℃冰箱中储存备用;NaHSO3、盐酸、丙酮、无水乙醇、乙醚、醋酸钠均为分析纯 广东金华科技股份有限公司;氯化血红素标品为生化试剂 国药集团化学试剂有限公司。
紫外可见分光光度计 UV-VIS 745,上海舜宇恒平科学仪器有限公司;离心机 D275M,长沙湘智离心机仪器有限公司;电子天平 DJ-6002,福州华志科学仪器有限公司;分析天平 BSA 224S-CW,赛多利斯科学仪器,北京有限公司;电热鼓风干燥箱 DAG-9070A型,上海飞越实验仪器有限公司;定时电动搅拌器 JJ-1,江苏金坛市中大仪器厂。
1.2.1 酸性丙酮法提取血红素的工艺流程

1.2.2 单因素实验设计 取50g血渣,根据质量体积比加入不同体积的盐酸丙酮混合溶液,充分搅拌,6000r/min离心10min,血红素留在上清液中,取上清液。用2mol/L的NaOH调节上清液pH至5,并按体积比加入醋酸钠溶液搅拌均匀静置使血红素沉降,6000r/min离心10min,沉淀即为血红素。将沉淀分别用去离子水、无水乙醇以及乙醚洗涤两次,60℃烘箱干燥即可。分别设置酸酮比(1∶100、2∶100、3∶100、4∶100、5∶100)、料液比(1∶2、1∶3、1∶4、1∶5、1∶6)和搅拌时间(5、10、15、20、25min)三个单因素实验。
1.2.3 正交实验设计 选定盐酸丙酮体积比、料液比、搅拌时间进行单因素实验,在单因素实验的基础上确定正交实验的工艺条件,通过正交实验确定优化的提取工艺条件,每个实验重复3次,正交实验设计如表1所示。

表1 血渣中提取氯化血红素的正交实验设计Table 1 Coded values and corresponding actual values of the optimization factors in the orthogonal array design
1.2.4 血红素粗品的纯化 采用刘任民[6]等的方法稍有改动,粗血红素用0.1mol/L的NaOH充分溶解,6000r/min去掉沉淀,取上层溶液用1mol/L盐酸溶液调节pH至5,加入1g/100mL的醋酸钠,使血红素沉淀下来,离心取沉淀,用去离子水反复清洗3次,95%的乙醇清洗两次,乙醚清洗一次后60℃烘箱干燥即可。
1.2.5 血红素各项指标检测方法建立
1.2.5.1 血红素鉴定
a.显色反应:采用袁曦[7]等的方法,取血红素铁2mg,加0.1mol/L的氢氧化钠溶液2mL于热水中溶解,冷却后加20%的硫酸溶液8mL,混合均匀,即生成棕色沉淀。过滤后取滤液1mL,加入硫酸氢铵试剂数滴,摇匀,溶液显棕红即为血红素铁。取标准样品2mg,以同样的操作方法作为对比。
b.血红素的紫外扫描:分别取0.01g血红素标准品和样品血红素,用0.1mol/L的氢氧化钠溶解定容到100mL,用紫外可见分光光度计在200~800nm处扫描。
1.2.5.2 氯化血红素含量的检测
a.氯化血红素标准曲线的绘制:取一定量的氯化血红素标准品,105℃烘箱干燥4h以除去水分,精确称取20mg干燥好的标准品,用0.1mol/L的NaOH溶解,定容至 100mL 分别吸取 1.0、2.0、3.0、4.0、5.0mL置于100mL的容量瓶中,用0.1mol/L的NaOH溶液定容至刻度,摇匀。以0.1mol/L的NaOH为空白,与385nm处测定吸光值,绘制标准曲线为y=0.0758x-0.0008,R2=0.9998。
b.氯化血红素样品含量的测定:取经过105℃干燥至恒重的氯化血红素样品,研成粉末;精密称取适量样品,置于100mL烧杯中,加0.1mol/L的氢氧化钠溶液溶解,将溶液转移到 100mL容量瓶中,加0.1mol/L的氢氧化钠溶液至刻度,摇匀,过滤。取滤液10mL于100mL容量瓶中,用0.1mol/L氢氧化钠溶液稀释至刻度,摇匀,以0.1mol/L的氢氧化钠溶液为空白。在385nm波长处测定其吸光度A。代入回归方程即可求算氯化血红素的含量,酶解血渣中的氯化血红素含量为0.864g/100g,其血红素提取率计算公式如式(1)。

1.2.5.3 氯化血红素中铁含量的测定
a.原子吸收分光光度法测氯化血红素铁含量
标准溶液:按国标GB/T 5009.90-2003的方法进行测定,准确称量1g的精制铁粉,用硝酸溶解,然后用0.5N的硝酸溶液定容到1000L,此溶液相当于1mg/mL,分别量取 0.5、1、2、3、4mL 标准使用液于100mL的容量瓶中,用0.5N的硝酸定容摇匀,用原子吸收分光光度计测定,绘制标准曲线。
样品中铁含量的测定:精确称取均匀干燥的样品1、2、3与标准样品40mg,于100mL的烧杯中,加入混合酸消化液20mL,上盖表皿,置于可调功率电炉中消化,直至无色透明为止,加入几毫升去离子水,继续加热以除去多余的硝酸,待烧杯中溶液为2~3mL时,取下冷却,用去离子水洗并移于10mL的刻度管中,用去离子水定容到10mL。空白用相同体积的混合酸消化液消化,步骤与上相同。
b.磺基水杨酸法测血红素中铁含量
标准溶液的配制:准确称取0.7030g硫酸亚铁铵于100mL的烧杯中,加入50mL 1mol/L盐酸溶液,完全溶解后移入1L容量瓶中,再加入50mL 1mol/L,再用蒸馏水稀释至刻度,混匀。取6支100mL的容量瓶编号,分别用移液枪取 0、1、2、3、4、5mL 铁标准液于100mL容量瓶中,每份分别加入20%的磺基水杨酸7mL,然后加入1∶1的氨水2mL,使溶液由红色变为稳定的黄色,再过量1mL,稀释至刻度,摇匀。在分光光度计上选取最大吸收波长,λ=420nm,使用蒸馏水作为参比液,分别测定1~6号容量瓶吸光值,重复一次,然后取平均值,以测得的的吸光值为纵坐标,溶液浓度为横坐标,绘制标准曲线。
样品铁含量的测定:配置样品溶液,放入100mL的容量瓶中,按上述方法显色并测其吸光值,求出样品铁含量。
2 结果与分析
2.1 单因素实验
2.1.1 盐酸丙酮添加量对氯化血红素含量和提取率的影响 血红蛋白是由4分子的血红素和1分子的珠蛋白结合而成的,在酸性条件下,血红蛋白中原先不带电荷的埋藏在分子内部的组氨酸残基(PI=7.0),由于带有负电荷而暴露出来,此时血红素和珠蛋白的结合较为疏松,蛋白质在丙酮的作用下沉淀后血红素则留在溶液中[8]。料液比为5∶1,搅拌时间为20min,醋酸钠添加量与提取液体积比为1∶100的条件下,由表2可知不同的酸酮比对氯化血红素的含量有一定的影响,随着盐酸添加量的不断增加,血红素的含量和提取率持续上升,当酸酮比为3∶100时,得到的产品的含量和提取率都较高,分别达到了97.91%和63.50%。

表2 盐酸丙酮比对氯化血红素含量和提取率的影响Table 2 Effect of hydrochloric acid and acetone volume ratio on hemin purity and yield
2.1.2 料液比对氯化血红素的含量以及提取率的影响 提取过程中加入丙酮是为了溶出血红素并使蛋白质变性沉降下来,用量过少不能使蛋白质充分沉降,而用量过大料液比超过1∶6时,则产量不稳定,过滤困难[9]。在盐酸丙酮体积比为3∶100,搅拌时间为20min,醋酸钠添加量为1%的条件下,由表3可知:随着酸性丙酮添加量的加大,提取的样品的质量下降,这可能是因为丙酮的量增加,使珠蛋白沉降的更充分。当料液比为1∶5时,含量达到了最大值,再加大酸性丙酮的添加量时含量和提取率变化不大。

表3 料液比对氯化血红素含量和提取率的影响Table 3 Effect of solid-liquid ratio on hemin purity and yield
2.1.3 搅拌时间对氯化血红素的含量以及提取率的影响 在盐酸丙酮体积比为3∶100,料液比为1∶5,醋酸钠添加量为1%的条件下,由表4可以看出:搅拌时间在20min时所得的氯化血红素的含量和提取率都较高,时间延长到25min时,则变化不明显。
2.2 正交实验
在单因素实验的基础上,选取盐酸丙酮比、料液比、搅拌时间三个因素,采用正交设计表L9(34)进行三因素三水平的正交实验,结果见表5,在分析过程中以氯化血红素的含量与提取率为考察指标。

表4 搅拌时间对氯化血红素含量和提取率的影响Table 4 Effect of stirring time on hemin purity and yield
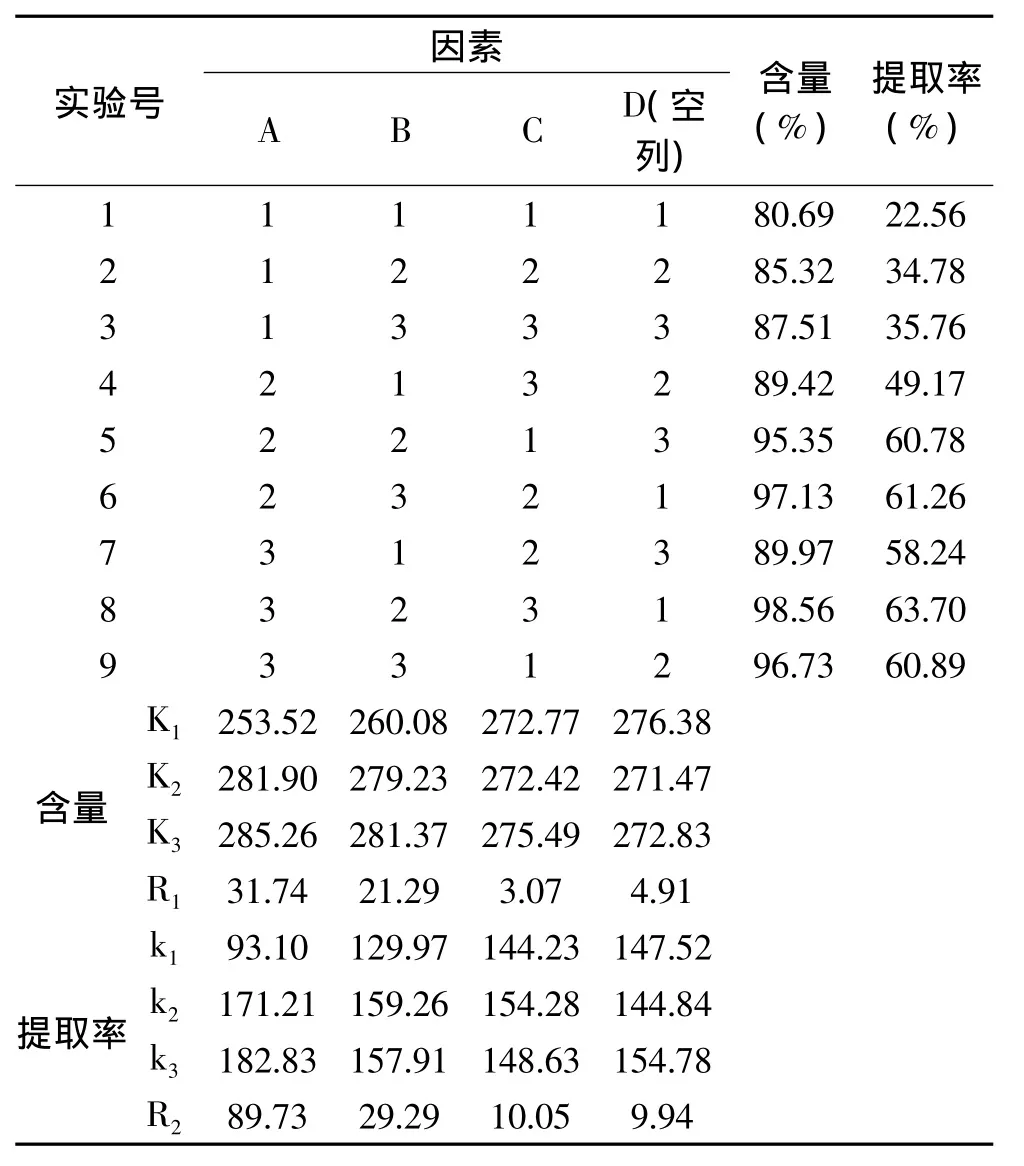
表5 工艺条件确定正交实验设计及结果Table 5 Orthogonal array design matrix and corresponding experimental results
由正交表5可知,各因素对氯化血红素的含量的影响次序是A>B>C,即盐酸丙酮的体积比>料液比>搅拌时间,其最优水平为A3B3C3。各因素对氯化血红素提取提取率的影响次序是A>B>C,即盐酸丙酮的体积比>料液比>搅拌时间,最优水平为A3B2C2。由于两个考察指标独立分析后得出的最佳工艺条件不同,需要对它们影响的主次顺序进行综合考虑以确定最后的最佳工艺,考虑到氯化血红素的提取率与其含量和样品的质量相关,且呈正比关系,故以氯化血红素的提取率为主要考虑因素。根据正交实验结果,对于因素B,即为料液比(v/v)为1∶5和1∶6时,2水平和3水平相差不大,考虑到有机试剂成本问题,选择B2比较合适。综合考虑,优化的工艺条件是 A3B2C2,即盐酸丙酮体积比为4∶100,酸性丙酮添加量为血渣体积的5倍,搅拌时间为20min。通过极差分析可得到因素C的R值小于空白列的R值,说明此因素对氯化血红素含量这一指标没有显著意义。
2.3 氯化血红素的鉴定
2.3.1 产品性状 所得产品肉眼观察为黑褐色,反射光下为钢蓝色的粉末状晶体,与参考文献[10]报道的氯化血红素性状一致;不溶于水、稀酸、醚、氯仿、及丙酮,溶于氢氧化钠水溶液、热醇或氨水中,在水中稳定,在有氧与光照条件下容易被破坏,与参考文献[11]的报道一致。
2.3.2 显色反应 见图1,左边试管为血红素标准样品,右边为样品,可以看出两个试管中溶液颜色都是浅棕色,外观性质一致,可以确定样品为氯化血红素。

图1 氯化血红素的显色反应Fig.1 Color yield properties of hemin
2.3.3 氯化血红素的紫外扫描图谱 从图2可以看出,对照品和供试品紫外可见光谱基本一致,最大吸收峰为410nm,与文献报道一致[12],可以判定所提取的样品为氯化血红素。
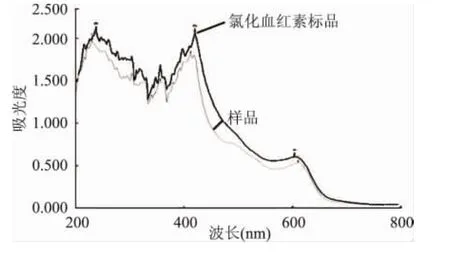
图2 氯化血红素的紫外光谱图Fig.2 The UV spectrum of hemin
2.4 氯化血红素制备收率及含量
用优化的工艺重复3次,纯化后制备氯化血红素,结果见表6。

表6 氯化血红素提取率和收率Table 6 The purity and yield of hemin
2.5 氯化血红素铁含量检测
分别采用国标GB/T 5009.90-2003中原子吸收分光光度法以及磺基水杨酸显色法对血红素中铁含量进行检测,其标准曲线见图3。
所提样品中铁含量检测及分析结果见表7。

图3 原子吸收分光光度法测氯化血红素中的铁含量Fig.3 The detection of hemin’s iron content by atomic absorption spectrophotometric

图4 氯化血红素铁含量检测的标准曲线Fig.4 The standard curve of hemin iron content

表7 氯化血红素成品铁含量检测Table 7 The detection of hemin’s iron content
从表7可见用原子吸收法所测得的铁含量指标比用分光光度法测得的数值偏高,考虑到原子吸收分光光度法法的精密度比分光光度法的高,并且省时,选择原子吸收分光光度法为这一指标的检测方法。
3 结论与讨论
3.1 血渣中提取血红素的最佳工艺条件是A3B2C2,即盐酸丙酮比为4∶100、料液比为1∶5、搅拌时间为20min,提取的血红素含量可以达到98%以上,铁含量7.8%以上,提取率达到60%以上,达到市场要求。此工艺方法易于操作、重复性好、所得产品含量高,适合工业化生产。
3.2 血红素很不稳定,容易被氧化成氯化血红素,所以提取之前在血渣中添加少量的还原剂,可以防止血红素在提取过程中被氧化,另外还可以将已经被氧化的血红素还原成亚铁血红素。血红素在光照下不稳定,因此整个提取过程应尽量避免光照。
3.3 动物血球酶解制备血红蛋白肽之后剩下的血渣富含血红素,可以用来提取血红素,且在提取工艺过程中丙酮使用率量较其他工艺大大减少,提取后剩下的杂蛋白经过脱除有机溶剂处理又可以作为饲料销售,增加了猪血附加值。
[1]宋照军,张延生,刘玺,等.猪血中血红素提取纯化新技术研究[J].肉类工业,2004,8(8):23-25.
[2]吴立芳.利用猪血制备氯化血红素技术的研究[D].湖南农业大学,2006.
[3]李志钊,叶春华.血红素的应用与生产技术研究进展[J].食品研究与开发,2000,10(20):12-14.
[4]张婷,庄红,薛培宇.血红素铁功能及其二价铁保护探索[J].肉类研究,2008,3:18-20.
[5]Adrian R West,Phillip S Oates.Mechanisms of heme iron absorption:Current questions and controversies[J].World J Gastroenterol,2008,14(26):4101-4110.
[6]刘任民,范万东,王摇风,等.猪血中高纯度血红素的提取工艺[J].现代医学卫生,2007,23(18):2687-2689.
[7]钟耀广.猪血中卟啉铁的提取方法及血红素修饰技术的研究[D].北京:中国农业大学,2002.
[8]袁曦,洪清.氯化血红素提取工艺及质量标准研究[J].药品检验,1997,32(6):360-362.
[9]王颖明,莫宝庆,徐济达,等.猪血中血红素提取条件的比较[J].食品科技,2007,32(10):246-254.
[10]汪长国,戴亚,刘少民,等.超声波酸性丙酮法制备氯化血红素[J].食品科学,2010,31(6):109-113.
[11]罗章,郑立红.血红素色素制取及在肉品加工中的应用[J].中国农业科技导报,2006,8(1):40-42.
[12]杨娟.利用猪血制备氯化血红素及分析[D].重庆:重庆大学,2008.
