睾酮抑制高盐喂养下雄性大鼠血管内皮生长因子的表达和释放
2013-05-15王晓慧谈世进
王晓慧, 谈世进
(1苏州大学医学部老年医学专业2010级, 苏州 215123; 2上海交通大学附属第六人民医院老年科, 上海 200233)
高盐负荷下血压升高的特性被称作血压的盐敏感性,由高盐引起的血压升高为盐敏感性高血压。雄激素的作用十分广泛,在心血管系统中起重要作用,在雄性个体中,雄激素的浓度及活性随年龄的增长而降低[1]。在雄激素中,起主要生理活性作用的是睾酮。笔者之前的研究表明,高雄激素水平可促进高盐喂养下雄性大鼠血压的升高,而去势处理可以降低高盐喂养所引起的血压升高幅度[2]。其他学者的研究也有类似发现[3]。而雄激素对盐敏感高血压的影响机制尚未完全阐明,血管内皮在调节体内心血管生理功能、维持血压的平衡中起着极其重要的作用,雄激素影响高盐饮食下大鼠的血压水平,是否与内皮功能的变化有关,值得关注。血管内皮生长因子(vascular endothelial growth factor,VEGF)是主要存在于血管内皮中,可特异性地刺激血管内皮细胞增殖的活性肽[4],推测VEGF作为有效的血管生成因子、内皮细胞特异性有丝分裂原和强烈的血管通透因子[5],其含量的变化可对内皮功能产生重要影响。本实验通过建立高盐饮食雄性大鼠实验模型,探讨不同水平的睾酮对高盐饮食下雄性大鼠血管VEGF的影响。
1 材料与方法
1.1 实验动物
清洁级雄性Wistar大鼠32只,8周龄左右,体质量(200±10)g,由上海西普尔-必凯实验动物公司提供。
1.2 实验药物
丙酸睾酮注射液(上海通用药业股份有限公司,生产批号100404);氟他胺片(flutamide,上海复旦复华药业有限公司,生产批号110902);盐酸氯胺酮注射液(福建古田药业有限公司,生产批号101103)。
1.3 主要试剂
大鼠睾酮、VEGF酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)试剂盒(Biotech公司)。
1.4 主要仪器
电子称,自动平衡离心机,高速冷冻离心机(BECKMAN公司),超低温冰箱(Sanyo 公司,中国),酶标仪(美国BioTek公司,型号ELx800),荧光定量PCR仪(FTC3000型),多样品组织研磨机(净信科技公司,Tissuelyser-24型)。
1.5 实验方法
1.5.1 实验模型与分组 32只雄性Wistar大鼠随机分为4组:假手术组(Sham组),去势组(Cas组),去势后补充睾酮组(TC组),去势后补充睾酮和氟他胺组(FTC组)。每组8只。全部在适应性喂养2周后开始实验。Cas组、TC组及FTC组大鼠均施以去势手术。2ml/kg体重盐酸氯胺酮腹腔注射麻醉后,碘伏消毒阴囊处皮肤,沿纵膈正中切开一纵形切口,剪开鞘膜后,分别将双侧睾丸与附睾分离并切除睾丸,然后把附睾放回阴囊,青霉素冲洗切口预防感染,缝合切口。Sham组只睾丸与附睾的分离处理,不做切除,然后放回阴囊,青霉素冲洗并缝合切口。各组大鼠术后均用2×105U青霉素连续腹腔注射3d预防感染。
1.5.2 动物饲养与给药 手术后各组均以8%氯化钠高盐颗粒饲料喂养,自由摄食,自由饮用自来水,TC组、FTC组给予丙酸睾酮2mg/kg、皮下注射、隔日1次[6],其余各组分别以等量的玉米油皮下注射,FTC组同时给予氟他胺1mg/kg、每日1次灌胃,其余组以等量的生理盐水灌胃。
1.5.3 采集血样及组织 高盐饲料喂养8周后取材。氯胺酮2ml/kg腹腔注射麻醉后,剖开胸腔,充分暴露心脏并于右心房处采血,注入普通管,管口封好后放入4℃冰箱中1~2h,然后取出以2500r/min的速度离心10min,分离上清并分装,-80℃冰箱冻存备用。采血后迅速分离并剪取胸主动脉及腹主动脉,生理盐水冲洗干净后置-80℃冰箱冻存备用。
1.5.4 ELISA法测定血清中睾酮和VEGF浓度 将待测血清样本置冷水中复融,采用ELISA法测定,严格按照试剂盒说明操作。
1.5.5 RT-PCR测定血管内皮中VEGF mRNA的表达 按说明抽提总RNA,核酸分析仪测定RNA样品浓度,A260nm/A280nm在1.8~2.0之间,说明提取的RNA纯度高,无蛋白质和DNA的残余。取1.6µg RNA为模板反转录为cDNA。PCR引物:VEGF上游5′-CCTGGCTTTACTGCTGTACCT-3′,下游5′-GCTGGTAGACGTCCATGAACT-3′;GAPDH上游5′-GACGCTTTGGTGAAGAAACTGA-3′,下游5′-CACACGGCAATAAATGACATGAG-3′。产物用2%琼脂糖凝胶电泳,对照相对分子质量标准检测扩增结果,凝胶成像分析系统对目的DNA条带进行扫描,并采用BandScan 5.0凝胶图像分析软件进行吸光度(A)值分析。软件自动算出每个基因Ct值的均数及标准差,并计算出mRNA相对于内参GAPDH的表达量,以各组VEGF与自身GAPDH吸光度值的比值作为各组细胞中VEGF mRNA的相对含量(M)。
1.6 统计学处理
计量资料以±s表示,数据处理采用SPSS16.0统计软件,各组间均数比较采用单因素方差分析(One-Way ANOVA),满足方差齐性的多重比较采用LSD法,不满足方差齐性的多重比较采用非参数检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 各组大鼠的血清睾酮和VEGF浓度
与Sham组相比,Cas组血清睾酮浓度明显降低(P<0.01),TC组差异则无统计学意义,FTC组升高近2倍(P<0.01)。与Sham组相比,Cas组、FTC组大鼠血清VEGF浓度明显升高(分别为P<0.01,P<0.05),TC组大鼠无明显差异(P>0.05;表1)。
表1 各组大鼠血清睾酮、VEGF浓度Table 1 Serum testosterone and VEGF contents in rats (n=8,±s)

表1 各组大鼠血清睾酮、VEGF浓度Table 1 Serum testosterone and VEGF contents in rats (n=8,±s)
VEGF: vascular endothelial growth factor; Sham group: control group;Cas group: castration group; TC group: testosterone supplement after castration group; FTC group: flutamide-treated testosterone supplemented castrated group.Compared with Sham group, *P<0.05, **P<0.01
Group Testosterone(ng/L) VEGF(µg/L)Sham group 3.15±0.54 20.837±13.828 Cas group 0.26±0.02** 47.246±19.733**TC group 2.80±0.30 22.870±12.057 FTC group 5.47±1.29** 46.043±22.070*
2.2 各组大鼠的血管内皮中VEGF mRNA表达
与Sham相比,Cas组、FTC组大鼠血管内皮VEGF mRNA 表达水平明显升高(均P<0.01);TC组差异则无统计学意义(P>0.05;图1,图2)。
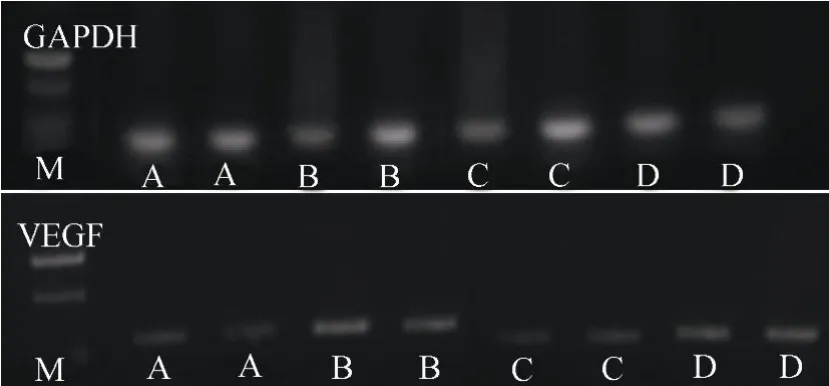
图1 RT-PCR检测血管内皮中VEGF mRNA的含量Figure 1 VEGF mRNA expression in vascular endothelium
3 讨 论
众所周知,高盐饮食可以对血压产生重要影响。在此基础上,既往研究又发现高盐诱导下,高雄激素水平对雄性大鼠血压的升高有促进作用,通过去势处理降低雄激素水平可相应的降低血压水平。但雄激素在此过程中具体的作用机制尚未完全阐明。
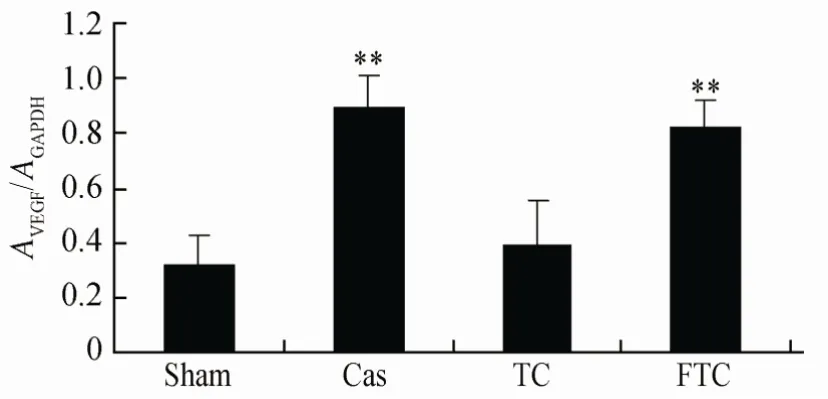
图2 血管内皮中VEGF的相对表达Figure 2 Relative VEGF expression in endothelial cells
Hu等[7]的研究表明,雄激素可能是通过激活肾素-血管紧张素系统(renin-angiotensin-system,RAS),促进高盐饮食下大鼠血压的升高,同时也加重了肾脏的损伤。RAS不是血压调节中唯一起作用的途径,血管内皮在血压调节中也起重要作用。Oloyo等[8]研究发现,SD大鼠的主动脉环对乙酰胆碱的最大舒张效应在高盐饮食下降低,而在去势处理后升高,如果在去势的基础上补充生理剂量的睾酮,舒张效应又转为降低,提示雄激素可能通过直接作用于血管内皮产生影响。
血管内皮是介于循环血液与血管平滑肌细胞之间的,能够合成、分泌多种重要血管活性物质的生理屏障。VEGF主要存在于血管内皮细胞,为特异刺激血管内皮细胞增殖的活性肽,可刺激血管内皮细胞分化、移行、增生和管腔形成,是一种强有力的促血管生成因子[4];可增加血管的通透性及参与新生血管的形成[9];同时还可以选择性地增强血管内皮细胞的有丝分裂,刺激内皮细胞增殖[10]。因此,VEGF含量的变化可对血管内皮的功能产生重要的影响。
临床研究发现,高血压人群血清VEGF含量明显高于正常血压人群[11]。刺激VEGF分泌的因素主要有缺血、缺氧、牵拉、炎症细胞因子等,其中最主要的为缺血和缺氧。血压升高导致血管内皮局部环境的缺血、缺氧,刺激VEGF分泌,而VEGF可以促进血管内皮细胞的分裂、增殖,同时增加血管的通透性,使血管中过多的水分渗入到组织中,可对高血压起代偿作用。
另一方面,在抗肿瘤药物的研究中,抑制VEGF信号通路的药物是最新的抗肿瘤药物之一,多位学者在研究中发现该类药物最明显的副作用是造成血压升高[12,13],也从侧面证明VEGF可对血压的变化产生有益的代偿作用。在本实验中,雄激素完整组(Sham组和TC组)的大鼠血清VEGF浓度较低,低雄激素水平组(Cas组)的大鼠血清VEGF浓度较高,FTC组虽然睾酮浓度最高,但由于雄激素受体(androgen receptor,AR)阻滞剂氟他胺的作用,睾酮作用不能得到发挥,故VEGF浓度也较高。同时血管内皮中VEGF mRNA的表达也呈现类似的水平。由此推测,雄激素可能抑制了VEGF的表达与释放,导致VEGF水平降低,因而由高盐饮食造成的内皮损害得不到相应的代偿性修复,使血管内皮细胞的功能受损。VEGF本身可通过刺激血管内皮细胞的分裂、增殖,增加血管壁的通透性等作用对血管内皮的功能产生影响,同时有学者研究发现,VEGF还可调控一氧化氮合酶的表达而对血管内皮产生影响[14,15]。
雄激素发挥作用主要是通过AR,AR主要位于睾丸间质细胞核内,也存在于神经系统、肾及肾上腺、大部分心房及心室肌、主动脉、冠状动脉中,这也是雄激素作用广泛的原因。Lin等[16]最早发现血管壁中存在AR,血管壁各层均有分布,以内层为主。氟他胺是一种非类固醇类抗雄激素药物,主要通过抑制靶细胞受体对睾酮的摄取和(或)结合,进而干扰雄激素作用[17]。在本实验氟他胺组,即使睾酮浓度很高,也不能正常发挥作用,表明雄激素主要是通过AR发挥作用。
本研究表明,以睾酮为代表的雄激素可对高盐饮食大鼠的VEGF水平产生影响,高浓度雄激素可降低VEGF水平,而低浓度则导致VEGF升高,且这种影响是通过AR进行的。但确切的影响机制尚需进一步证实。雄激素可能通过影响VEGF的水平直接影响血管内皮功能,这可能是雄激素影响盐敏感高血压作用的机制之一。
[1]张春萍, 方宁远, 康近方.老年人9种性激素的化学发光免疫分析[J].中国老年杂志, 2006, 26(8): 1030−1031.
[2]胡剑平, 谈世进, 丁在咸.雄性激素在高盐引发高血压中的作用[J].中华高血压杂志, 2008, 16(11): 991−993.
[3]Yanes LL, Sartori-Valinotti JC, Iliescu R,et al.Testosterone-dependent hypertension and upregulation of intrarenal angiotensinogen in Dahl salt-sensitive rats[J].Am J Physiol Renal Physiol, 2009, 296 (4): F771−F779.
[4]Breier G, Albrecht U, Sterrer S,et al.Expression of vascular endothelial growth factor during embryonic angiogenesis and endothelial cell differentiation[J].Development, 1992,114(2): 521−532.
[5]Anteby EY, Greenfield C, Natanson-Yaron S,et al.Vascular endothelial growth factor, epidermal growth factor and fibroblast growth factor-4 and -10 stimulate trophoblast plasminogen activator system and metalloproteinase-9[J].Mol Hum Reprod, 2004, 10(4): 229−235.
[6]Lin SM, Tsao CM, Tsai SK,et al.Influence of testosterone on autotomy in castrated male rats[J].Life Sci, 2002, 70(20):2335−2340.
[7]Hu J, Tan S, Zhong Y.Effects of testosterone on renal function in salt-loaded rats[J].Am J Med Sci, 2011, 342(1):38−43.
[8]Oloyo AK, Sofola OA, Anigbogu CN.Orchidectomy attenuates impaired endothelial effects of a high-salt diet in Sprague-Dawley rats[J].Can J Physiol Pharmacol, 2011,89(4): 295−304.
[9]Miller JW, Adamis AP, Shima DT,et al.Vascular endothelial growth factor/vascular permeability factor is temporally and spatially correlated with ocular angiogenesis in a primate model[J].Am J Pathol, 1994, 145(3): 574−584.
[10]Vyzantiadis T, Karagiannis A, Douma A,et al.Vascular endothelial growth factor and nitric oxide serum levels in arterial hypertension[J].Clin Exp Hypertens, 2006, 28(7):603−609.
[11]廖贵红.高血压患者血清VEGF和ET- 1检测的临床意义[J].中国热带医学, 2007, 7(9): 1616−1619.
[12]Belcik JT, Qi Y, Kaufmann BA,et al.Cardiovascular and systemic microvascular effects of anti-vascular endothelial growth factor therapy for cancer[J].J Am Coll Cardiol, 2012,20(7): 618−625.
[13]Maitland ML, Bakris GL, Black HR,et al.Initial assessment,surveillance, and management of blood pressure in patients receiving vascular endothelial growth factor signaling pathway inhibitors[J].J Natl Cancer Inst, 2010, 102(9):596−604.
[14]Facemire CS, Nixon AB, Griffiths R,et al.Vascular endothelial growth factor receptor 2 controls blood pressure by regulating nitric oxide synthase expression[J].Hypertension, 2009, 54(3): 652−658.
[15]Machnik A, Neuhofer W, Jantsch J,et al.Macrophages regulate salt-dependent volume and blood pressure by a vascular endothelial growth factor-C-dependent buffering mechanism[J].Nat Med, 2009, 15(5): 545−552.
[16]Lin AL, McGill HC Jr, Shain SA.Hormone receptors of the baboon cardiovascular system:Biochemical characterization of myocardial cytoplasmic androgen receptors[J].Circ Res,1981, 49 (4): 1010−1016.
[17]Goldspiel BR, Kohler DR.Flutamide: an antiandrogen for advanced prostate cancer[J].DICP, 1990, 24(6): 616−623.
