杨梅素提取工艺优化
2013-05-05邓丹雯杨佩吕建垚张彬黄赣辉
邓丹雯,杨佩,吕建垚,张彬,黄赣辉
(南昌大学食品科学与技术国家重点实验室,江西南昌,330047)
杨梅素(3,5,7,3',4',5'-六羟基黄酮)亦称杨梅黄酮,是从杨梅树皮和树叶中提取出的多羟基黄酮类化合物[1-2]。杨梅素具有较强抗氧化活性、显著的自由基清除能力、抗炎和抗肿瘤药效,能够降低血糖,预防糖尿病及糖尿病并发症[3-5],有很好的研究价值和经济价值。
鉴于目前国内对杨梅素提取工艺的研究较少,本实验以新鲜杨梅树叶为原料,采用乙醇回流提取、C18固相萃取小柱纯化[6]的方法,对杨梅素提取工艺进行研究。通过考察液料比、提取时间、提取温度、乙醇体积分数对杨梅素提取得率的影响,利用响应面分析法对其提取工艺参数进行优化[7-8],以确定杨梅素提取最佳工艺条件,为杨梅素的应用提供实验依据。
1 材料与方法
1.1 材料与试剂
杨梅树叶:荸荠种杨梅树叶,采于江西乐平;选取新鲜杨梅树叶,用蒸馏水洗净,放入50℃烘箱烘干后粉碎,过40目筛后保存备用。
杨梅素标品:阿拉丁试剂(上海)有限公司,w>98%;无水乙醇:分析纯;甲醇、磷酸二氢钾均为色谱纯。
1.2 仪器
Aglient1260高效液相色谱仪(四元泵、紫外检测器),Simon Aldrich-C18固相萃取小柱,JT2003电子精密天平(河北路仪公路仪器有限分公司),DFY-500摇摆式高速万能粉碎机(温岭市林大机械有限公司),旋转蒸发仪RE-52(上海亚荣生化仪器厂),DHG-9053型电热恒温鼓风干燥箱(上海三发科学仪器有限公司),DKS-24型电热恒温水浴锅(嘉兴市中新医疗仪器有限公司)。
1.3 方法
1.3.1 杨梅素的提取工艺流程
杨梅树叶→烘干粉碎→40目筛分→回流提取→抽滤→杨梅素粗提液
1.3.2 杨梅素的提取
准确称取适量杨梅树叶粉末置于单口圆底烧瓶,加入一定量的乙醇水溶液,控制一定温度回流提取一定时间后,过滤,滤液即为杨梅素粗提液。
1.3.3 单因素影响实验
准确称取10 g杨梅树叶粉末,按1.3.2方法对杨梅素进行提取,主要考察液料比、提取温度、乙醇体积分数、提取时间因素对杨梅素提取的影响,具体因素水平见表1。
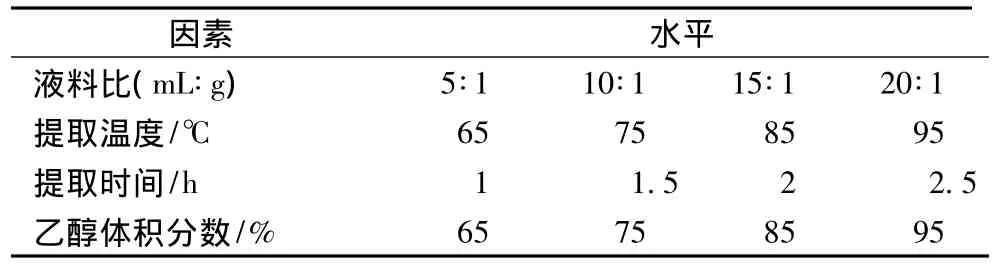
表1 单因素实验因素水平表Table 1 Factors and levels of one-factor-at-a-time(OFAT)experiments
1.3.4 响应面法优化提取工艺
在单因素实验结果的基础上,根据中心组合实验Box-Behnken设计原理[9],设计三因素三水平的响应面分析实验。
1.3.5 杨梅素的测定
1.3.5.1 杨梅素的测定方法
将杨梅素粗提液旋蒸至浸膏状,甲醇溶解定容至50 mL,吸取0.5 mL用甲醇定容至25 mL后取5 mL通过活化好的Simon Aldrich-C18固相萃取小柱,弃去最初2滴开始收集[10],用0.22 μm针头过滤器过滤,高效液相外标法进行分析。
1.3.5.2 HPLC检测条件
色谱柱:Thermo-C18液相色谱柱(4.6 mm×250 mm,5 μm);流动相:0.005 mol/L磷酸二氢钾溶液-甲醇(体积比30∶70);流速为0.5 mL/min,进样10 μL,柱温25℃,检测波长360 nm。
1.3.5.3 标准曲线绘制
准确称取杨梅素标品10 mg置100 mL容量瓶中,用甲醇溶解并定容,作为对照品溶液。用甲醇稀释并定容,配成 10,20,30,40,50 μg/mL 系列浓度的杨梅素标品溶液,10 μL进样,在1.3.5.2色谱条件下进HPLC分析,以峰面积为纵坐标(Y),以浓度为横坐标(X)绘制标准曲线。所得回归方程为Y=54.155X -161.47,R=0.999 6,表明样品在 10~50 μg/mL内线性关系良好。
1.3.5.4 得率计算
提取得率/%=(杨梅素提取量/杨梅树叶粉末干质量)×100
2 结果与讨论
2.1 HPLC检测结果
在1.3.5.2色谱条件下,标品和样品在360 nm的波长处色谱图如图1和图2所示。
图1 标品色谱图Fig.1 Chromatogram of standard substance
2.2 单因素实验结果与分析
2.2.1 液料比对杨梅素提取得率的影响
固定提取温度为90℃、乙醇体积分数为90%、提取时间为 2 h,研究液料比(5∶1、10∶1、15∶1、20∶1)对杨梅素提取得率的影响,结果如图3所示。
图2 样品色谱图Fig.2 Chromatogram of sample
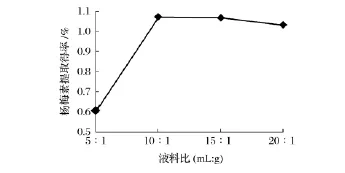
图3 液料比对杨梅素提取得率的影响Fig.3 Effect of liquid-to-material ratio on myricetin yield
由图3可知,随着液料比的增加,杨梅素提取得率提升,当液料比为10∶1时,提取得率达到最大,但随着液料比的继续增加,杨梅素的提取得率反而略有下降,因此确定提取杨梅素的最佳液料比为10∶1。
2.2.2 提取温度对杨梅素提取得率的影响
固定乙醇体积分数为90%、液料比为10∶1、提取时间为2h,研究提取温度(65、75、85、95℃)对杨梅素提取得率的影响,结果如图4所示。
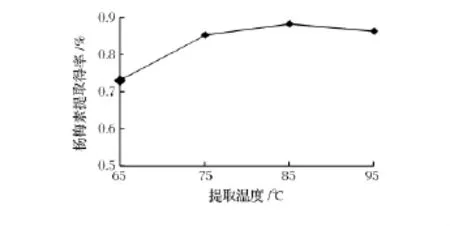
图4 提取温度对杨梅素提取得率的影响Fig.4 Effect of extraction temperature on myricetin yield
由图4可知,当提取温度低于85℃时,随着温度的提升,杨梅素的提取得率增加;当温度为85℃,提取得率达到最大,但当温度继续增加,杨梅素的提取得率反而下降,分析其原因是当提取温度低于85℃时,温度升高越靠近乙醇的沸点越有利于回流提取,提取得率会增加,但杨梅素在长时间高温条件下不稳定[11],当温度超过适宜温度时,杨梅素的结构被破坏,从而导致杨梅素的提取得率下降,因此确定提取杨梅素的最佳温度为85℃。
2.2.3 提取时间对杨梅素提取得率的影响
固定提取温度为85℃、液料比为10∶1、乙醇体积分数为90%,研究提取时间(1、1.5、2、2.5 h)对杨梅素提取得率的影响,结果如图5所示。
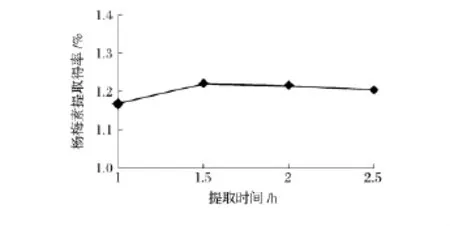
图5 提取时间对杨梅素提取得率的影响Fig.5 Effect of extraction time on myricetin yield
由图5可知,当提取时间小于1.5 h时,随着时间的延长,杨梅素的提取得率有所增加,但增加的程度变化不明显;当提取时间超过1.5 h,随着时间的继续延长,杨梅素的提取得率略有下降,其原因是提取包括扩散、渗透和溶解等过程,时间延长有助于杨梅素的溶出,从而提取得率上升,但杨梅素在长时间的高温条件下不稳定[11],提取时间超过1.5 h后,杨梅素的结构可能开始被破坏,从而导致杨梅素的提取得率略有下降。综合考虑确定提取杨梅素的最佳时间为1.5 h。
2.2.4 乙醇体积分数对杨梅素提取得率的影响
固定提取温度为85℃、液料比为10∶1、提取时间为 1.5 h,研究乙醇体积分数(65、75、85、95%)对杨梅素提取得率的影响。结果如图6所示。
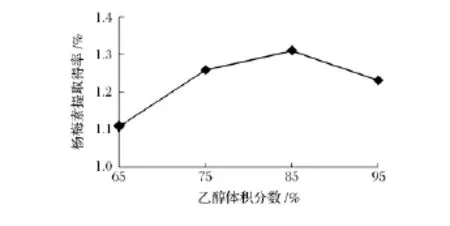
图6 乙醇体积分数对杨梅素提取得率的影响Fig.6 Effect of ethanol concentration on myricetin yield
由图6可知,当乙醇体积分数低于85%时,随着乙醇体积分数的增加,杨梅素的提取得率增加,当乙醇体积分数为85%,提取得率达到最大,分析其原因是杨梅素微溶于水,易溶于乙醇,随着乙醇体积分数的增加,杨梅素的提取得率上升,但当乙醇体积分数达到95%时,提取溶液极性较小不利于杨梅素的提取,提取得率反而下降,因此确定提取杨梅素的最佳乙醇体积分数为85%。
2.3 响应面实验结果与分析
2.3.1 响应面实验结果
根据单因素实验结果,选取液料比、提取温度、乙醇体积分数为对提取杨梅素影响显著的3个因素,以杨梅素提取得率为响应值,因素水平编码表见表2。
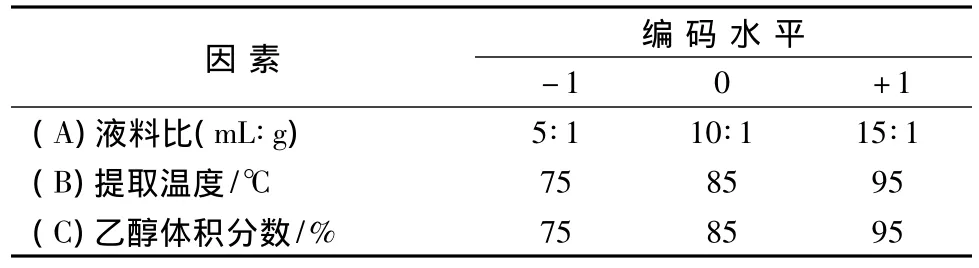
表2 响应面因素水平编码表Table 2 Factors and levers of response surface test
响应面实验结果如表3所示,通过Design Expert8.05数据分析软件进行回归分析,得到杨梅素提取得率(Y)对液料比(A)、提取温度(B)、乙醇体积分数(C)的二次多项回归模型为:
Y=1.29+0.24A+0.026B-0.042C-0.032AB+0.013AC+0.041BC-0.21A2-0.16B2-0.061 C2
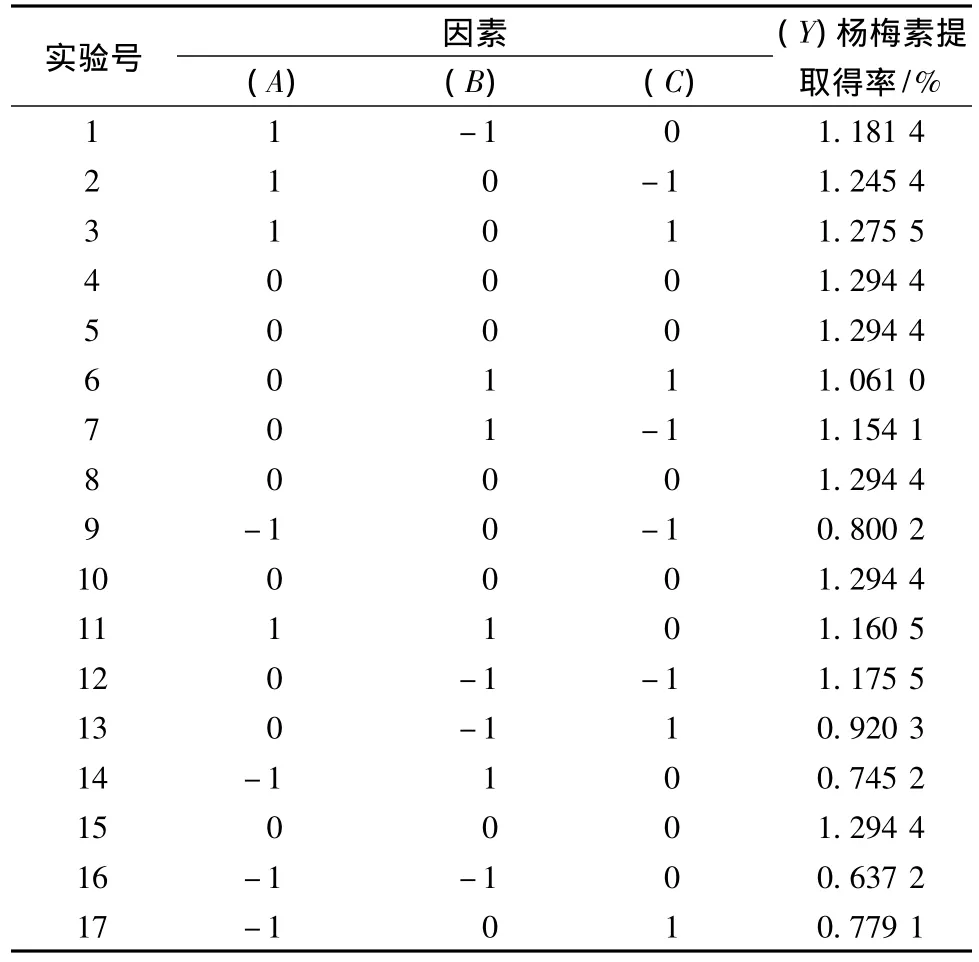
表3 响应面实验结果Table 3 Test design and results of response surface analysis
2.3.2 回归方程方差分析
方差分析结果如表4所示,由表4可以看出,模型Prob>F值小于0.01,表明该模型方程极显著,不同处理间的差异高度显著,说明这种实验方法是准确可靠的,使用该方程模拟真实的三因素三水平的分析是可行的。由表4的Prob>F值知,方程中A、A2、B2对杨梅素提取得率Y值的影响极显著,C、C2对Y值的影响显著,表明实验因素对响应值的影响不是简单的线性关系,二次项对响应值也有很大的影响,交互项作用的影响较小。从表4还可以看出,在所选取因素水平范围内,对杨梅素提取得率的影响大小依次为:液料比>乙醇体积分数>提取温度。且模型的复相关系数为R2=98.05%,大于90%,说明模型拟合程度良好,实验误差小,可以用于杨梅素提取实验的理论预测。
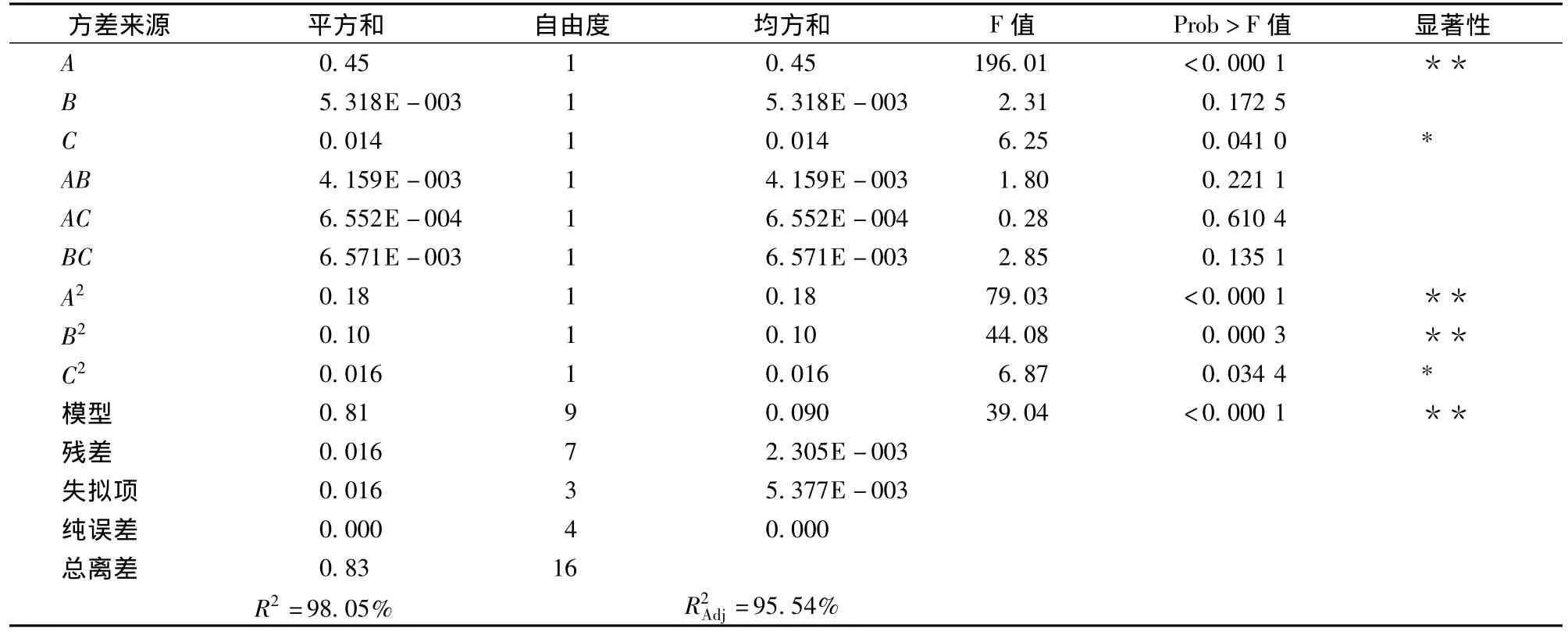
表4 方差分析表Table 4 Analysis of variance for each term of the fitted regression equation
2.3.3 响应面曲面分析
根据二次多项回归模型作出的相应的响应面图及等高线图见图7~图9。响应面的坡度变化及等高线的形状可以反映各因素间的交互作用效应[12]。
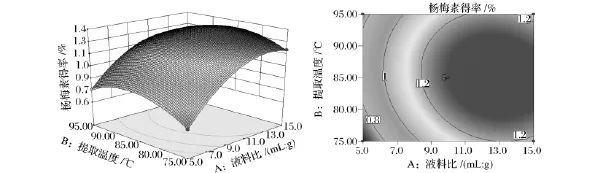
图7 提取温度和液料比对杨梅素提取得率影响的响应面图和等高线图Fig.7 Response surface plot and contour plot showing the interactive effect of extraction temperature and liquid-to-material ratio on myricetin yield
从图7响应面图可以看出,当固定乙醇体积分数为85%时,液料比A的变化引起的响应面坡度变化较陡峭,而提取温度B的变化引起的响应面坡度变化相对平缓,说明在两者的交互作用中液料比A相对于提取温度B而言居于主要方面。由图7等高线可知,椭圆在料液比A区域排列更密集,表明料液比A的变化对响应值变化的影响更大;等高线的形状偏圆形表示2个因素交互作用不太显著。
从图8响应面图可以看出,当固定提取温度为85℃时,液料比A的变化引起的响应面坡度变化比乙醇体积分数C更陡峭,说明在两者的交互作用中,影响杨梅素提取得率的主要方面是液料比A。由图8等高线图可知,椭圆在料液比A区域排列更密集,表明料液比A的变化对响应值变化的影响更大;等高线的形状为椭圆形,表示液料比A和乙醇体积分数C交互作用很显著。

图8 乙醇体积分数和液料比对杨梅素提取得率影响的响应面图和等高线图Fig.8 Response surface plot and contour plot showing the interactive effect of ethanol concentration and liquid-to-material ratio on myricetin yield
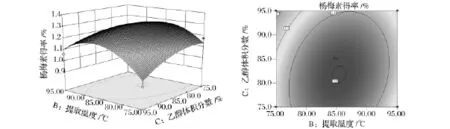
图9 提取温度和乙醇体积分数对杨梅素提取得率影响的响应面图和等高线图Fig.9 Response surface plot and contour plot showing the interactive effect of extraction temperature and ethanol concentration on myricetin yield
从图9响应面图可以看出,当固定液料比为10∶1时,乙醇体积分数C的变化引起的响应面坡度变化比提取温度B更陡峭,说明在两者的交互作用中,影响杨梅素提取得率的主要方面是乙醇体积分数C。由图9等高线图可知,等高线的形状为偏椭圆形,表示提取温度B和乙醇体积分数C交互作用较显著。
2.4 验证实验
根据响应面分析得出优化条件为提取温度84.86℃、乙醇体积分数82.09%、液料比为12.82∶1、提取时间1.5 h,回归模型算出的理论预测值为1.36%;为证实回归模型的可靠性,在此优化条件下进行3次提取验证实验,结果如表5所示,将实验值与预测值相比较,相对误差仅为0.88%,由此证明该回归模型的可靠性。
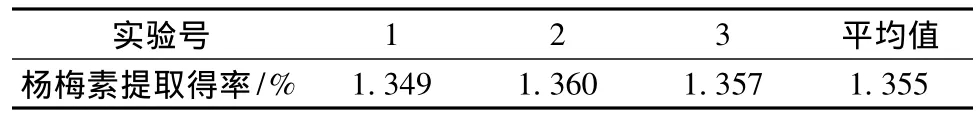
表5 验证实验结果Table 5 Verification results of myricetin extraction
3 结论
采用乙醇回流提取杨梅素,在提取温度、乙醇体积分数、液料比、提取时间4个工艺条件中,液料比对杨梅素的提取得率影响达到极显著水平,乙醇体积分数对杨梅素的提取得率影响显著,而提取温度、提取时间对杨梅素的提取得率的影响不显著。分析结果表明,杨梅树叶中杨梅素的最佳提取条件为提取温度84.86℃、乙醇体积分数82.09%、液料比为12.82∶1、提取时间1.5 h。在此条件下,杨梅素的提取得率可达1.355%。
[1] 唐霖,张莉静,王明谦.杨梅中活性成分杨梅素的研究进展[J].中成药,2006,28(1):121-122.
[2] 张莉静.杨梅树不同部位及不同生长年限茎皮中杨梅素含量比较研究[J].现代中医药,2006,26(5):66-67.
[3] 赵丽,徐淑萍,李宗阳,等.杨梅素及其类似物抗氧化与乙酰胆碱酯酶抑制活性研究[J].食品与发酵工业,2012,38(1):56-62.
[4] Zhi Hong Wang,Kyoung Ah Kang,Rui Zhang,et al.Myricetin suppresses oxidative stress-induced cell damage via both direct and indirect antioxidant action[J].Environmental Toxicology and Pharmacology,2010,29:12-18.
[5] Michael H Gordon,Andrea Roedig-Penman.Antioxidant activity of quercetin and myricetin in liposomes[J].Chemistry and Physics of Lipids,1998,97:79 -85.
[6] 刘源,周光宏,徐幸莲.固相微萃取及其在食品分析中的应用[J].食品与发酵工业,2003,29(3):83-87.
[7] 柯仲成,程小玲.枇杷叶总黄酮提取工艺的优化[J].食品与发酵工业,2012,38(7):173-175.
[8] 王文兰,杨梅,严平.响应面分析法优化回流提取岷江柏总黄酮工艺[J].食品科学,2012,33(18):57-62.
[9] 费荣昌.实验设计与数据处理(第4版)[M].无锡:江南大学,2001:59-63.
[10] 董学畅,杨光宇,乔永峰,等.固相萃取和高效液相色谱法测定杨梅素和杨梅素糖苷[J].云南化工,2003,30(3):61-63.
[11] 王志江.杨梅素的稳定性研究[J].广东微量元素科学,2008,15(10):37-401.
[12] 龚文琼,刘睿.响应面法优化微波辅助提取普洱茶中茶色素工艺研究[J].食品科学,2010,31(8):137-142.
