真姬菇多糖HMP-1的分子结构特性及其生物活性*
2013-05-05包鸿慧周睿愈商权
包鸿慧,周睿,愈商权
1(黑龙江八一农垦大学食品学院,黑龙江大庆,163319)2(韩国江陵原州大学海洋生物科技学院,韩国,江源江陵,210702)
真姬菇又名蟹味菇、玉蕈、海鲜菇等,口感佳,具有独特的蟹香味,在日本有“香在松茸、味在玉蕈”之说,是著名的珍稀食用菌,具有防止便秘、抗癌、防癌、提高免疫力、预防衰老、延长寿命等独特功效。
真菌多糖普遍具有潜在的抗癌和免疫活性,荷叶离褶伞的水溶性多糖具有促进腹膜巨噬细胞增值和抑制肿瘤生长的作用,推断其抗癌活性是通过调控寄主的免疫防御系统而产生[1]。然而,Lavi等人报道,从糙皮侧耳中提取的多糖对HT-29癌细胞具有直接的细胞毒性,这种对癌细胞的细胞毒性是通过产生促凋亡因子Bax和细胞色素C而实现的[2]。真菌多糖的抗癌和免疫活性与其分子结构和超微构效有非常密切的关系,对多糖的结构鉴定和抗癌免疫活性的研究是非常重要的[3]。我国引进真姬菇较晚,对真姬菇多糖的研究,自2007年才见报道,并且大部分是对粗多糖提取工艺的研究[4-8]。目前国内对真姬菇相应的药理活性研究也主要针对粗多糖,难以进行量效关系测定,且仅限于抗氧化活性[9]和抑菌活性[10]。本文分离纯化真姬菇多糖,并对纯化后的多糖的分子结构特性和抗癌免疫活性进行了研究。
1 材料与方法
1.1 材料与仪器
真姬菇,购于上海大山合菌物科技股份有限公司;醋酸纤维素膜,英国沃特曼公司产品;糖标样:葡萄糖、木糖、甘露糖、半乳糖,Fluka公司产品;DEAE sepharose fast flow离子交换树脂,Phamacia公司产品;胎牛血清、RPMI-1640培养基,美国Gibco公司产品;水溶性四唑盐(WST-1),瑞士Roche公司产品;Raw 264.7细胞、人胃腺癌细胞(AGS)、结肠腺癌细胞(DLD-1)、子宫颈癌细胞(HeLa),美国标准生物品收藏中心(ATCC);其余试剂均为国产分析纯。
R200-旋转蒸发器,瑞士布齐公司;高效液相色谱(配置2414示差折光检测器),美国Waters公司;Bruker Agilent 6890N气谱质谱联用仪,美国安捷伦科技有限公司;十八角激光光散射仪(MALLS)及ASTRA 5.3工作站,美国Wyatt技术公司;EL-800酶联检测仪,美国BioTek公司。
1.2 实验方法
1.2.1 真姬菇子实体粉的预处理
去杂、烘干(60℃,24 h)、粉碎、过筛(<0.5 mm)、备用。
1.2.2 真姬菇子实体多糖的提取纯化
称取真姬菇子实体粉末100 g,加入体积分数80%乙醇,于60℃水浴回流脱脂2h,残渣中加适量水(水料比1∶20),100℃水浴提取2次,每次2 h,过滤,合并滤液,加入三氯甲烷-正丁醇(体积比4∶1),充分振荡30 min,离心,取上层水相重复除蛋白10次以上,去除游离蛋白。取上清液装入透析袋内,透析,浓缩,真空冷冻干燥,即得真姬菇粗多糖(HMP)。
溶解真姬菇多粗糖HMP,上样后分别用蒸馏水及不同浓度NaCl溶液洗脱,流速1.5 mL/min。收集洗脱液(30 min/管),用硫酸苯酚法检测[11],合并相同流分,浓缩,透析,真空冷冻干燥,得不同多糖级分。
1.2.3 化学组成和单糖含量的测定
总糖和蛋白含量分别采用硫酸苯酚法[11]和Lowry法检测[12]。单糖含量采用HPLC系统测定,糖分析色谱柱(4.6 mm×250 mm),流动相为乙腈与水混合物 (体积比80∶20),流速2 mL/min。
1.2.4 真姬菇多糖的均一性和平均分子质量测定
采用高效分子排阻色谱法(HPSEC)对真姬菇多糖进行均一性及分子质量的测定。溶解多糖,醋酸纤维素膜 (3.0 μm pore size)过滤,注入 HPSECMALLS-RI-UV系统,高效凝胶排阻色谱为3个色谱柱串联:TSK G5000 PW(7.5 mm ×600 mm)、TSK G3000 PWxl(7.8 mm ×300 mm)、TSK G2500PWxl(7.8 mm ×300 mm),流动相:0.15 mol/L NaNO3和0.02%NaN3,流速:0.4 mL/min。多糖的平均分子量可根据MALLS和RI检测器收集的数据,通过ASTRA 5.3 软件直接计算[13]。
1.2.5 糖苷键连接方式分析
多糖经甲基化处理后[14],衍生物注入气相色谱-质谱联用(GC-MS)检测。色谱柱为HP-5柱(30 m×0.25 mm,0.25 μm),程序升温条件:初始温度/停顿时间为160℃/2 min,程序升温终止温度/停顿时间240℃/10 min,升温速率5℃/min。
1.2.6 对癌细胞的抑制作用
取对数生长期的人胃腺癌细胞(AGS)、结肠腺癌细胞(DLD-1)、子宫颈癌细胞(HeLa),以1×105个/mL的细胞悬液接种于96孔培养板,置37℃、5%CO2培养箱培养24 h后吸取上清液弃去,加入真姬菇多糖样品,每个浓度设3个平行,培养48 h,加入WST-1,450 nm下测OD值,计算癌细胞抑制率:
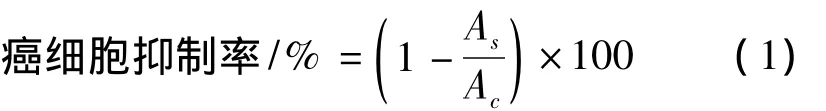
其中,As是实验组OD值;Ac是空白对照组OD值。
1.2.7 真姬菇多糖对巨噬细胞的增值作用
在96孔培养板中加入巨噬细胞Raw 264.7(1×105个/mL)和不同浓度的多糖溶液,在CO2培养箱中培养72 h,RPMI-1640(含10%胎牛血清)为培养基。空白对照加生理盐水。增值作用采用WST-1法,计算免疫细胞增值率:
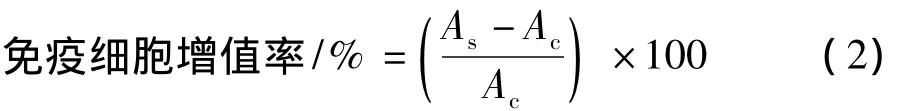
其中,As是实验组OD值;Ac是空白对照组OD值。
1.2.8 真姬菇多糖对巨噬细胞NO释放的影响
取对数生长期的巨噬细胞,调整细胞浓度至1×106个/mL,接种于96孔细胞培养板,于37℃,5%CO2条件下培养,待细胞贴壁后,弃掉培养上清液,加入多糖溶液或LPS(1 μg/mL,阳性对照)。培养24 h,取细胞培养上清液与等体积的Griess试剂混合,反应10 min,酶标仪540 nm测吸收值。NO浓度参考NaNO2(1~200 μmol/L)标准曲线计算。
1.2.9 数据处理
2 结果与分析
2.1 真姬菇多糖的分离纯化
真姬菇子实体粉末经水提取、醇沉、Sevag法脱蛋白得真姬菇子实体粗多糖(HMP),HMP进一步经DEAE-Sepharose Fast Flow离子交换柱分离纯化,DEAE-Sepharose Fast Flow不仅具有离子交换功能,还具有较快的洗脱速度和良好的分子筛效应,对真姬菇多糖的洗脱曲线如图1所示,该粗多糖被分离为3个组分,将洗脱液浓缩、透析、冷冻干燥得白色絮状多糖HMP-1、HMP-2、HMP-3。

图1 真姬菇多糖的DEAE-Sepharose Fast Flow色谱分离曲线Fig.1 Elution pattern of polysaccharides from Hypsizigus marmoreus on DEAE-Sepharose Fast Flow chromatography
2.2 化学组成与单糖成分的测定
对纯化后真姬菇多糖化学成分分析可知HMP-1和HMP-2含糖量分别为99%和98%,其余为蛋白,蛋白含量非常少。HMP-3为蛋白多糖,含糖量为65%。本实验首先对HMP-1的分子结构和活性进行了研究。单糖分析结果表明,HMP-1由葡萄糖和半乳糖组成,其中葡萄糖含量为67.36 mg/g;半乳糖含量为33.36 mg/g。与真姬菇同属的菌核侧耳和平菇的水溶性多糖也主要由葡糖糖(73.1%~97.0%)和半乳糖(0.5% ~4.3%)组成[15-17],其他单糖如果糖、木糖、甘露糖等在本研究中没有发现。
2.3 HMP-1的均一性及分子质量测定
多糖的纯度不能以通常小分子化合物的纯度标准来衡量,它是一种生物高分子化合物,存在微观的不均一性。真姬菇多糖HMP-1的均一性及分子质量采用高效分子排阻色谱法(HPSEC)进行分析。从RI和UV检测器得到的色谱图可知(图2),HMP-1在HPSEC上得到一个单一对称峰,说明HMP-1为均一多糖组分。同时,HMP-1在系统中没有明显的UV反应值检出,说明其蛋白含量非常低,这与HMP-1的化学组成检测结果(蛋白含量1%)相一致。经MALLS技术测定HMP-1的平均分子量(Mw)为(4 781±0.6)ku。HMP-1的回旋半径值(Rg)也通过MALLS计算出来以评估其分子尺寸,为(17.1±1.6)nm。从不同蘑菇中提取的水溶性多糖分子质量之间差异比较大,从1.1 ×104~3 900 ×104g/mol不等[18-19],这种巨大的差异不仅是由于蘑菇种类不同,也与提取纯化方法,分析检测技术及蘑菇所处的生长周期不同有关。
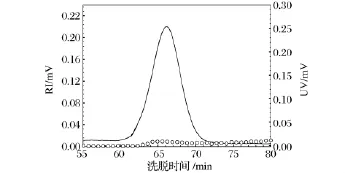
图2 RI检测仪检测的HMP-1分子排阻色谱图Fig.2 HPSEC chromatograms of HMP-1 from RI detector
2.4 糖苷键连接方式分析
HMP-1经甲基化,酸水解、还原及乙酰化,生成甲基化糖醇乙酸酯衍生物,对其进行GC-MS分析,总离子图(TIC)如图3所示,质谱电离方式为EI源,1~5号峰相对应的质谱图如图3所示。
甲基化产物的GC-MS分析结果(表1)显示,甲基化糖醇衍生物中占绝大部分的为2,3,6-Me3-Glcp,这说明多糖HMP-1分子的主链可能主要是通过1,4糖苷键连接的葡糖糖组成。一种经DEAE-纤维素柱层析纯化的真姬菇多糖HPS-II也以(1,4)葡聚糖为主链,与我们的研究结果一致,虽然纯化方法不尽相同[20]。同时由于衍生物中也有相当一部分的2,3,4-Me3-Galp,说明其主链也包含了 1,6 糖苷键连接的半乳糖。在真姬菇同属的菌核侧耳和环柄侧耳多糖也由(1,4)葡萄糖构成主链,同时包含(1,6)葡萄糖或者半乳糖分支,与本课题组发现的结构相似[21-22]。

表1 HMP-1的GC-MS甲基化分析结果Table 1 Methylation analysis of HMP-1
2.5 抗癌活性测定
HMP-1对AGS、DLD-1、HeLa癌细胞的体外抑制率见表2。由表2可见,HMP-1对AGS、DLD-1、He-La的抑制率相对比较低(<20%)而且无剂量依赖性。说明HMP-1对这3种癌细胞没有明显的细胞毒性。Ikekawa等人也曾报道过体外实验中真姬菇粗多糖对L-5178Y肿瘤细胞几乎没有细胞毒性[23],与我们的研究结果吻合。菌核侧耳多糖和香菇多糖也对Sarcoma 180细胞和人肝癌细胞(HepG2)的体外抑制率(11% ~28%)较低[24-25]。然而,尽管体外抗癌活性低,真姬菇粗多糖和金福菇多糖在体内实验中表现出了高抗癌活性[23,26]。对于这些多糖为什么只在体内表现抗癌活性,目前机理并不明确,然而有迹象表明多糖可能是作为生物反应调节剂,通过刺激免疫细胞产生NO或者细胞因子来抑制癌细胞的生长[23,27]。
2.6 真姬菇多糖对巨噬细胞的增值作用
小鼠巨噬细胞Raw264.7在LPS的刺激下会释放细胞因子,这一系统被用于测定某种成分是否对免疫系统具有调节活性[28]。因此,本实验以小鼠巨噬细胞 Raw264.7为细胞模型,考查了 HMP-1对Raw264.7细胞增殖及NO生成的影响,为活性多糖的免疫调节研究提供有价值的参考模式。本实验的研究发现,含有HMP-1(1~200 μg/mL)的培养孔中,培养基颜色清澈,细胞透亮,长势良好。WST-1结果(图4)表明,HMP-1可促进Raw264.7细胞的增值,HMP-1对Raw264.7无细胞毒作用。
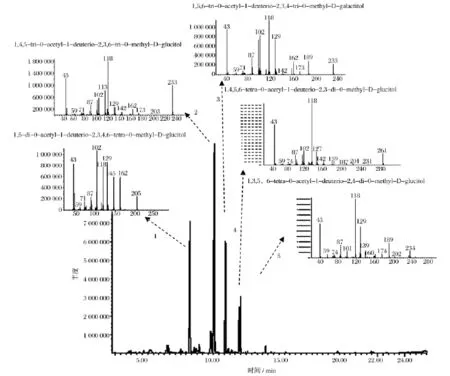
图3 HMP-1的总离子流图谱和部分甲基化糖醇乙酸酯的质谱图Fig.3 Chromatogram of HMP-1 on GC-MS total ion flow and Mass spectra of partially methylated alditol acetates of HMP-1

表2 HMP-1对人细胞株的体外抑制作用Table 2 Anti-proliferative activity of HMP-1 in AGS cell lines

图4 HMP-1对Raw264.7增值率的影响Fig.4 Effect of HMP-1 on cell proliferation of Raw264.7 cells
2.7 真姬菇多糖对巨噬细胞NO释放的影响
HMP-1对Raw264.7细胞中NO释放的影响如图5所示,由结果可知,巨噬细胞在不添加任何成分,也就是在静息状态下,释放的NO很少。添加HMP-1后,Raw264.7分泌NO的能力明显提高(P<0.01),生成的NO的量随HMP-1剂量的增加而增加,呈剂量依赖关系。当 HMP-1在浓度为100 μg/mL时,Raw264.7生成NO 的量为31.94 μmol/L,与 LPS中Raw264.7生成NO的量相似。NO水平是巨噬细胞激活的一个重要指标,巨噬细胞抗病毒、抗肿瘤、抑制胞内病原体增值等作用主要都是通过释放NO实现[29]。HMP-1显著增加了巨噬细胞释放 NO的能力,说明HMP-1是巨噬细胞免疫调节物质,具有免疫调节活性。
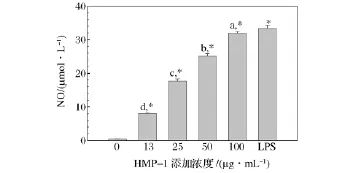
图5 HMP-1对巨噬细胞Raw264.7中NO的影响Fig.5 Effect of HMP-1 on NO production in mouse peritoneal macrophage Raw264.7 cells
3 结论
从真姬菇中提取生物活性成分真姬菇多糖,经离子交换柱层析分离纯化得到组分HMP-1;HMP-1主要由葡萄糖和半乳糖构成,分子质量为(4 781±0.6)ku,分子回旋半径值为(17.1±1.6)nm;经甲基化和GC-MS初步分析其结构,HMP-1主链为(1,4)葡萄糖,含有(1,6)半乳糖分支;体外实验表明,HMP-1虽对AGS、DLD-1和HeLa癌细胞无明显的细胞毒性,但对小鼠巨噬细胞有明显的激活作用,具有免疫活性,可以作为免疫调节剂应用于医药、卫生或者保健食品中。今后将对HMP-2和HMP-3的结构和活性进行检测,以期对真姬菇多糖的结构和活性之间的关系进行研究。
[1] Ukawa Y,Ito H,Hisamatsu M.Antitumor effects of(1→3)-β-d-glucan and(1→6)-β-d-glucan purified from newly cultivated mushroom,Hatakeshimeji(Lyophyllum decastes Sing.)[J].Journal of Bioscience and Bioengineering,2000,90(1):98 -104.
[2] Lavi I,Friesem D,Geresh S,et al.An aqueous polysaccharide extract from the edible mushroom Pleurotus ostreatus induces anti-proliferative and pro-apoptotic effects on HT-29 colon cancer cells[J].Cancer Letters,2006,244(1):61-70.
[3] Zhang M,Cui S W,Cheung P C K,et al.Antitumor polysaccharides from mushrooms:a review on their isolation process,structural characteristics and antitumor activity[J].Trends in Food Science & Technology,2007,18(1):4-19.
[4] 姜华,蔡德华,张华卫.真姬菇子实体粗多糖提取条件试验[J].食用菌,2007,29(3):55 -56.
[5] 李顺峰,刘兴华,张丽华,等.真姬菇子实体多糖的提取工艺优化[J].农业工程学报,2008,24(2):281 -284.
[6] 付娟妮,刘兴华,蔡福带,等.真姬菇菌丝体多糖碱提取工艺优化[J].农业机械学报,2008,39(6):98 -101.
[7] 张俊刚,徐颖,赵清珍,等.真姬菇子实体多糖提取条件正交实验研究[J].安徽农业科学,2008,36(21):9 125-9 191.
[8] 周浩.真姬菇多糖的提取和组分研究[J].安徽农业科学,2009,37(30):14 879 -14 880.
[9] 李顺峰,郑丽华,付娟妮,等.真姬菇子实体多糖体外抗氧化特性研究[J].西北农业学报,2008,17(4):302-305.
[10] 王耕.真姬菇液体培养条件的优化及多糖提取与分析[D].福州:福建农林大学,2009:28-36.
[11] Dubois M,Gilles K A,Hamilton J K,et al.Colorimetry method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350 -356.
[12] Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the Folin-Phenol reagents[J].Journal of Biological Chemistry,1951,193(1):265 -275.
[13] You S G,Lim S T.Molecular characterization of corn starch using an aqueous HPSEC-MALLS-RI system under various dissolution and analytical conditions[J].Cereal Chemistry,2000,77(3):303 -308.
[14] 周林,郭祀远,郑必胜.高分子质量裂褶菌多糖的纯化及表征[J].食品与发酵工业,2008,34(12):47 -50.
[15] Santos-Neves J C,Pereira M I,Carbonero E R,et al.A novel branched αβ-glucan isolated from the basidiocarps of the edible mushroom Pleurotus florida[J].Carbohydrate polymers,2008,73(2):309 -314.
[16] Zhang M,Zhang L,Cheung P C K,et al.Molecular weight and anti-tumor activity of the water-soluble polysaccharides isolated by hot water and ultrasonic treatment from the sclerotia and mycelia of Pleurotus tuber-regium[J].Carbohydrate Polymers,2004,56(2):123 -128.
[17] Zhang M,Zhang L,Cheung P C K,et al.Fractionation and characterization of a polysaccharide from the sclerotia of Pleurotus tuber-regium by preparative size-exclusion chro-matography[J].Journal of Biochemical and Biophysical Methods,2003,56(1 -3):281 -289.
[18] Synytsya A,Mickova K,Synytsya A,et al.Glucans from fruit bodies of cultivated mushrooms Pleurotus ostreatus and Pleurotus eryngii:Structure and potential prebiotic activity[J].Carbohydrate Polymers,2009,76(4):548 -556.
[19] Yang C,Chung D,You S G.Determination of physicochemical properties of sulphated fucans from sporophyll of Undaria pinnatifida using light scattering technique[J].Food Chemistry,2008,111(2):503 -507.
[20] 姜华,纪春暖,陈健,等.真姬菇多糖的分离纯化及机构分析[J].食品科技,2008,33(12):204 - 207.
[21] Tao Y,Zhang L.Characterization of polysaccharide-protein complexes by size-exclusion chromatography combined with three detectors[J].Carbohydrate Research,2008,343(13):2 251 -2 257.
[22] Roy S K,Maiti D,Mondal S,et al.Structural analysis of a polysaccharide isolated from the aqueous extract of an edible mushroom,Pleurotus sajor-caju,cultivar Black Japan[J].Carbohydrate Research,2008,343(6):1 108 -1 113.
[23] Ikekawa T,Saitoh H,Feng W,et al.Antitumor activity of hypsizigus marmoreus.Ⅰ.Antitumor activity of extracts and polysaccharides[J].Chemical and Pharmaceutical Bulletin,1992,40(7):1 954 -1 957.
[24] Tao Y,Zhang L.Characterization of polysaccharide-protein complexes by size-exclusion chromatography combined with three detectors[J].Carbohydrate Research,2008,343(13):2 251-2 257.
[25] Maeda Y Y,Watanabe S T,Chihara C,et al.Denaturation and renaturation of a β-1,6;1,3-glucan,lentinan,associated with expression of T-cell-mediated responses[J].Cancer Research,1988,48(3):671 -675.
[26] Liu F,Ooi V E C,Liu W K,et al.Immunomodulation and antitumor activity of polysaccharide-protein complex from the culture filtrates of a local edible mushroom,Tricholoma lobayense[J].General Pharmacology,1996,27(4):621 -624.
[27] Liu C,Xi T,Lin Q,et al.Immunomodulatory activity of polysaccharides isolated from strongylocentrotus nudus eggs[J].International Immunopharmacology,2008,8(13/14):1 835-1 841.
[28] Porcheray F,Viaud S,Rimaniol A C,et al.Macrophage activation switching:an asset for the resolution of inflammation[J].Clinical& Experimental Immunology,2005,142(3):481-489.
[29] Jiao L,Li X,Li T,et al.Characterization and anti-tumor activity of alkali-extracted polysaccharide from Enteromorpha intestinalis[J].International Immunopharmacology,2009,9(3):324 -329.
