食品药品包装材料中抗氧化剂毒理学研究
2013-05-02朱玲风任佳丽李忠海
朱玲风 杜 晶 任佳丽 李忠海 张 慧 李 远
ZHU Ling-feng DU Jing REN Jia-li LIZhong-hai ZHANG Hui LIYuan
(中南林业科技大学食品科学与工程学院,湖南 长沙 410004)
(Central South University of Forestry and Technology Institute of Food Science and Engineering,Changsha,Hunan 410004,China)
目前塑料制品因其质轻、化学稳定性好、易加工、易成型、原料价格便宜等优点而广泛的应用于食品和药品包装。但是,为了改善聚合物材料加工和使用性能,在聚合物生产过程中会加入各种添加剂,这些添加剂并不能牢固结合在有机载体上,在一定的条件和作用下会游离于外环境,因包装材料的不安全因素而影响食药用安全甚至酿成事故的例子屡见不鲜[1]。为确保食药用的安全,有必要研究塑料制品添加剂的安全性,如已发现广泛用于药品包装材料的添加剂—全氟辛烷磺酸类物质,具有较高的毒性[2]。目前国内外对食品和药品包装材料中抗氧化剂的迁移检测方面研究比较多,如意大利学者[3]报道了抗氧化剂Irganox1010和Irgafos168从聚烯烃类药品包装向油性内容物中的迁移研究,林勤保等[4]对聚乙烯塑料包装材料中4种抗氧剂(BHA,BHT,Irganox1010,Irganox1076)向脂肪食品模拟物迁移做了相关研究。
医药包装材料是一种特殊的包装材料,对其要求越加严格,医用塑料对某些药物有吸附和迁移作用,从而造成药物浓度不稳定,导致药效学异常,影响临床疗效。徐小薇等[5,6]研究发现,在PVC输液袋中,24 h相对0 h的胰岛素百分数含量为 78.9%~80.8%,48 h为65.72%~68.83%,张磊等[7,8]测得5%葡萄糖注射液和0.9%氯化钠注射液中存在外源性抗氧化剂168。迁移作用在液体药品中普遍存在,抗氧化剂就是其中的一类迁移物,因此有对抗氧化剂的毒性研究的必要性。在实际应用中,塑料通常添加几种抗氧化剂,如严瑞娟等[9]测得5层共挤膜输液用膜袋中含有抗氧化剂1010、330、168、1076。在20世纪70~90年代,瑞士汽巴公司已对BHT、Irganox1010、Irganox1076、Irgafos168 4 种抗氧化剂纯品做了较全面的毒理学研究,21世纪以来,国内外对其研究较少,尤其是后三者,BHT比后三者毒性较高,且自身氧化易变色等原因,在塑料行业使用量越来越少,但应用仍较广泛。但对抗氧化剂的混合物毒性研究未见报道。为了研究塑料包装材料中抗氧化剂混合物的毒性作用,首先选取某品牌输液塑料瓶为材,通过高效液相色谱仪测的其中的抗氧化剂有BHT、Irganox1010、Irganox1076、Irgafos168,含量比为 1∶6∶1∶9。故本试验将这4种抗氧化剂1∶6∶1∶9混合,以混合物为研究对象,对其进行毒理学研究,从而为抗氧化剂混合物的安全应用提供试验依据。
1 材料与方法
1.1 仪器与受试物
电子天平:ARA520型,上海强森生物技术有限公司;
生物显微镜:9CA-SMUV型,上海光学仪器厂;
全自动血液分析仪:CA-500型,山东兰桥医学科技有限公司;
半自动生化分析仪:RT-1904C Rayto型,深圳市雷杜生命科技股份有限公司;
台式高速离心机:TG16-WS型,湖南湘仪离心机仪器有限公司;
切片机:TKD-QPB型,孝感泰康达医疗设备有限公司;
BHT、Irganox1010、Irganox1076、Irgafos168: 纯 度 均 为98%,瑞士汽巴公司。
1.2 试验动物
SPF级昆明种小鼠(18~22 g,25~35 g)和 SPF级SD大鼠(180~200 g)均由湖南斯莱克景达实验动物有限责任公司提供,动物证号:SCXK(湘)2011-0033。试验前,动物在试验环境中适应5 d,饲养条件为温度20~24℃,相对湿度40%~60%,12 h光照,12 h黑暗。
1.3 方法
1.3.1 急性经口毒性试验 将昆明种小鼠随机分为4个剂量组,1个溶剂对照组,每组10只动物,雌雄各半。以聚乙二醇—400为溶剂,将受试物按剂量分别为1 000,2 150,4 160,10 000mg/kg配置成溶液,用于剂量组染毒,对照组用溶剂染毒。采用灌胃方式(灌胃量为每20 g体重给予0.4mL)染毒,24 h内灌胃4次,每次间隔6 h。染毒后观察动物的一般体征变化与死亡情况,连续观察14 d,试验结束时将存活动物处死。结果判定参照GB 15193.3——2003。
1.3.2 遗传毒性
(1)小鼠骨髓微核试验:昆明种小鼠(体重25~35 g)随机分成3个剂量组,1个阴性对照组和1个阳性对照组,每组10只,雌雄各半。以2%的吐温-80为溶剂,将受试物按750mg/kg(低),1 500 mg/kg(中),3 000 mg/kg(高)配置成溶液,用于剂量组染毒,阴性对照组用体积分数2%的吐温-80水溶液染毒,阳性对照组用环磷酰胺染毒,剂量为64mg/kg。采用灌胃方式(灌胃量为每20 g体重给予0.6mL)染毒,30 h灌胃2次。第2次灌胃后6 h颈椎脱臼处死动物,取股骨的骨髓液,并与小牛血清混合后。常规涂片,用甲醇固定10min,自然晾干,Giemasa染色20min,自然晾干,双盲法阅片。每只鼠计数1 000个嗜多染红细胞,按雌雄性别,分别统计每组动物出现的微核总数及正染红细胞数目,计算嗜多染红细胞和正染红细胞比率(PCE/NCE),结果判定参照GB 15193.5——2003。
(2)小鼠精子畸形试验:雄性昆明种小鼠(体重25~30 g)随机分成3个剂量组,1个阴性对照组和2个阳性对照组,每组10只,以体积分数为2%的吐温-80为溶剂,将受试物按750 mg/kg(低),1 500 mg/kg(中),3 000 mg/kg(高)配置成溶液,用于剂量组染毒,阴性对照组用体积分数2%的吐温-80水溶液染毒,阳性对照组用环磷酰胺染毒,剂量为64mg/kg。采用灌胃方式(灌胃量为每20 g体重给予0.6mL)染毒,连续灌胃5 d,首次染毒后的第35天颈椎脱臼处死小鼠,取出一侧附睾,放入盛有1mL 0.9%氯化钠注射液的平皿中,用眼科剪将附睾纵横各一刀,静止4 min,用合成纤维血网过滤,吸滤液常规涂片,用甲醇固定10min,自然晾干,用2%伊红染色1 h,用水轻冲,晾干,双盲法阅片,每只动物计数1 000个精子,统计每组出现的畸形精子总数,并计算其畸形率。结果判定参照GB 15193.7——2003。
1.3.3 大鼠30 d喂养试验 SD大鼠(体重180~220 g)随机分成3个剂量组和1个阴性对照组,每组20只,雌雄各半,以体积分数为2%的吐温-80为溶剂,将受试物按40mg/kg(低),400 mg/kg(中),800 mg/kg(高)配置成溶液,用于剂量组染毒,阴性对照组用体积分数2%的吐温-80水溶液染毒,采用灌胃方式(灌胃量为每200 g体重给予2mL)染毒,连续染毒30 d,试验期间,每天观察动物的一般体征、中毒表现和死亡情况;每周称体重和饲料,计算增重和食物利用率。最后一次染毒后,逐只称重,采集血液样本进行血液学、生化学检查,解剖取心、肝、脾、肺、肾、胸腺、肾上腺,脑、性器官脏器称重,计算脏体比,并观察有无明显脏器病变,同时对以上器官及胃肠进行组织病理学检查。数据处理和结果判定等参照GB 15193.13——2003。
1.4 数据分析
采用SPSS 11.0统计软件对试验数据进行单因素方差分析和t检验。
2 结果与分析
2.1 急性毒性试验
每次染毒后,动物出现少动,不进食现象,但第2天即可恢复正常。试验期间,动物一般体征表现正常,除极少数死亡动物有胃肠胀气外,其他死亡动物的心、肝、脾、肺、肾等器官未发现肉眼可观察到的异常病变。试验结束后对存活动物进行剖检,肉眼未观察到相关器官发生异常病变。以上观察表明,受试物未表现出较强的急性毒性。试验观察期间,对照组和1 000mg/kg 剂量组小鼠未见死亡,2 150,4 160,10 000mg/kg各剂量组的10只小鼠分别死亡1,3,4只,结合机率单位—剂量对数法可计算出以昆明种小鼠为试验动物,受试物的经口急性毒性LD50值为11 340mg/kg,根据中国的小鼠急性经口毒性分级标准,该样品属无毒级。
2.2 遗传毒性试验
2.2.1 小鼠骨髓微核试验 按雌雄性别分别统计各组动物的微核总数与正染红细胞总数,结果见表1。通过t检验可知,各剂量组的小鼠微核率与阴性对照组比较,差异均无统计学意义(P>0.05),而阳性对照组与阴性对照组比较,差异有显著统计学意义(P<0.01)。由此表明,受试物对嗜多染红细胞微核的产生无显著影响。同时,阴性对照组及各剂量组的PCE/NCE在 0.6~1.2,阳性对照组 PCE/NCE<0.6。根据 GB 15193.5——2003可以判定剂量组对骨髓红细胞系统的增殖无明显抑制作用。所以,通过微核率及嗜多染红细胞和正染红细胞比率(PCE/NCE)两个指标可初步确定抗氧化剂混合物对小鼠骨髓细胞染色体无损伤作用。
2.2.2 小鼠致畸试验 各剂量组动物的精子畸形率与阴性对照组比较,差异均无统计学意义(P>0.05),而阳性对照组精子畸形率显著高于阴性对照组及各剂量组(P<0.01),未观察到受试物对小鼠精子的损害作用。每组动物10只,每只动物受检1 000个精子,结果汇总见表2。
表1 抗氧化剂混合物对小鼠骨髓细胞微核的影响Table1 Effect of antioxidants compounds onmicronucleus of cell bornmarrows ofmice(±s,n=10)

表1 抗氧化剂混合物对小鼠骨髓细胞微核的影响Table1 Effect of antioxidants compounds onmicronucleus of cell bornmarrows ofmice(±s,n=10)
**.与阴性对照组相比,P<0.01。
组别 雌性雄性PCE/NCE 微核数 微核率/‰ PCE/NCE 微核数 微核率/‰低剂量组中剂量组高剂量组阴性对照阳性对照0.86±0.08 0.84±0.07 0.79±0.11 0.90±0.04 0.42±0.04 41 47 48 43 196 8.2±1.3 9.4±2.1 9.6±1.5 8.6±1.5 39.2±3.9**0.91±0.08 0.88±0.07 0.86±0.08 0.93±0.08 0.41±0.05 44 46 51 43 196 8.8±0.8 9.2±1.3 10.2±1.5 8.6±1.1 39.2±6.6**
2.3 大鼠30 d喂养试验
表2 抗氧化剂混合物对小鼠精子畸形率的影响Table2 Effects of antioxidants compounds on sperm malformation rate ofmice(±s,n=10)
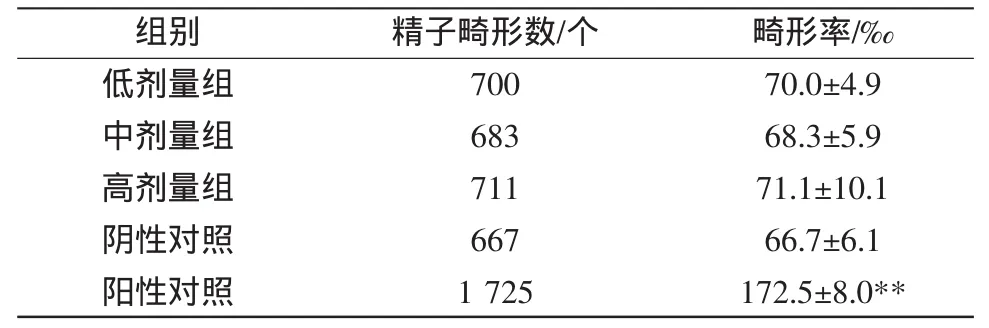
表2 抗氧化剂混合物对小鼠精子畸形率的影响Table2 Effects of antioxidants compounds on sperm malformation rate ofmice(±s,n=10)
**.与阴性对照组相比,P<0.01。
畸形率/‰70.0±4.9 68.3±5.9 71.1±10.1 66.7±6.1 172.5±8.0**组别低剂量组中剂量组高剂量组阴性对照阳性对照精子畸形数/个700 683 711 667 1 725
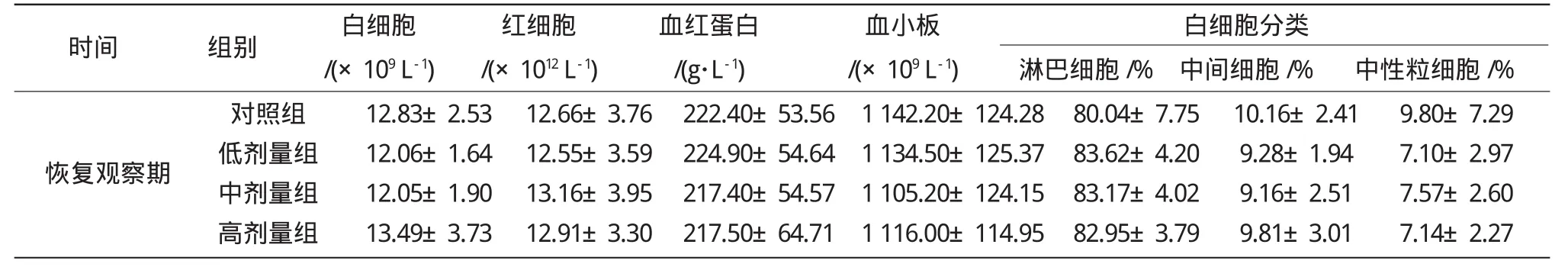
染毒期间,大鼠无死亡,一般体征无异常,各剂量组大鼠体重、进食量及食物利用率与阴性对照组比较差别没有统计学意义(P>0.05)。由表3可知,在染毒期间及恢复期,与阴性对照组比较,各剂量组大鼠白细胞、红细胞、血红蛋白、血小板及白细胞分类的检验结果比较,差异无统计学意义(P>0.05);由表4可知,各剂量组大鼠血清总蛋白、白蛋白、谷丙转氨酶、谷草转氨酶、碱性磷酸酶、总胆红素、尿素、肌酐、甘油三酯、总胆固醇、肌酸激酶、葡萄糖生化检查结果与阴性对照组相比,差异无统计学意义(P>0.05);由表5和表6可知,各试验组大鼠主要脏体比与阴性对照组相比,差异无统计学意义(P>0.05)。受试物染毒30 d后,停药恢复性观察2周,对大鼠的主要脏器进行病理组织学检查,结果表明大鼠脑、心、肺、肝、肾、胰、肾上腺、脾、胃、十二指肠、睾丸、附睾、子宫、卵巢、大肠、胸腺等经肉眼及镜检均无病理性改变,可初步判定受试物对大鼠无亚慢性毒性作用。
3 结论
表3 抗氧化剂混合物试验末期对大鼠血常规的影响Table3 Effects of antioxidants compounds on blood routine andwhite blood cell classification of the terminal stage of rats(±s,n=10)

表3 抗氧化剂混合物试验末期对大鼠血常规的影响Table3 Effects of antioxidants compounds on blood routine andwhite blood cell classification of the terminal stage of rats(±s,n=10)
时间 组别 白细胞/(×109 L-1)红细胞/(×1012 L-1)血红蛋白/(g·L-1)血小板/(×109 L-1) 淋巴细胞/%白细胞分类中间细胞/% 中性粒细胞/%给药末期对照组低剂量组中剂量组高剂量组12.61±3.17 12.67±3.83 11.28±2.54 12.55±4.20 12.81±3.98 12.41±4.39 12.69±4.28 12.75±4.20 209.40±49.67 202.90±51.00 206.30±47.67 212.20±55.09 1 083.60±126.03 1 054.10±88.22 1 124.00±129.50 1 074.80±127.78 81.51±4.56 82.11±4.70 82.38±3.76 82.05±3.02 11.00±2.64 10.54±3.04 11.06±2.73 10.94±2.62 7.61±2.65 7.68±1.94 6.56±1.96 7.19±1.27
本试验针对塑料医药包装材料中常用的BHT、Irganox1010、Irganox1076、Irgafos168[10]4种抗氧化剂混合物的
毒性进行研究。结果显示:小鼠急性经口LD50>10 000mg/kg,属无急性毒性级;小鼠骨髓微核试验、小鼠精子致畸试验结果均为阴性,可初步判定无染色体损伤及精子损害毒性;30 d喂养试验显示大鼠体重、食物利用率、血常规、血液生化指标、脏器比、以及心、肝、脾、肺、肾、肠胃、脑、生殖器官的病理组织学检查均未见异常改变,表明抗氧化剂混合物无显著亚慢性毒性。
续表3
表4 抗氧化剂混合物对大鼠试验末期血液生化的影响Table4 Effects of antioxidants on blood biochemistry of the terminal stage of rats(±s,n=10)
时间 组别 总蛋白/(g·L-1) 白蛋白/(g·L-1) 谷丙转氨酶/(U·L-1)谷草转氨酶/(U·L-1)碱性磷酸酶/(U·L-1)总胆红素/(μmol·L-1)给药末期恢复性观察期对照组低剂量组中剂量组高剂量组对照组低剂量组中剂量组高剂量组60.43±6.32 58.23±6.00 57.71±3.97 56.03±4.60 56.97±5.12 57.52±4.52 54.95±4.46 54.97±4.17 30.58±3.17 29.61±2.71 29.61±3.03 29.00±2.85 28.01±2.12 28.40±2.17 28.02±2.35 28.57±2.45 39.09±11.11 41.95±8.18 44.70±11.76 43.78±6.95 39.87±8.74 42.12±9.19 42.59±5.17 46.74±6.16 121.47±23.59 120.53±23.28 129.93±17.33 129.67±13.75 121.76±23.52 122.19±22.18 117.56±24.51 126.55±18.85 222.08±36.85 210.90±47.99 259.73±65.17 227.07±54.28 220.66±50.82 217.59±59.93 224.10±34.10 219.65±62.38 6.26±1.84 5.65±1.73 5.96±1.28 5.89±1.33 6.36±1.84 6.24±1.92 6.17±1.63 6.08±1.44时间 组别 尿素/(mmol·L-1)肌酐/(μmol·L-1)甘油三酯/(mmol·L-1)总胆固醇/(mmol·L-1)肌酸激酶/(U·L-1)葡萄糖/(mmol·L-1)给药末期恢复性观察期对照组低剂量组中剂量组高剂量组对照组低剂量组中剂量组高剂量组11.93±2.19 11.34±2.59 10.86±1.79 10.89±1.56 11.43±1.90 11.22±2.08 11.61±2.40 11.45±2.01 94.31±7.96 90.38±8.29 93.43±11.67 90.26±6.59 93.06±13.75 94.04±9.91 91.44±7.49 92.25±8.43 1.86±0.62 1.92±0.54 1.40±0.39 1.45±0.35 1.99±0.67 1.95±0.52 1.81±0.48 2.03±0.49 1.74±0.27 1.71±0.28 1.70±0.25 1.77±0.26 1.66±0.22 1.81±0.20 1.62±0.20 1.64±0.16 621.53±171.29 686.81±157.19 680.98±146.54 740.88±127.87 723.86±181.14 837.69±408.55 741.86±194.80 770.02±201.32 11.68±2.41 11.18±2.16 10.82±2.27 11.04±2.58 11.25±3.12 12.05±2.41 10.64±2.02 11.89±2.25
表5 抗氧化剂混合物对试验雌性大鼠脏器系数的影响Table5 Effects of antioxidants compounds on the organ/body ratios of female rats(±s,n=10) /(10-2g·g-1)
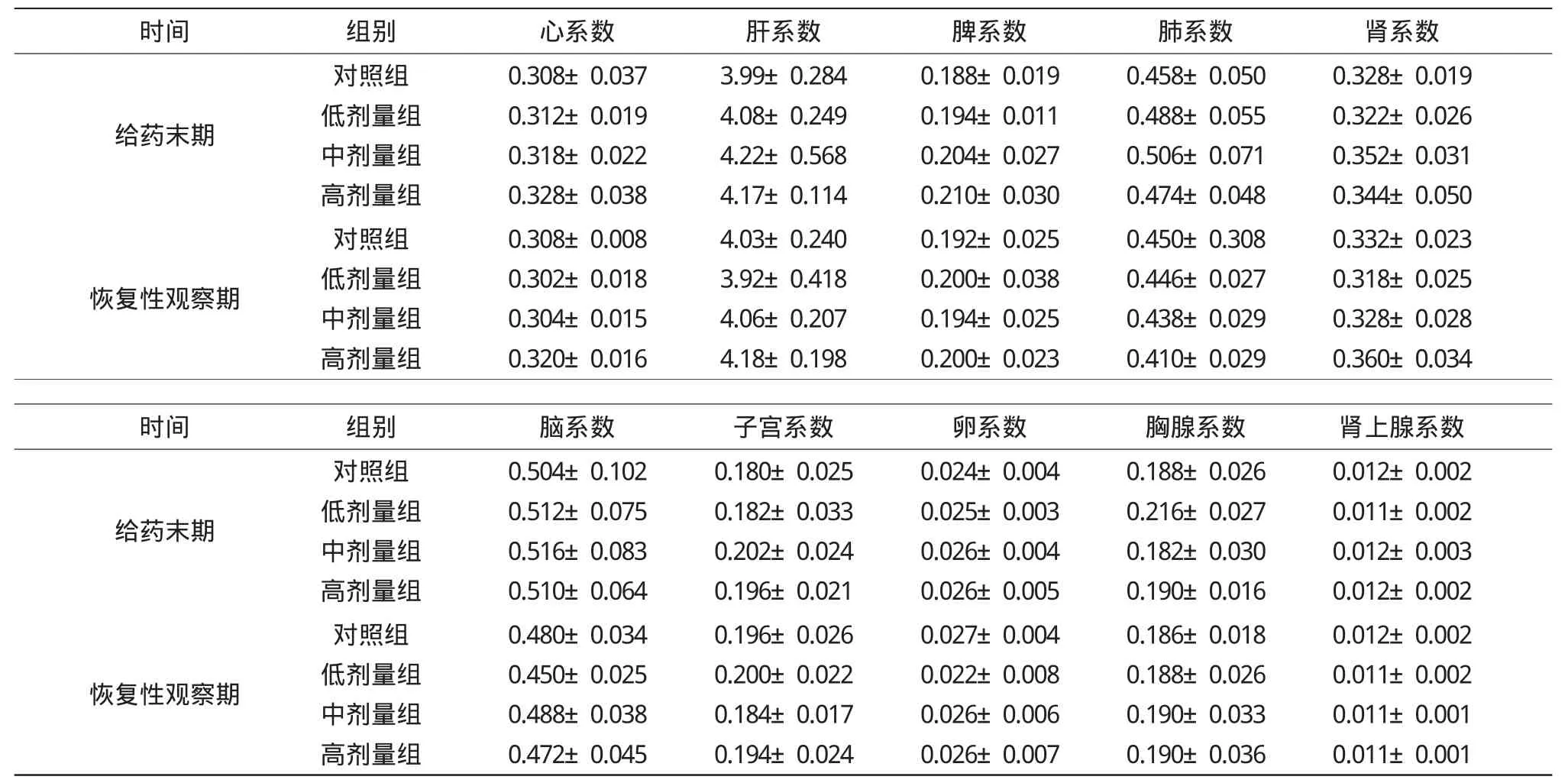
表5 抗氧化剂混合物对试验雌性大鼠脏器系数的影响Table5 Effects of antioxidants compounds on the organ/body ratios of female rats(±s,n=10) /(10-2g·g-1)
时间 组别 心系数 肝系数 脾系数 肺系数 肾系数给药末期对照组低剂量组中剂量组高剂量组0.308±0.037 0.312±0.019 0.318±0.022 0.328±0.038 3.99±0.284 4.08±0.249 4.22±0.568 4.17±0.114 0.188±0.019 0.194±0.011 0.204±0.027 0.210±0.030 0.458±0.050 0.488±0.055 0.506±0.071 0.474±0.048 0.328±0.019 0.322±0.026 0.352±0.031 0.344±0.050恢复性观察期0.332±0.023 0.318±0.025 0.328±0.028 0.360±0.034时间 组别 脑系数 子宫系数 卵系数 胸腺系数 肾上腺系数对照组低剂量组中剂量组高剂量组0.308±0.008 0.302±0.018 0.304±0.015 0.320±0.016 4.03±0.240 3.92±0.418 4.06±0.207 4.18±0.198 0.192±0.025 0.200±0.038 0.194±0.025 0.200±0.023 0.450±0.308 0.446±0.027 0.438±0.029 0.410±0.029给药末期恢复性观察期对照组低剂量组中剂量组高剂量组对照组低剂量组中剂量组高剂量组0.504±0.102 0.512±0.075 0.516±0.083 0.510±0.064 0.480±0.034 0.450±0.025 0.488±0.038 0.472±0.045 0.180±0.025 0.182±0.033 0.202±0.024 0.196±0.021 0.196±0.026 0.200±0.022 0.184±0.017 0.194±0.024 0.024±0.004 0.025±0.003 0.026±0.004 0.026±0.005 0.027±0.004 0.022±0.008 0.026±0.006 0.026±0.007 0.188±0.026 0.216±0.027 0.182±0.030 0.190±0.016 0.186±0.018 0.188±0.026 0.190±0.033 0.190±0.036 0.012±0.002 0.011±0.002 0.012±0.003 0.012±0.002 0.012±0.002 0.011±0.002 0.011±0.001 0.011±0.001
表6 抗氧化剂混合物对试验雄性大鼠脏器系数的影响Table6 Effects of antioxidants compounds on the organ/body ratios ofmale rats(±s,n=10) /(10-2g·g-1)

表6 抗氧化剂混合物对试验雄性大鼠脏器系数的影响Table6 Effects of antioxidants compounds on the organ/body ratios ofmale rats(±s,n=10) /(10-2g·g-1)
时间 组别 心系数 肝系数 脾系数 肺系数 肾系数给药末期恢复性观察期对照组低剂量组中剂量组高剂量组对照组低剂量组中剂量组高剂量组0.308±0.015 0.310±0.012 0.310±0.022 0.318±0.036 0.322±0.027 0.314±0.021 0.304±0.018 0.316±0.015 4.26±0.395 4.05±0.177 4.09±0.434 4.34±0.371 4.17±0.233 3.97±0.265 4.06±0.178 4.09±0.268 0.200±0.026 0.182±0.024 0.204±0.011 0.202±0.029 0.192±0.024 0.206±0.023 0.204±0.017 0.200±0.019 0.464±0.036 0.474±0.053 0.456±0.051 0.448±0.050 0.426±0.047 0.460±0.061 0.422±0.053 0.408±0.029 0.356±0.025 0.340±0.027 0.344±0.029 0.362±0.052 0.358±0.032 0.340±0.019 0.346±0.024 0.382±0.040时间 组别 脑系数 附睾系数 睾丸系数 胸腺系数 肾上腺系数给药末期恢复性观察期对照组低剂量组中剂量组高剂量组对照组低剂量组中剂量组高剂量组0.454±0.023 0.422±0.033 0.440±0.037 0.440±0.033 0.450±0.051 0.466±0.064 0.468±0.036 0.460±0.043 0.112±0.013 0.124±0.026 0.122±0.013 0.124±0.018 0.130±0.025 0.120±0.020 0.124±0.015 0.124±0.015 0.396±0.052 0.440±0.052 0422±0.026 0.424±0.029 0.404±0.033 0.396±0.036 0.422±0.028 0.410±0.028 0.162±0.026 0.168±0.024 0.162±0.028 0.164±0.039 0.176±0.027 0.174±0.019 0.186±0.034 0.182±0.029 0.010±0.002 0.010±0.003 0.011±0.003 0.010±0.003 0.011±0.003 0.011±0.002 0.011±0.003 0.011±0.003
由本试验结果可知,BHT、Irganox1010、Irganox1076、Irgafos168混合物无明显的毒性作用,并且由于4种抗氧化剂不溶于水、见光不稳定且推荐量小于0.5%使得实际液体药品中抗氧化剂的迁移量非常少[11],所以在医药包装材料中使用以上4种抗氧化剂是相对安全的。但是,研究表明可能存在微量迁移物与药品发生相互作用导致药效降低的隐患,如赵霞[12]在药用丁基胶塞与头孢曲松钠的相容性研究中,得出丁基胶塞中抗氧化剂在药物的贮存过程中,容易从胶塞中迁移至药物中,进而引起药物溶解度的下降,使药物溶液的澄清度变差,影响药物的稳定性。所以,在实际应用中,应综合考虑药品与医药包装材料中添加剂的性质,正确选择合适的包装材料。
1 赵天琪.对100家生产企业164份药品说明书的调查分析[J].中国药房,1997,8(4):178.
2 王利兵,赵青,李灼坤,等.食品包装材料中残留物全氟辛酸盐毒理学研究[J].食品科学,2008,29(10):586~592.
3 张弢.国内外有关塑料助剂研究的期刊文摘[J].塑料助剂,2004(1):48.
4 林勤保,李小梅,宋欢,等.聚乙烯塑料包装材料中4中抗氧化剂向脂肪食品模拟物迁移的研究 [J].分析科学学报,2010,26(6):631~635.
5 徐小薇,杜小莉,李大魁,等.3种不同材质输液容器对15种药物的吸着性实验[J].中国药学杂志,2004,39(3):206~208.
6 聂新华,阎翠环,陶金成,等.3种材质输液容器对药物的相容性及吸附性考察[J].中国药房,2005,16(16):1 273~1 275.
7 张磊.0.9%氯化钠注射液中两种酯类阻氧剂的测定[J].安徽医药,2011,15(12):1 514~1 516.
8 张磊,黄葆华.5%葡萄糖注射液中外源性抗氧剂的测定[J].安徽医药,2011,14(12):1 400~1 402.
9 严瑞娟,肖娟,张水寒,等.五层共挤膜输液用膜中4中抗氧化剂的同时测定及迁移研究[J].药品评价研究,2012,35(5):354~358.
10 梁诚.塑料抗氧剂生产现状与发展趋势[J].塑料助剂,2004(2):4~7.
11 刘志刚,王志伟.3种聚烯烃抗氧化剂在不同食品模拟物内的不稳定性试验研究[J].包装工程,2008,29(4):1~3.
12 赵霞.药用丁基胶塞与头孢曲松钠的相容性研究[D].北京:中国协和医科大学,2006.
