自噬基因融合蛋白重组多克隆抗体的纯化与检测
2013-04-25朱雄伟张佑红徐智鹏苏腾甲翟莉莉
朱雄伟,张佑红,徐智鹏,苏腾甲,熊 瑶,翟莉莉
(武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北 武汉 430074)
0 引 言
免疫学技术正沿着基础研究-应用研究-高技术开发研究3条主线在开展,三者互相促进,推动现代医学的发展[1].杂交瘤技术的建立和细胞因子对免疫细胞发育、分化的发现,基因工程技术的发展,使实验室的研究直接转向生物高技术产品的开发,如重组细胞因子、单克隆抗体及其相应的试剂盒、多克隆抗体、基因工程抗体和疫苗等已经或正在投入临床使用,特别是抗体药物以其对人体无毒无副作用、完全天然和高度特异性的疗效,越来越显示其优势,并创造出巨大的社会效益和经济效益[2].
1962年,Ashford等[3]报道在电子显微镜下发现肝细胞自噬现象,近年来由于发现与自噬相关的基因,以及自噬在生物体生理和病理等方面的作用,自噬基因融合蛋白(ATG12)是与自噬相关基因表达的蛋白.本研究合成带谷胱甘肽转移酶(GST)标签ATG12融合蛋白来免疫新西兰大白兔,制备多克隆抗体,并用免疫亲和纯化方法提纯抗血清中的多克隆抗体、酶联免疫吸附法(ELISA)检测抗体效价、蛋白印迹(Western blotting)检测抗体特异性及在组织中的表达情况、聚丙烯酰胺凝胶电泳(SDS-PAGE)检测其浓度.
1 实验部分
1.1 材 料
1.1.1 研究对象 新西兰大白兔.
1.1.2 实验试剂 抗原;乙醇;20 mmol/L 磷酸缓冲溶液p H 7.2;福氏佐剂;GST透析液;His溶液;PBS溶液;couping buffer;p H 5.0的甘氨酸;p H 2.0的 HCl溶液;1 mol/L Tris封闭液;p H 5.0 HCl溶液;CBB 溶液;0.01 mol/L Tris p H 7.5中和液;甘油;防腐剂Na N3;HRP酶标二抗;质量分数2%SKL;beads;0.01 mol/L PBS(p H 7.3);10% 分离胶;质量分数4% 浓缩胶;G250考马斯亮蓝溶液;0.15 mol/L NaCl溶液;2×(5×)SDS上样缓冲液;甲醇;电泳缓冲液;转移缓冲液;10×丽春红染液、封闭液;TBST;TBS;ECL显影底物;显影液;定影液;DAB溶液;化学发光试剂、HRP酶标二抗;脱脂奶粉;1 mol/L的Na HCO3;TMB显色液;所有试剂均为分析级.
1.2 实验方法
1.2.1 抗血清的制备 具体方法如下[4]:
a.新西兰大白兔的免疫.免疫途径有多种多样,如静脉内、腹腔内、肌肉内、皮内、皮下、淋巴结内注射等,一般常用皮下或背部多点皮内注射,每点注射0.1 mL左右.抗原剂量,首次剂量为300~500μg,加强免疫的剂量约为首次剂量为1/4左右.每2~3周加强免疫一次.加强免疫时用不完全佐剂,首次免疫时皮下注射百日咳疫苗0.5 m L,加强免疫时不必注射百日咳疫苗.在第2次加强免疫后2周,从耳缘静脉取2~3 m L血,制备血清,检测抗体效价.
b.抗血清的采集与保存.取兔血有两种方法,一是耳缘静脉或耳动脉放血,一是颈动脉入血,也可心脏采血.取动脉或静脉放血时,将兔放入一个特造的木匣或笼内,耳露于箱(笼)外,也可由另一人捉住兔身.剪去耳缘的毛,用少许二甲苯涂抹耳廓,30 s后,耳血管扩张、充血.用手轻拉耳尖,以单面剃须刀或尖的手术刀片,快速切开动脉或静脉,血液即流出,每次可收集30~40 m L.然后用棉球压迫止血,凝血后洗去二甲苯.二星期后,可在另一耳放血.此法可反复多次放血.颈动脉放血时,将兔仰卧,固定于兔台,剪去颈部的毛,切开皮肤,暴露颈动脉,插管,放血.取收集的血液在37℃恒温箱中放置30 min以防止激活补体系统,再将试管在4℃放置过夜使血液凝固.用药铲将血凝块从管壁上拨落,将血液转移至塑料离心管中,于4℃下4 000 r/min离心10 min.在无菌条件,吸出血清,分装,可在-20℃保存数年.
1.2.2 抗体的纯化 具体步骤如下[5]:
a.抗原柱子的制备.找到相应的血清和抗原、抗原的透析(对非包涵体蛋白)、活化beads、抗原与beads连接、封闭beads.
b.抗血清的预处理.将解冻好的血清在3 600 r/min,条件下离心17 min;除去离心后浮在表面的脂肪,将血清转移到标记好的瓶子中备用,注意尽量不要将沉在管底的血细胞倒出;对免疫原是GST融合蛋白的血清,同时是纯化抗原也是GST融合蛋白,此时需过GST柱子,吸附掉anti-GST的抗体.注意此时要留抗原小样,做ELISA检测看anti-GST的抗体有没有除尽.
c.beads与对应的抗血清的结合.将连接好抗原的beads和对应的抗血清一起孵育,封口后排气,在转子上固定好,孵育,室温2 h或4℃过夜,让血清流出纯化管,收集,10 m L PBS洗涤三次.
d.收集抗体.加入10 mL p H5.0甘氨酸,预洗脱,加入预冷的HCl洗脱液.同时检测收集的抗体浓度,确定收集峰,收集浓度高抗体,于4℃暂时保存.
e.浓缩和透析.将浓度不高的抗体吸水浓缩,注意放4℃保持低温.浓缩好后透析.次日检测收集的抗体浓度,确定收集峰.收集浓度高抗体,于4℃暂时保存.
f.beads的清洗和保存.依次用Tris和PBS洗,加入甘油、防腐剂-20℃保存.
1.2.3 ELISA 检测[6-8]a.抗原包被.用抗原包被液(1 mol/L的 Na HCO3)稀释抗原,50微升/孔,蛋白量为2~3μg/m L,孵育,室温2 h或4℃过夜,用GST标签蛋白作对照.
b.封闭.倒出孔内溶液,拍干,每孔加入100 u L稀释液 (3% 脱脂牛奶+PBST),封闭,放摇床上室温孵育1 h.
c.加一抗.倒出孔内溶液,拍干,洗3次,每次5 min.倒出孔内溶液,拍干,加入一抗,摇床上室温孵育1 h.
d.加二抗.倒出孔内溶液,拍干,洗三次,每次5 min.倒出孔内溶液,拍干,加入二抗,摇床上室温孵育1 h.
e.加底物显色.TMB显色液A、B按1∶1混合,100μL/孔,放摇床上15 min内观察结果,照相.
f.SDS-PAGE电泳.电泳时间一般4~5 h,电压为40 V较好,也可用60 V.电泳至溴酚蓝刚跑出即可终止电泳,进行转膜.
g.转 膜.
(1)转一张膜需准备6张7.0~8.3 cm 的滤纸和1张7.3~8.6 cm的PVDF膜,将切好的PVDF膜置于甲醇上浸才可使用.
(2)在加有转移液的塑料盒里放入转膜用的夹子、两块海绵垫、一支玻棒、滤纸和浸过的膜.
(3)将夹子打开使黑的一面保持水平.在上面垫一张海绵垫,用玻棒来回擀几遍以擀走里面的气泡.
(4)要先将玻璃板撬掉才可剥胶,撬的时候动作要轻,要在两个边上轻轻的反复撬.撬一会儿玻璃板便开始松动,直到撬去玻璃板.小心剥下分离胶盖于滤纸上,用手调整使其与滤纸对齐,轻轻用玻棒擀去气泡.在膜上盖3张滤纸并除去气泡.最后盖上另一个海绵垫,擀几下就可合起夹子.整个操作在转移液中进行,要不断的擀去气泡,膜两边的滤纸不能相互接触,接触后会发生短路.
(5)将夹子放入转移槽槽中,要使夹的黑面对槽的黑面,夹的白面对槽的红面.电转移时会产热,在槽的一边放一块冰来降温.一般用60 V转移2 h或40 V转移3 h.(6)转完后将膜用1×丽春红染液染5 min,然后用水冲洗掉没染上的染液就可看到膜上的蛋白.将膜晾干备用.
h.免疫反应.
(1)将膜用TBS从下向上浸湿后,移至含有封闭液的平皿中,室温下脱色摇床上摇动封闭1 h.
(2)将一抗用TBST稀释至适当浓度,撕下适当大小的一块儿保鲜膜铺于实验台面上,四角用水浸湿以使保鲜膜保持平整;将抗体溶液加到保鲜膜上;从封闭液中取出膜,用滤纸吸去残留液后,将膜蛋白面朝下放于抗体液面上,室温下孵育1~2 h后,用TBST在室温下脱色摇床上洗两次,再用TBS洗一次.
(3)准备二抗稀释液并与膜接触,室温下孵育1~2 h后,用TBST在室温下脱色摇床上洗两次,每次10 min;再用TBST洗一次,10 min,进行化学发光反应.
i.化学发光、显影、定影[9-10].
(1)将A和B两种试剂在保鲜膜上等体积混合,1 min后,将膜蛋白面朝下与此混合液充分接触,1 min后,将膜移至另一保鲜膜上,去尽残液,包好,放入暗盒中.
(2)在暗室中,将1×显影液和定影液分别到入塑料盘中;在红灯下取出胶片,用切纸刀剪裁适当大小;打开暗盒,把胶片放在膜上,一旦放上,便不能移动,关上暗盒,开始计时;根据信号的强弱适当调整曝光时间,一般为1 min或5 min,也可选择不同时间多次压片,以达最佳效果;曝光完成后,打开暗盒,取出胶片,迅速浸入显影液中显影,待出现明显条带后,即刻终止显影.显影时间一般为1~2 min(20~25℃),显影结束后,马上把胶片浸入定影液中,定影时间一般为5~10 min,以胶片透明为止,用自来水冲去残留的定影液后,室温下晾干.
2 结果与讨论
2.1 GST柱子分析
免疫原是GST融合蛋白的血清,同时是纯化GST柱子的穿流夜Ft GST融合蛋白,此时需过GST柱子,用来吸附掉anti-GST的抗体.图1所示的是未过GST柱子的血清F和GST柱子的穿流液Ft加入TMB底物后显色反应,表1所示的是血清F与穿流液Ft的稀释梯度[11-12].
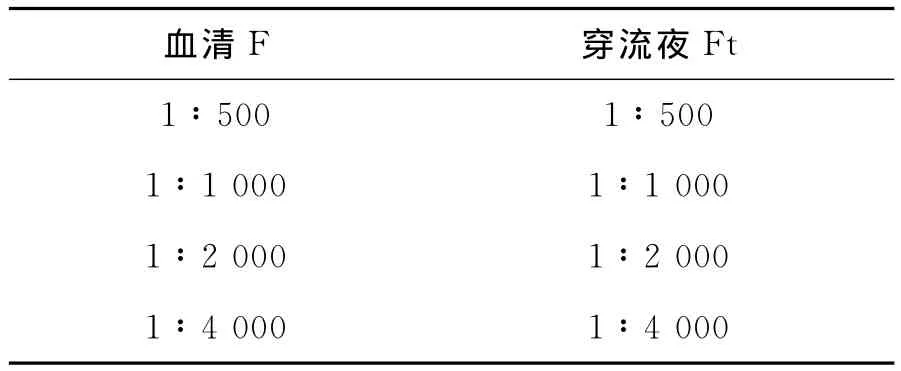
表1 血清F与穿流液Ft的稀释梯度Table 1 Dilution gradient of serum F and transit fluid Ft

图1 血清F(“1”)与穿流液Ft(“2”)的显色反应Fig.1 Chromogenic reaction of serum F and transit fluid
由图1和表1可知:在四种梯度下,血清F加TMB底物显色后四孔全部显蓝色,而穿流液Ft全部无色,说明anti-GST已除干净.
2.2 ELISA结果分析
图2所示的是未过GST柱子的血清F、GST柱子的穿流液Ft和抗体Pu加入TMB底物后显色反应、表2所示的是血清F、穿流液Ft和抗体Pu的稀释梯度.

图2 血清F、穿流液Ft、抗体Pu的显色反应Fig.2 Chromogenic reaction of serum F,transit fluid Ft and antibody Pu
由图2和表2可知,以Ft为参照,F、Ft、Pu显色孔数依次为4,3,4,其中Ft的是底色.结果说明血清还可以进一步纯化,而且收集的纯化血清效果也不错,即稀释度为1:500 000.
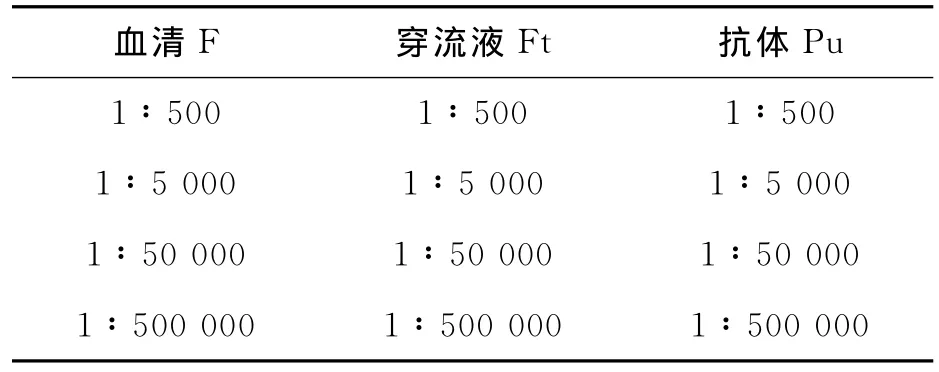
表2 血清F、穿流液Ft、抗体Pu的稀释梯度Table 2 Dilution gradient of serum F,transit fluid Ft and antibody Pu
2.3 SDS-PAGE测定 ATG 12多克隆抗体浓度[13]
使用SDS-PAGE测定蛋白质浓度,图3所示的是ATG12多克隆抗体的SDS-PAGE图.如图3所示:左边的条带为ATG12蛋白,右边为marker条带,marker的分子质量图中已经标出.以67 k D为参照来估测蛋白浓度,67 k D代表的marker质量浓度为每10μL含8μg,而目的蛋白的颜色只有其5/8深,则蛋白浓度为每10μL 5/8×8μg,即每10μL为5μg.

图3 ATG12多克隆抗体的SDS-PAGEFig.3 SDS-PAGE of ATG12 polyclonal antibody

图4 免疫印记蛋白质大小Fig.4 Size of Immune mark protein
2.4 Western blotting分析
图4所示的是免疫印记蛋白质大小及在Colon(结肠)中的表达条带中的表达情况.
由图4可知:Western blotting条带上的点清晰,说明其能在结肠中较好的表达,由图知蛋白质大小为55 k D左右.
3 结 语
使用带GST标签的融合蛋白免疫新西兰大白兔,制备得到ATG12多克隆抗体,运用ELISA及Western blotting检测结果显示此抗体效价及特异性较高,Western blotting检测结果显示其在结肠组织中表达,SDS-PAGE结果显示其浓度也较高.本研究成功得到浓度较高的ATG12多克隆抗体,并证实其在结肠组织中表达较明显.
致谢
感谢天惠生物公司对本研究的支持与帮助.
[1]周建光,杨梅.免疫学技术的发展及临床应用[J].医疗装备,2011,24(7):49-51.
[2]孔维,杨文辉.单克隆抗休及其应用的研究进展[J]畜牧兽医科技信息,2009(1):9-11.
[3]Ashford T P,Porter K R.Cytoplasmic components in hepatic cell lysosomes[J].The Journal of cell biology,1962(1):198-202.
[4]谭荣荣,刘明炎,龚自明.茶尺蠖核型多角体病毒多克隆抗体的制备及检测应用[J].湖北农业科学,2012,51(2):298-301.
[5]张花美,李因来,潘熙萍.抗麦草畏多克隆抗体v的制备及其间接竞争ELISA检测方法的建立[J].浙江大学学报:农业与生命科学版,2012,38(2):153-158.
[6]Susumu H T,Suzuki K,Akahori Y.Antibody-dependent cell-mediated cytotoxicity is induced by a single-chain Fv-protein III fusion in the presence of a rabbit anti-protein III polyclonalantibody[J].Immunology Letters,2011,136(1):44-48.
[7]Horiguchi T,Urushitani H,Ohta Y.Establishment of a polyclonal antibody against the retinoid X receptor of the rock shell Thais clavigera and its application to rock shell tissues for imposex research[J].Ecotoxicology,2010,19(3):571-576.
[8]Xu M Y,Wang S D.Prokaryotic expression of pathogenesis related protein 1 gene from Nicotiana benthamiana:antifungal activity and preparation of its polyclonal antibody[J].Biotechnology Letters,2012,34(5):919-924.
[9]Anderson G J,Cipolla C M,Kennedy R T.Western Blotting Using Capillary Electrophoresis[J].Analytical chemistry,2011,83(4):1350-1355.
[10]Welinder C,Ekblad L.Coomassie Staining as Loading Control in Western Blot Analysis[J].Journal of proteome research,2011,10(3):1416-1419.
[11]Rath A,Glibowicka M,Nadeau V G.Detergent binding explains anomalous SDS-PAGE migration of membrane proteins[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(6):1760-1765.
[12]Hans J C,Wessels R O.LC-MS/MS as an alternative for SDS-PAGE in blue native analysis of protein complexes[J].Cell & Molecular Biology,2009,9(17):4221-4228.
[13]Riechers A,Schmidt F,Stadlbauer S.Detection of Protein Phosphorylation on SDS-PAGE Using Probes with a Phosphate-Sensitive Emission Response[J].Bioconjugate Chemistry,2009,20(4):804-807.
