濒危药用植物桃儿七野生居群遗传多样性与遗传结构的SCoT分析
2013-04-22陈大霞,赵纪峰,刘翔,王昌华,张植伟,秦松云,钟国跃
陈大霞,赵纪峰,刘翔,王昌华,张植伟,秦松云,钟国跃

[摘要] 目的:揭示珍稀濒危药用植物桃儿七的遗传多样性水平及居群遗传结构特点。方法:采用新型分子标记SCoT对来源于我国的6个桃儿七野生居群共45个个体进行遗传多态性检测。运用POPGENE软件计算相关遗传参数,UPGMA方法聚类,结合MEGA5软件生成树状图。结果:筛选出的27条引物,共检测到350个位点,其中284个为多态位点,平均每条引物扩增所得多态条带为10.52条。物种水平上,桃儿七6个野生居群的遗传多样性较为丰富,PPB 79.27%,Ne1.332 7,H 0.210 9,Hsp0.328 6。在居群水平上,遗传多样性水平较低: PPB 10.48%(4.00%~23.71%),Ne1.0487(1.020 7~1.103 7),H 0.029 7(0.012 9~0.063 1),Hpop 0.046 2(0.019 9~0.098 6)。Nei′s 基因多样性指数计算的居群间遗传分化系数Gst=0.841 1与Shannon′s居群分化系数(Hsp-Hpoppop)/Hsp=0.849 4基本一致,均说明大部分遗传变异存在于居群间。基因流Nm= 0.094 4,表明桃儿七居群间基因交流处于低等水平。Nei′s遗传一致度(I)范围为0.570 8~0.978 7。聚类分析将供试居群分为2 类,相同地理来源或相似生境的材料具有聚为一类的倾向。结论:供试野生桃儿七具有较丰富的遗传多样性,为有效保护和改良种质资源奠定了一定的基础。
[关键词] 桃儿七;SCoT;遗传多样性;遗传结构
桃儿七Sinopodophyllum emodi(Wall.)Ying为小檗科桃儿七属多年生草本植物,《神农本草经》中以“鬼臼”之名收载,药用历史悠久,其根及根状茎、果实均可药用,具有祛风除湿、活血化瘀、化痰止咳、解毒的功效,用于风湿痹痛、肢体麻木、胃脘疼痛、跌打损伤、劳伤咳嗽等证,并可解铁棒锤中毒。目前,桃儿七地下部分主要作为抗癌药物Vp-16(etoposide)等合成的前体物质鬼臼毒素(podophyllotoxin)的提取原料,果实则为藏药材“小叶莲”(藏族语称“奥勒莫色”)。桃儿七为我国特有种,主要分布于陕西、甘肃、青海、四川、云南、西藏等地,生于海拔1 500~4 300 m的高山灌丛、草丛及路旁。目前,桃儿七的人工栽培尚未规模化,药材主要来源于野生。在利益的驱使下,野生桃儿七掠夺式地被大量采挖,致使植被遭受严重破坏,生境急剧恶化,加之藏医以其果实入药,极大的削弱了群体的天然繁殖能力。目前,桃儿七野生群体数目和群体规模在不断变小,分布区域日渐缩减,资源面临濒危的境地,早在1992年即已被列入《中国珍稀濒危植物名录》,并被《中国植物红皮书-稀有濒危植物》收录[1],为国家三级保护植物。近年来,人们逐渐认识到保护桃儿七资源的重要意义,并开展了资源分布调查、野生变家种等保护工作,但大多数保护活动仍然是在缺乏基本的生物学研究尤其是保护遗传学研究的情况下进行的,很难制定科学的保护措施。此外,笔者等的研究表明,不同产地与小生境生长的桃儿七(居群),其生物量及地下部分中的鬼臼毒素的含量均存在较大差异[2-3],提示桃儿七药材质量可能与其遗传特性有关。为合理保护和利用桃儿七资源,有必要研究其遗传多样性,分析其遗传结构。
目标起始密码子多态性(start codon targeted polymorphism,SCoT)分子标记技术是Collard和Mackill开发的一种新型目标分子标记技术[4],以其操作简便、成本低廉、多态丰富、扩增效率高、引物具有通用性等优点,已被成功应用于多种植物的遗传多样性[4-7]或基因差异表达研究[8-9]。就桃儿七而言,近来许多学者对桃儿七资源调查[2]、繁殖生物学[10]、育苗及栽培技术[11-12]、生态适应机制[13]、化学[3]等方面进行了许多研究。关于桃儿七的遗传多样性的研究不多,仅见于肖猛等[14-15]对桃儿七部分来源地的遗传多样性进行了分析评价。为促进桃儿七资源的合理保护与利用技术进步,本文采用SCoT标记技术对我国6个桃儿七自然居群的遗传结构和种内遗传多态性进行了分析。
1 材料和方法
1.1 样品 桃儿七采集于我国的西藏、青海、四川,共计6 个野生居群,45 个个体,由重庆市中药研究院秦松云副研究员进行物种鉴定。收集当年生新鲜幼嫩叶片,洗净、晾干后,放入装有硅胶的自封袋,快速干燥,并用GPS定位系统记录各居群生长的海拔、经度及纬度(表1)。
1.2 仪器与试剂 S1000TM Thermal Cycler 热循环仪(BIO-RAD),Gel Doc XR凝胶成像系统(BIO-RAD),Smart SpeeTM3000型分光光度计(BIO-RAD公司),DYCZ-24B型电泳槽(北京市六一仪器厂)、DYY-6C型电泳仪(北京市六一仪器厂)。
SCoT引物(上海生工生物工程有限公司)、Trans 2K Plus DNA Marker (北京全式金)、植物基因组DNA提取试剂盒(北京天根)、Taq酶(TOYOBO),dNTPs(TaKaRa),SYBR Green核酸染料(北京鼎国代理)、琼脂糖(进口分装)、其余为国产分析纯试剂。
1.3 基因组DNA提取 用天根植物基因组DNA提取试剂盒提取桃儿七基因组DNA。1%琼脂糖凝胶电泳检测DNA的质量,并用紫外分光光度计测定其浓度和纯度,将样品稀释标定到40 mg·L-1,置于-20 ℃冰箱中保存备用。
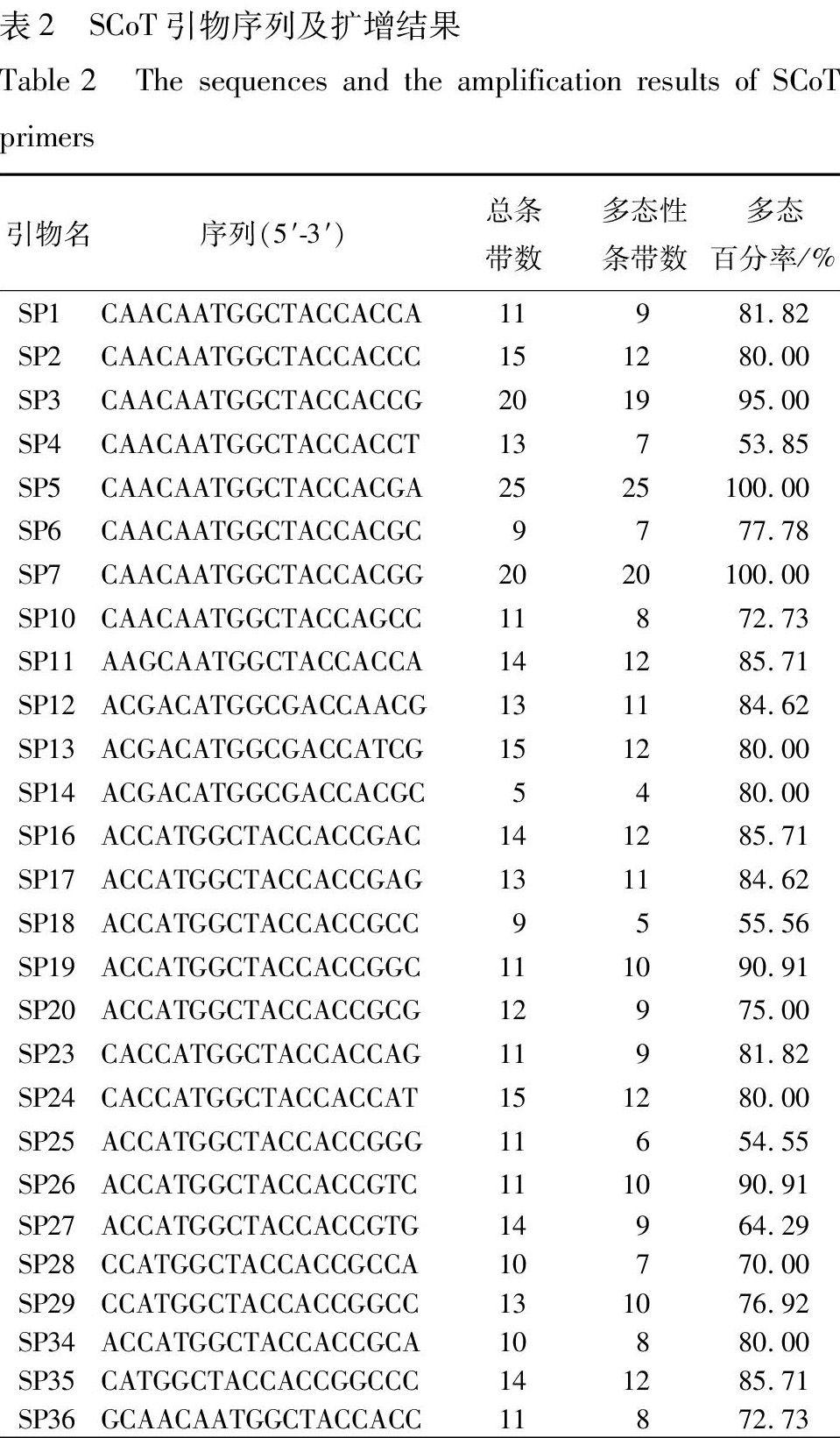
1.4 SCoT分析 SCoT引物采用Collard和Mackill[1]开发的引物,由上海生工生物工程有限公司合成,共计36条。随机抽取2 个DNA模板进行引物筛选,最终确定27 条扩增产物条带清晰、易于区分,且重复性高、稳定性好、具有差异的引物用于样品的多态性检测。具体引物、序列见表2。
SCoT-PCR反应体系:总体积25 μL,内含1×PCR buffer,1.5 mmol·L-1 Mg2+,200 μmol·L-1 dNTP,0.4 μmol·L-1引物,40 ng模板,1 U Taq DNA聚合酶。扩增程序为94 ℃预变性4 min,然后进行36 个循环:94 ℃变性1 min, 50 ℃退火1 min,72 ℃延伸2 min,循环结束后72 ℃延伸10 min,4 ℃保存。
各取PCR扩增产物5 μL,加1 μL 6×DNA Lodding Buffer(内含染料)混匀后,在1.5%的琼脂糖凝胶上电泳分离。缓冲系统为1×TAE,电压150 V。当溴酚蓝指示剂距离琼脂糖凝胶前沿约2~3 cm时停止电泳,在凝胶成像系统上观察、照相、记录。
1.5 数据统计与分析 按电泳图谱上DNA条带的“有”或“无”进行统计,同一位置有条带(扩增阳性)记为“1”,无条带(扩增阴性)记为“0”,形成“0”和 “1”组成的原始矩阵后,输入计算机。采用POPGENE 1.31软件进行数据分析,计算参数包括多态位点百分率(PPB),Shannon′s多样性信息指数(Ho,在物种水平上为Hsp,在居群水平上为Hpop),Nei′s基因多样度指数(H) 、平均每个位点的观察等位基因数(Na)、平均每个位点的有效等位基因数(Ne)、总的基因多样度(Ht )、居群内基因多样度(Hs)、基因分化系数(Gst )、基因流(Nm)和Nei′s遗传距离(D)和遗传一致度(I),并据此采用UPGMA聚类法建立系统聚类分支树状图,分析各群体之间的遗传关系。同时也通过Shannon′s居群分化系数[( Hsp-Hpop)/Hsp]来估测居群间的遗传变异。
2 结果与分析
2.1 SCoT多态性检测 采用27个扩增谱带清晰并呈现多态性的引物对所有45份样品进行SCoT-PCR扩增检测。SCoT标记的多态性见表2:每条引物产生5~25 条扩增带,27 条引物共得到350 条扩增带,其中有284条呈多态性,平均每个引物产生12.96 条扩增带和10.52条多态性带。由此可见,SCoT标记的多态效率检测较高,适用于桃儿七的遗传多样性分析。
2.2 遗传多样性分析 通过POPGENE软件分析,得到桃儿七在物种和居群水平上的相关遗传参数(表3)。在物种水平上,桃儿七的遗传多样性较为丰富,PPB 79.27%,Ne 1.332 7,H 0.210 9,Hsp0.328 6。在居群水平上,6 个居群的遗传多样性均较低,高低排序依次为POP3>POP5>POP2>POP4>POP1>POP6,各群体遗传参数的平均值和变化范围为 PPB 10.48%(4.00%~23.71%),Ne=1.048 7(1.020 7~1.103 7),H=0.029 7(0.012 9~0.063 1),Hpop 0.046 2(0.019 9~0.098 6),表明群体间的遗传多样性存在差异,尤其是POP3与其他居群存在较为显著的差异, POP6居群的遗传多样性最低可能与该居群采集的个体较少有关(仅4个)。
2.3 桃儿七6个居群的遗传结构分析 居群的遗传结构分析包括总的基因多样度(Ht)、居群内基因多样度(Hs)、居群间的基因多样度(Dst=Ht-Hs)、基因分化系数(Gst)和基因流(Nm)等指标。
用Nei′s基因多样度衡量,6 个居群Ht 0.186 9,其中Hs 0.029 7,Dst0.157 2。Nei′s的基因分化系数Gst 0.841 1,表明有84.11%的遗传变异存在于居群间,15.89%的遗传变异存在于居群内,居群间的遗传分化远大于居群内的分化,说明群体间变异是桃儿七的主要变异来源。
用Shannon′s多样性信息指数衡量,物种水平上Shannon′s多样性信息指数Hsp0.328 6,居群水平上Hpop 0.046 2(表4),计算出Shannon′s居群分化系数(Hsp-Hpop)/Hsp为0.849 4,即有84.94% 的遗传变异分布在居群间,14.06%的遗传变异分布在居群内部。以上2 种方法的分析结果完全一致,共同表明桃儿七不同居群间的遗传分化明显,遗传变异主要存在于居群间。
桃儿七居群间基因流[Nm=0.5(1-Gst )/Gst]为0.094 4,小于1,表明桃儿七居群间基因交流处于低等水平,交流比较少,遗传分化程度较高。
2.4 遗传距离与聚类分析 用POPGENE计算出了桃儿七6个野生居群间的Nei′s遗传一致度(I)为0.570 8~0.978 7,遗传距离为0.021 6~0.560 7(表4)。POP1与POP3之间的遗传一致度最低(I 0.570 8),遗传距离最远(D 0.560 7),表明亲缘关系最远。POP5与POP6之间的遗传一致度最高(I 0.978 7),遗传距离最近(D 0.021 6) ,表明亲缘关系最近。
MEGA5基于Nei′s遗传距离绘出的UPGMA聚类分支树状图(图1)表明,6个群体聚为2 类:POP3独为第Ⅰ类,其余5居群聚为第Ⅱ类。在第Ⅱ类中,来源于西藏的2个居群(POP1与POP2)聚为一支,来源于四川2个居群(POP4与POP6)与青海的1个居群(POP6)聚为一支。从供试材料间的聚类结果可以看出,地理来源相同或相近的种质趋向于聚在一类,但也有例外,如POP3独为一支,与各居群的遗传差异较大。
3 讨论
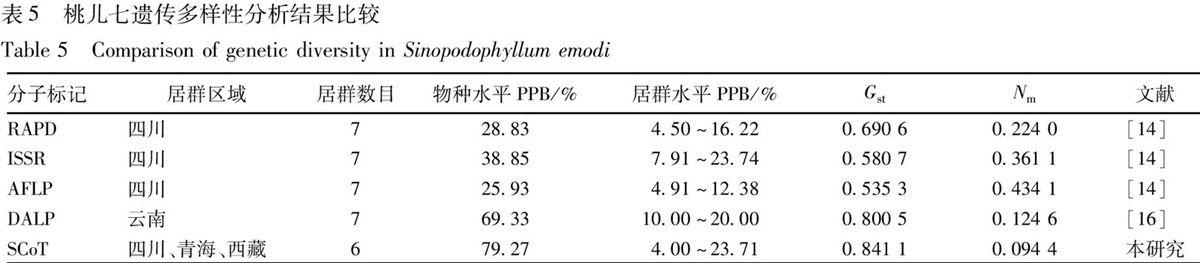
3.1 桃儿七遗传多样性的比较 桃儿七虽然为濒危物种,供试材料中桃儿七野生居群在物种水平上具有较丰富的遗传多样性 (PPB 79.27%)。但在居群水平上其遗传多样性却较低,平均仅为10.48%,且不同居群之间PPB变化幅度较大,其中青海玉树与其他居群表现出明显的遗传差异,PPB高达23.71%。如果将这一居群排除在外,仅用其他5个居群进行遗传结构分析,发现物种水平上PPB为54.14%,由此可见桃儿七居群的遗传多样性及遗传结构研究中,群体的选择非常重要。本研究与已有文献报道的研究结果表明,由于检测手段和研究群体各异,在揭示桃儿七居群遗传多样性和遗传结构状况差异也是较大的(表5)。本研究的结果与吴刚[16]等的结果较为一致,与肖猛[14]的研究差异较大。尽管不同研究者所得出的结果存在差别,通过有效和准确地分析和利用这些遗传数据,还是可以看出相同的趋势:桃儿七野生居群间基因交流处于低等水平,遗传分化明显,遗传变异主要存在于居群间。同时也可以看到肖猛[14]采用不同的分子标记(RAPD,ISSR,AFLP)对相同的研究材料(四川西部的桃儿七7 个自然居群)的遗传多样性水平和遗传结构进行了分析,3种标记方法得到的结果具有较高的一致性,从分子水平上基本了解了四川西部高原地区桃儿七的遗传多样性和遗传结构状况。
由于所选分子标记自身的特点和研究材料的局限性,要全面的评价桃儿七的群体遗传变异,还需要进一步全面收集种源,采用有效的分子标记对桃儿七遗传多样性的变异大小、时空分布等从遗传学基础上进行系统的剖析,才能真正揭示该物种的进化历史,深入分析其濒危原因和进化潜力,为科学合理地制订保护策略提供理论支持。
3.2 基因流障碍 供试材料居群间基因流为0.094 4,处于极低水平,说明存在明显的基因流障碍。植物种群内和种群间的基因流是借助于花粉、种子、孢子、营养体等遗传物质携带者媒介来实现的,其中花粉和种子的扩散是2种最主要的形式。就桃儿七而言,基因流障碍与其特有的繁育系统、种子的有限传播方式以及地理隔离效应有关。
花粉基因流的强弱和植物的繁育系统有很大关系。桃儿七是一种自交或自交占优势的植物[10],基因流动无法通过传粉的方式来实现, 大大限制了该物种的基因流。因此, 桃儿七分布区的扩张与群体间的基因流动主要通过种子传播来进行。成熟的桃儿七果实中虽然具有较多的种子(平均60粒左右),繁殖系数较高,但种子具有休眠特性,且自然状态下萌发率低,降低了因种子传播而产生的基因流。笔者等在野外调查时发现,同一居群中桃儿七常见有丛生状态(同一果实的种子萌发形成的多个个体形成丛生),证实自然状态下,桃儿七种子的传播方式主要是依靠重力和果实破裂方式进行的,传播的距离相当有限。此外,桃儿七种子的另一种传播途径是依赖人或动物来进行。在进化过程中,桃儿七为有效的传播种子,形成了一些适应机制:成熟的桃儿七果实不含鬼臼毒素,富含糖分,味甜,且果实颜色鲜艳,能吸引人和其他动物食用,为其传播种子[13],但这种传播方式具有极大的随机性。肖猛[14]发现偶尔其种子由牲畜短距离在同居群内扩散,极少情形下因鸟类或人为活动在居群内或居群间传播。由此可见,种子的有限传播也是造成由桃儿七有限基因流的原因之一。
有限的基因流还可能与种群的空间地理隔离效应有关。桃儿七分布区域虽大,野外调查发现桃儿七居群的生境片断化趋势明显,大多居群呈星散岛状分布,彼此隔离,有时一条小河或山谷就成为一个明显的分界线,分布于同一山谷的个体就组成了1个有效居群[16]。且多数居群规模很小,限制了群体间的基因流,产生了明显的遗传漂变。
3.3 桃儿七遗传多样性的保护策略 种质资源的分子评价是对物种进行保护、合理利用和遗传改良的基础。本研究结果表明桃儿七具有较丰富的遗传多样性,为有效保护和改良种质资源奠定了一定的基础。根据桃儿七群体遗传变异特点,提出了桃儿七遗传多样性的保护策略就地保护,重点保护遗传多样性高的群体。杂交育种中进行亲本选配时,种群选择是提高育种效率的重要途径之一,因此,除了对所有种群进行必要的保护外,应重点保护遗传多样性高的地区,如本研究中的青海玉树居群蕴藏着桃儿七丰富的遗传资源;迁地保护,注重取样策略,即在尽可能多的群体中取样。由于桃儿七群体间遗传变异均存在显著的分化,且主要来源于居群间,因此,在迁地保护时应尽可能在较多的群体中取样,而不是在同一群体取多个个体;野生抚育,人为增加基因流动。采用模拟原生态环境的种植方式,通过人工散播种子提高群体间的基因交流,以达到尽可能最大限度的保护和丰富其遗传多样性的目的。
[参考文献]
[1] 傅立国.中国植物红皮书-稀有濒危植物.第1册[M].北京:科学出版社,1992:184.
[2] 赵纪峰,刘翔,王昌华,等.珍稀濒危药用植物桃儿七的资源调查[J].中国中药杂志,2011,36(10):1255.
[3] 黄坤,蒋伟,赵纪峰,等.濒危药用植物桃儿七中鬼臼毒素和总木脂素含量测定[J].中国中药杂志,2012,37(10):1360.
[4] Collard B C Y, Mackill D J.Start codon targeted(SCoT) polymorphism: a simple, novel DNA marker technique for generating gene-targeted markers in plants[J].Plant Mol Biol Rep, 2009,27(1):86.
[5] 陈虎,何新华,罗聪,等.龙眼24个品种的SCoT遗传多样性分析[J].园艺学报,2010,37(10):1651.
[6] 熊发前,蒋菁,钟瑞春,等.目标起始密码子多态性(SC0T)分子标记技术在花生属中的应用[J].作物学报, 2010,36(12):2055.
[7] 韩国辉,向素琼,汪卫星,等.柑橘SCoT分子标记技术体系的建立及其在遗传分析中的应用[J].园艺学报,2011,38(7):1243.
[8] 吴建明,李杨瑞,王爱勤,等.赤霉素诱导甘蔗节间伸长基因的cDNA-SCoT 差异表达分析[J].作物学报,2010,36(11):1883.
[9] 蒋巧巧,龙桂友,李武文,等.SCoT结合克隆测序鉴别湖南甜橙变异类型[J].中国农学通报,2010,27(6):148.
[10] 马绍宾,徐正尧,胡志浩.桃儿七繁殖生物学研究[J].西北植物学报,1997,17(1):49.
[11] 韩彩萍,余治家,樊亚鹏, 等.六盘山野生濒危植物——桃儿七播种育苗技术研究[J].农业科学研究,2010,31(1):29.
[12] 鲍隆友,杨小林,刘玉军.西藏野生桃儿七生物学特性及人工栽培技术[J].中国林副特产,2004,71(4):1.
[13] 马绍宾,胡志浩,李俊.桃儿七生化生态适应的初步研究[J]. 生态学杂志, 1997,16(3):67.
[14] 肖猛.濒危植物桃儿七的遗传多样性研究[D].成都:四川大学,2006.
[15] Xiao M, Li Q, Guo L, et al.AFLP analysis of genetic diversity of the endangered species Sinopodophyllum hexandrum in the Tibetan region of Sichuan province, China[J].Biochem Genet, 2006,44(1/2):47.
[16] 马绍宾,胡志浩.桃儿七分布格局与生态适应的初步研究[J].武汉植物学研究,1996,(14):47.
Genetic diversity and genetic structure of endangered wild Sinopodophyllum
emodi by start codon targeted polymorphism
CHEN Da-xia1, ZHAO Ji-feng1, LIU Xiang1, WANG Chang-hua1, ZHANG Zhi-wei1, Qin Song-yun1, ZHONG Guo-yue2*
(1.Chongqing Academy of Chinese Materia Medica, National Engineering Laboratory for
Propagation of Endangered Traditional Chinese Medicine, Chongqing 400065, China;
2.Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China)
[Abstract] Objective: Revealed the genetic diversity level and genetic structure characteristics in Sinopodophyllum emodi, a rare and endangered species in China.Method: We detected the genetic polymorphism within and among six wild populations (45 individuals) by the approach of Start Codon Targeted (SCoT) Polymorphism.The associated genetic parameters were calculated by POPGENE1.31 and the relationship was constructed based on UPGMA method.Result: A total of 350 bands were scored by 27 primers and 284 bands of them were polymorphic.The average polymorphic bands of each primer were 10.52.At species level, there was a high level of genetic diversity among six populations (PPB=79.27%, Ne=1.332 7, H=0.210 9 and Hsp=0.328 6).At population level, the genetic diversity level was low(PPB=10.48%(4.00%-23.71%), Ne=1.048 7(1.020 7-1.103 7), H=0.029 7(0.012 9-0.063 1), Hpop=0.046 2(0.019 9-0.098 6).The Nei′s coefficient of genetic differentiation was 0.841 1, which was consistent with the Shannon′s coefficient of genetic differentiation (0.849 4).Two calculated methods all showed that most of the genetic variation existed among populations.The gene flow (Nm=0.094 4) was less among populations, indicating that the degree of genetic differentiation was higher.Genetic similarity coefficient were changed from 0.570 8 to 0.978 7.By clustering analysis, the tested populations were divided into two classes and had a tendency that the same geographical origin or material of similar habitats clustered into one group.Conclusion: The genetic diversity of samples of S.emodi is high,which laid a certain foundation for effective protection and improvement of germplasm resources.
[Key words] Sinopodophyllum emodi; SCoT; genetic diversity; genetic structure
doi:10.4268/cjcmm20130227
[责任编辑 吕冬梅]
