薄层生物自显影技术比较新疆2种洋甘菊抗氧化活性
2013-04-22韩松林,李新霞,勉强辉,兰卫,刘岩
韩松林,李新霞,勉强辉,兰卫,刘岩
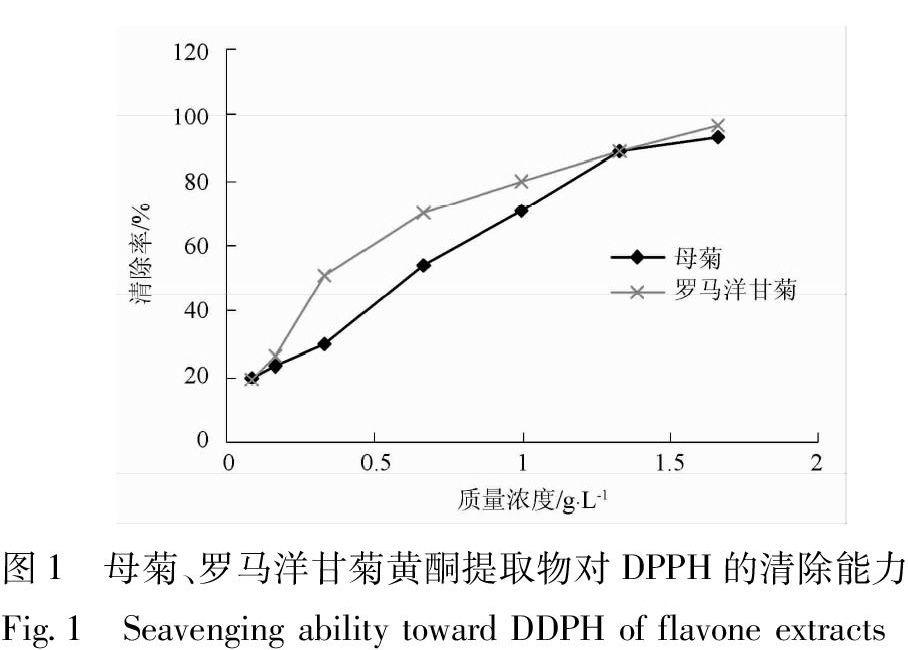
[摘要] 目的: 比较新疆2种洋甘菊——母菊和罗马洋甘菊抗氧化活性成分差异。方法: 采用薄层-生物自显影技术,以1,1-二苯基苦基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基为实验模型,经薄层扫描获得各抗氧化成分的峰面积,从而对2种洋甘菊的挥发油提取物、黄酮提取物进行抗氧化活性成分的分析,以总峰面积大小为指标比较不同提取物的抗氧化能力,并与2种洋甘菊黄酮提取物总的抗氧化活性进行比较。结果:母菊挥发油提取物显现烯炔双环醚等4个白色抗氧化斑点,罗马洋甘菊挥发油提取物显现1个白色抗氧化斑点,薄层扫描结果表明母菊挥发油提取物抗氧化斑点峰面积大于罗马洋甘菊挥发油提取物;2种洋甘菊黄酮提取物紫外-可见分光光度法抗氧化活性测定结果表明,母菊清除50%DPPH自由基的质量浓度为0.66 g·L-1,罗马洋甘菊清除50%DPPH自由基的质量浓度为0.33 g·L-1;2种洋甘菊黄酮提取物薄层生物自显影实验结果表明,母菊黄酮提取物显现芹菜素、芹苷元-7-葡萄糖苷等7个淡黄色抗氧化斑点,罗马洋甘菊黄酮提取物显现芹菜素、芹苷元-7-葡萄糖苷等8个淡黄色抗氧化斑点,薄层扫描结果表明罗马洋甘菊黄酮提取物抗氧化斑点峰面积大于母菊黄酮提取物。结论:2种洋甘菊挥发油提取物抗氧化活性TLC差异显著,母菊挥发油提取物抗氧化活性强于罗马洋甘菊挥发油提取物;母菊挥发油提取物中已知抗氧化活性成分为烯炔双环醚,其他3个抗氧化活性成分以及罗马洋甘菊挥发油提取物中1个抗氧化活性成分均为未知化合物,有待进一步确定;鉴于2种洋甘菊挥发油提取物抗氧化活性斑点数差异显著,可应用于2种洋甘菊的鉴别区分。2种洋甘菊黄酮提取物抗氧化活性测定结果、薄层生物自显影实验结果一致,母菊、罗马洋甘菊黄酮提取物都具有较强的抗氧化活性,且罗马洋甘菊黄酮提取物的抗氧化活性强于母菊黄酮提取物;2种洋甘菊黄酮提取物中均含已知抗氧化活性成分芹菜素、芹苷元-7-葡萄糖苷,母菊黄酮提取物中其他5个抗氧化活性成分以及罗马洋甘菊中其他6个抗氧化活性成分均为未知成分,有待进一步确定。该方法为进一步鉴定洋甘菊抗氧化活性成分奠定基础。
[关键词] 母菊;罗马洋甘菊;DPPH;薄层生物自显影;薄层扫描;抗氧化
新疆有2种常用洋甘菊,一种是德国洋甘菊,为一年生草本植物,即母菊,学名Matricaria chamomilla L.,植物名Matricaria recutita[1];一种是罗马洋甘菊,一至多年生草本,学名Anthemis nobile L.,植物名Chamaemelum nobile。母菊头状花序干燥后是一种重要的药用植物和香料植物,在食品和饮料行业,其精油和提取物用作调味剂成分,还可用于化妆品、肥皂、漱口液的制造。罗马洋甘菊在民间主要以茶饮用,工业上主要用于食品、化妆品等行业。市场上母菊价格昂贵,罗马洋甘菊相对便宜。2种洋甘菊外观极为相似,肉眼难以区分,常借助显微鉴别,化学成分分析等加以区分。2种洋甘菊都具有药用价值,母菊具有消炎、抑制真菌、解痉等作用[2-4];罗马洋甘菊具有抑制恶心、呕吐、消化不良、食欲不振等作用[5],但维吾尔药志记载母菊和罗马洋甘菊药物作用基本一致[2]。母菊主要含有α-红没药醇、芹菜素苷、木犀草素-7-葡萄糖苷、芹苷元-7-葡萄糖苷[6]等化学成分;罗马洋甘菊主要含有芹菜素、芹菜素苷、槲皮素、倍半萜内酯、蓝香油薁等化学成分[7]。在欧洲洋甘菊有很悠久的使用历史,1882年母菊就收入德国药典[8]。美国药典收载的品种为母菊,薄层鉴别以龙脑、乙酸龙脑酯和愈创奥为参照物对照鉴别其中的烯炔双环醚、没药醇和萜类化合物;含量测定采用HPLC测定芹苷元-7-葡萄糖苷含量;并以红没药醇为对照品,采用GC测定挥发油中没药烷衍生物的总含量。但欧盟药典收载的品种是罗马洋甘菊,薄层鉴别以芹菜素、芹苷元-7-葡萄糖苷为对照品进行鉴别。母菊在维吾尔医中是常用药材,国家药品标准维吾尔药分册(1998年版)就已收载该品种的药材,同时收入的3种制剂:复方木尼孜其颗粒、祖卡木颗粒、强力玛得士力阿亚特蜜膏均以母菊为药材入药。虽然国家药品标准维吾尔药分册收载了母菊,但只有显微鉴别,没有薄层鉴别和含量测定,现已列为国家药品标准提高品种。
现代医学研究发现人类的多种疾病都与自由基对机体的氧化损伤有关,自由基是机体生命活动中产生的一种活性分子,在正常代谢情况下,自由基起着调节细胞间的信号传递和细胞生长、抑制病毒和细菌的作用;机体内过多自由基会损伤生物细胞的膜结构,包括蛋白质、脂类、核酸、碳水化合物,从而引发炎症、肺气肿、肿瘤、动脉粥样硬化等多种疾病[9-11]。抗氧化活性是很多天然产物类化合物的药效机制之一,目前常用抗氧化活性测定方法包括1,1-二苯基苦基苯肼(DPPH·)法,羟基自由基(·OH)法,超氧自由基(O2-·)法。近年来,DPPH作为抗氧化模型与薄层色谱相结合,形成了薄层色谱-生物自显影技术,国内谷丽华等首次将薄层色谱-生物自显影技术应用于中药质量评价, 发展了基于平面色谱技术的生物检定法[12-13],开始应用于中药抗氧化活性成分的导向分离、鉴定和品质评价研究,并且《中国药典》(2010年版)[14]也引入了该活性检测方法。DPPH法薄层色谱-生物自显影技术中,DPPH与具有抗氧化活性的物质结合,生成DPPH-H 而呈现白色或淡黄色,薄层板本身显紫色,从而筛选出抗氧化活性组分[15]。该技术结合了比色法(或荧光法)与色谱分离技术二者的优点,具有操作简单、耗费低、灵敏度、专属性高等特点,是一种集鉴定、分离、活性测定于一体的药物筛选方法[11]。
国内外关于2种洋甘菊的抗氧化活性仅有少量报道, PovilAitytoee V等[16]采用紫外-可见分光光度法对罗马洋甘菊的挥发油提取物的抗氧化活性进行了研究,杨俊杰等[17]采用紫外-可见分光光度法研究了母菊挥发油提取物的抗氧化活性。为进一步比较系统地了解2种洋甘菊的抗氧化活性成分,本文采用DPPH法薄层生物自显影技术对2种洋甘菊的挥发油提取物、黄酮提取物同时进行抗氧化活性成分分析。本文中首先测定了2种洋甘菊黄酮提取物的抗氧化能力,之后采用DPPH法薄层色谱-生物自显影技术分析了2种洋甘菊挥发油提取物及黄酮提取物的抗氧化成分,为2种洋甘菊的鉴别区分及后续活性成分的分离分析奠定基础。
1 材料
半自动点样仪(CAMAG LINOMAT5),薄层色谱数码成像系统(CAMAG REPROSTAR3),薄层色谱扫描仪(CAMAG ScannerⅢ),薄层板加热仪(CAMAG TLC PLATEHEATERⅢ),旋转蒸发仪(EYELA ROTARY EVAPORA TOR N1001),分光光度仪(Cintra 404),氮吹仪(HSC-12A),100 μL微量进样针,双槽展开缸(20 cm×10 cm),硅胶G预制板(5 cm×10 cm,Merk),聚酰胺薄膜(浙江省台州市路桥四甲生化塑料厂);
愈创奥(SIGMA-ALDRICH),龙脑(中国食品药品检定研究院,批号8KT6-BLVP),乙酸龙脑酯(中国食品药品检定研究院,批号NZTU-EQ63),芹苷元-7-葡糖糖苷(成都普瑞科技有限公司),芹菜素(成都普瑞科技有限公司),十二烷基硫酸钠(SIGMA-ALDRICH),香草醛(成都市科龙化工试剂厂),1,1-二苯基苦基苯肼(SIGMA-ALDRICH),甲苯、正庚烷、甲醇、乙醇、甲酸(分析纯,天津市富宇精细化工有限公司),正丁醇(分析纯,天津市福晨化学试剂厂),二氯甲烷(分析纯,天津永晟精细化工有限公司),三氯甲烷、冰醋酸(分析纯,天津市化学试剂三厂),浓硫酸(分析纯,北京化工厂)。
母菊,采于新疆策勒;罗马洋甘菊,采于新疆。
2 方法与结果
2.1 2种洋甘菊黄酮提取物抗氧化活性测定
DPPH甲醇溶液呈深紫色,其最大吸收波长为517 nm。当有抗氧剂存在时,抗氧剂与DPPH单电子配对而使其逐渐褪色,可见光区517 nm处的吸收逐渐消失,其褪色程度与接受的电子数成定量关系,以清除率表示其抗氧化能力的强弱[18]:清除率S=1-(Ai-Aj)/A0,其中,A0为DPPH·与甲醇混合液的吸光度,Ai为DPPH·与样品反应后的吸光度(30 ℃水浴0.5 h),Aj为样品与甲醇混合液的吸光度;
2.1.1 DPPH溶液的制备 称取DPPH对照品约8 mg,置100 mL量瓶中,甲醇定容至刻度,配成0.08 g·L-1的溶液。在200~800 nm扫描,得到DPPH溶液的最大吸收波长517 nm。
2.1.2 母菊、罗马洋甘菊对DPPH的清除能力测定 称取母菊花粉末 (过3号筛)0.831 1 g,置于具塞锥形瓶中,加入甲醇30 mL,超声处理10 min(60 ℃水浴),放至室温,滤过,取甲醇10 mL冲洗具塞锥形瓶,清洗液滤过,合并滤液转移至50 mL量瓶中,甲醇定容至刻度,即得16.62 g·L-1母菊储备液。吸取母菊储备液0.05,0.1,0.2,0.4,0.6,0.8,1.0 mL至10 mL量瓶中,得母菊系列质量浓度为0.083 1,0.166 2,0.332 4,0.664 8,0.997 2,1.329 6,1.662 0 g·L-1;称取罗马洋甘菊花粉末(过3号筛) 0.829 2 g,同法处理得罗马洋甘菊储备液16.58 g·L-1及系列质量浓度0.082 9,0.165 8,0.331 6,0.663 2,0.994 8,1.326 4,1.658 0 g·L-1。
吸取DPPH溶液2 mL,加入甲醇2 mL,在517 nm处测定吸光度A0为0.921;吸取DPPH溶液2 mL,加入一系列浓度母菊溶液1 mL,再加入甲醇1 mL,30 ℃水浴0.5 h后,在517 nm处测定吸光度Ai;空白对照为甲醇3 mL分别加相对应母菊系列溶液1 mL,在517 nm处测定吸光度Aj;同法测定罗马洋甘菊系列液,按照清除率公式计算母菊、罗马洋甘菊对DPPH的清除率,结果见图1。结果显示,清除50%DPPH的母菊花质量浓度、罗马洋甘菊花质量浓度(EC50)分别为0.66,0.33 g·L-1,罗马洋甘菊黄酮提取物的抗氧化活性大于母菊黄酮提取物。
2.2 薄层生物自显影分析2种洋甘菊的抗氧化活性成分
2.2.1 挥发油提取物抗氧化活性成分的分析 对照品溶液的制备:取龙脑、乙酸龙脑酯、愈创奥对照品,加甲苯制成每1 mL分别含1,2,4 mg的混合溶液,作为对照品溶液。供试品溶液的制备:取2种洋甘菊花粗粉各1 g,分别置具塞锥形瓶中,加二氯甲烷10 mL,置室温浸泡1 h,滤过,滤液置旋转蒸发仪35 ℃下浓缩,然后氮吹仪吹干,残渣加甲苯0.5 mL使溶解,作为供试品溶液。
母菊、罗马洋甘菊供试品溶液,龙脑、乙酸龙脑酯、愈创奥混合对照品溶液分别点于同一硅胶G薄层板(5 cm×10 cm)上,以氯仿为展开剂,展开后取出,晾干,喷以1%香草醛浓硫酸溶液,在105 ℃加热5 min,置可见光下检视[19]。
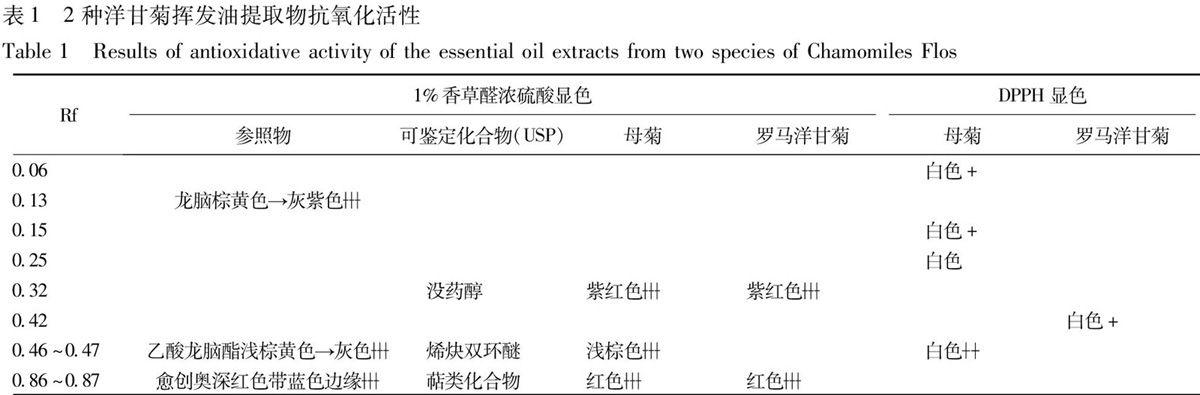
母菊、罗马洋甘菊供试品溶液分别点于另一硅胶G薄层板(5 cm×10 cm)上,同法展开晾干后喷0.008% DPPH甲醇溶液,30 min后,置可见光下检视,以及在检测波长410 nm,参比波长517 nm下进行双波长扫描测定[20]。2种洋甘菊花挥发油提取物抗氧化活性结果见表1。
1%香草醛浓硫酸显色可见光下检视,首先确定参照物龙脑、乙酸龙脑酯、愈创奥的相对位置,根据参照物Rf确定供试品中3种成分没药醇、烯炔双环醚、萜类化合物的位置。喷以0.008%DPPH甲醇溶液后置可见光下检视及薄层扫描,母菊挥发油提取物抗氧化活性成分的峰面积为3 038、罗马洋甘菊挥发油提取物抗氧化活性成分的峰面积为632,母菊挥发油提取物显现4个白色斑点,罗马洋甘菊挥发油提取物显现1个白色斑点,说明2种洋甘菊挥发油提取物都含有清除DPPH自由基的抗氧化活性成分,且母菊挥发油提取物抗氧化活性强于罗马洋甘菊挥发油提取物;根据Rf确定母菊挥发油提取物中含有烯炔双环醚等4个抗氧化活性成分,罗马洋甘菊挥发油提取物中含有1个未知的抗氧化活性成分,母菊中其他3个白色斑点属于具有抗氧化活性的未知化合物。1%香草醛浓硫酸显色条件下,2种洋甘菊薄层色谱差异性较小,DPPH显色后,2种洋甘菊薄层色谱斑点数目差异明显,可应用于2种洋甘菊的鉴别区分。
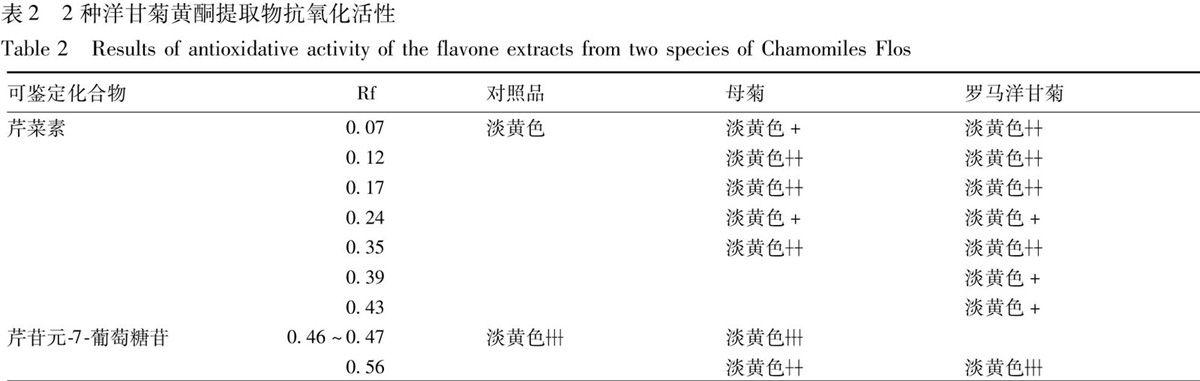
2.2.2 黄酮类成分抗氧化成分的分析 对照品溶液的制备:取芹菜素对照品、芹苷元-7-葡萄糖苷对照品,加甲醇制成每1 mL各含0.25 mg的混合溶液,作为对照品溶液。供试品溶液的制备:取2种洋甘菊花粗粉各0.5 g,分别置具塞锥形瓶中,加甲醇10 mL,超声处理5 min(60 ℃水浴),放至室温,滤过,取续滤液作为供试品溶液。表1 2种洋甘菊挥发油提取物抗氧化活性母菊、罗马洋甘菊供试品溶液,芹菜素、芹苷元-7-葡萄糖苷混合对照品溶液,分别点于同一聚酰胺板(5 cm×10 cm)上。称取十二烷基硫酸钠(表面活性剂)6.7 g,正丁醇(助表面活性剂)15.8 g,正庚烷(油相)2.5 g,水75 g,放置24 h制得75%O/W微乳液;以75%O/W微乳液-甲酸(9∶2)为展开剂,展开后取出,晾干,喷以0.008%DPPH甲醇溶液,置紫外光灯(254 nm)和可见光下检视以及对其峰面积进行双波长扫描测定(λ1=410 nm,λ2=517 nm)。2种洋甘菊花黄酮提取物抗氧化活性结果见表2。
以DPPH紫外光灯(254 nm)检视结果确定芹苷元-7-葡萄糖苷、芹菜素的位置;可见光下检视及薄层扫描,母菊黄酮提取物抗氧化活性成分的峰面积为11 554(其中芹菜素727,芹苷元-7-葡萄糖苷4 442),罗马洋甘菊黄酮提取物抗氧化活性成分的峰面积为16 277(其中芹菜素3 061,芹苷元-7-葡萄糖苷2 453),母菊黄酮提取物显现芹菜素、芹苷元-7-葡萄糖苷等7个淡黄色斑点,罗马洋甘菊黄酮提取物显现芹菜素、芹苷元-7-葡萄糖苷等8个淡黄色斑点,说明2种洋甘菊黄酮提取物都含有较强清除DPPH自由基作用的抗氧化活性成分,且罗马洋甘菊黄酮提取物的抗氧化活性强于母菊黄酮提取物;根据Rf确定2种洋甘菊黄酮提取物中都含有芹菜素、芹苷元-7-葡萄糖苷等抗氧化活性成分,母菊黄酮提取物中其他5个淡黄色斑点及罗马洋甘菊黄酮提取物中其他6个淡黄色斑点属于具有抗氧化活性的未知化合物。该薄层色谱条件下,2种洋甘菊黄酮提取物能较好分离。
3 讨论
1%香草醛浓硫酸显色结果确定参照物龙脑、乙酸龙脑酯、愈创奥的相对位置[19];DPPH显色后,根据参照物Rf确定供试品挥发油提取物中的抗氧化活性成分为烯炔双环醚等。DPPH薄层生物自显影分析2种洋甘菊黄酮提取物抗氧化活性成分除芹菜素、芹苷元-7-葡萄糖苷外,还含有其他结构的化学成分。
薄层生物自显影筛选结果显示,2种洋甘菊挥发油提取物都具有一定的抗氧化活性,母菊白色斑点数多于罗马洋甘菊,且母菊挥发油提取物抗氧化斑点峰面积大于罗马洋甘菊挥发油提取物,说明母菊挥发油提取物抗氧化活性强于罗马洋甘菊挥发油提取物;2种洋甘菊黄酮提取物都具有较强的抗氧化活性,薄层生物自显影筛选结果显示罗马洋甘菊黄酮提取物抗氧化斑点峰面积大于母菊黄酮提取物,并与总黄酮提取物抗氧化能力的测定结果一致。
本实验在分析2种洋甘菊挥发油提取物抗氧化活性过程中,考察了欧洲药典中冰醋酸-水-正丁醇(17∶17∶66)展开系统[21],但DPPH显色后供试品中斑点成白色条带状,拖尾严重,分离度差;然后采用微乳展开系统含水量75%O/W微乳液-甲酸(9∶2)优化后,斑点清晰,分离效果较好,但微乳条件下抗氧化斑点为淡黄色,可能与聚酰胺板作为薄层固定相有关。
[参考文献]
[1] 赵鑫.德国母菊[J].国外医药·植物药分册, 2008,23(2):92.
[2] 刘勇民.维吾尔药志.上册[M].乌鲁木齐: 新疆科技卫生出版社,1999:412.
[3] 小林义典.母菊提取物的止痒作用[J].国外医学·中医中药分册, 2003, 25(3):173.
[4] 郑金臣, 全山丛, 张虹, 等.值得重视的归化药用和香料植物-母菊(洋甘菊) [J].中草药, 1996, 27(9):568.
[5] Hallie E.Flora von Deutschland[M].Gera-Untermhaus, 1987, 29:256.
[6] 新疆卫生厅 .维吾尔药标准.上册[M].乌鲁木齐: 新疆科技卫生出版社,1993: 255.
[7] Fauconnier M L, Jaziri M, Homies J, et al.Anthemis nobilis L.(Roman Chamomile): in vitro culture, micropropagation, and the production of essential oils[J].Med Aromat Plants Abstr, 1996, 37:16.
[8] Rolf Franke, Heinz Schilcher.Chamomile industrial profiles[M]. Florida: the chemical rubber company press, 2005:18.
[9] Buschman J L.Green tea and cancer in humans: a review of the literature[J].Natr Cancer, 1998, 31:51.
[10] Yang C S.Tea and health[J].Nutrition, 1999, 15:946.
[11] 谷丽华, 吴弢, 张紫佳, 等.应用薄层色谱-生物自显影技术评价乌药等三种中药的抗氧化活性[J].药学学报, 2006, 41(10):957.
[12] Gu L H, Wu T, Wang Z T.TLC bioautography-guided isolation of antioxidants from fruit of Perilla frutescens var.acuta[J].Food Sci Technol, 2009, 42(1): 131.
[13] Zheng X Y, Zhang Z J, Chou G X, et al.Acetylcholinesterase inhibitive activity-guided isolation of two new alkaloids from seeds of Peganum nigellastrum Bunge by an in vitro TLC- bioautographic assay[J].Arch Phram Res, 2009, 32 (9): 1245.
[14] 中国药典.一部[S].2010: 115.
[15] Corrado M, Rodrigues K F.Antmiicrobial evaluation of fungal ex-tracts produced by entophytic strAins of Phomopsis sp.[J].J Basic Microbiol, 2004, 44: 157.
[16] PovilAitytoee V, Venskutonis P R.Antioxidative activity of purple peril (Perilla frutescens L.), moldavian dragonhead (Dracocephalum moldavica L.), and roman chamomile (Anthemis nobilis L.) extracts in rapeseed oil[J].J Am Oil Chem Soc, 2000, 9(77): 951.
[17] 杨俊杰.洋甘菊再生体系的建立及抗炎抑菌、抗氧化作用的研究[D].合肥:安徽农业大学, 2009.
[18] Larrauri J A, Sanchez M C, Saura C F.Efects of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J].J Agric Food Chem, 1998, 46:2694.
[19] United States Pharmacopoeia[S].USP34-NF29.
[20] 童珊珊, 余江南, 徐希明, 等.薄层色谱-生物自显影技术测定绵茵陈提取液中绿原酸的含量并评价其抗氧化活性[J].中国药学杂志, 2009, 44(22):1740.
[21] European Pharmacopoeia[S].EP7.0.
Comparison of antioxidant activity between two species of chamomiles
produced in Xinjiang by TLC-bioautography
HAN Song-lin1,2, Li Xin-xia1*, MIAN Qiang-hui1, LAN Wei1, LIU Yan3
(1. Xinjiang Medical University, Urumqi 830054, China; 2. Aksu Vocational and Technical College, Aksu 843000, China;
3. Bill Brother Biotechnology Co., Ltd., Urumqi 830011, China)
[Abstract] Objective: To compare the antioxidant active components from two species of chamomile-matricaria and Roman chamomile produced in Xinjiang. Method: The TLC-bioautography was used, with 1,1-Diphenyl-2-picrylhydrazyl (DPPH) radical as the experimental model. The peak areas of various antioxidant components were obtAined by TLC-scanning for analyzing antioxidant active components contAined in volatile oil extracts and flavone extracts from the two species of chamomiles. The total peak area was taken as the indicator for comparing the antioxidant capacities of the two types of extracts, and comparing them with the total antioxidant activity of flavone extracts of the two species of chamomiles. Result: According to the result of TLC-bioautography in volatile oil extracts from the two species of chamomiles, volatile oil extracts from chamomile showed four white antioxidant spots, including en-yne-dicycloether, and volatile oil extracts from Roman chamomile showed only one white antioxidant spot. The TLC-scanning result showed that the peak area of antioxidant spots of volatile oil extracts from chamomile was significantly larger than that of volatile oil extracts from Roman chamomile. According to the test on the antioxidant activity of the two species of chamomiles with ultraviolet-visible spectrophotometry, the concentration of chamomile after scavenging 50% of DPPH radicals was 0.66 g·L-1, whereas the figure for Roman chamomile was 0.33 g·L-1. According to the result of TLC-bioautography in flavone extracts from the two species of chamomiles, flavone extracts from chamomile showed seven yellowish antioxidant spots, including apigenin and apigenin-7-glucoside, and flavone extracts of Roman chamomile showed eight yellowish antioxidant spots, including apigenin and apigenin-7-glucoside. The TLC-scanning results showed that the peak area of antioxidant spots of flavone extracts from Roman chamomile was significantly larger than that of flavone extracts from chamomile. Conclusion: Volatile oil extracts from the two species of chamomiles have significant difference in the antioxidant activity in TLC-bioautography. Specifically, the antioxidant activity of volatile oil extracts from chamomile is stronger than volatile oil extracts from Roman chamomile; the known antioxidant active components in volatile oil extracts from chamomile is en-yne-dicycloether, while all of the other three antioxidant active components as well as antioxidant active components in volatile oil extracts from Roman chamomile are unknown components and remAin to be further determined. Considering the significant difference in the number of antioxidant active spots in volatile oil extracts from the two species of chamomiles, the result can be applied to distinguish the two species of chamomiles. The antioxidant activity determination result for flavone extracts from two species of chamomiles was consistent with the result of TLC-bioautography, showing that flavone extracts from chamomile and Roman chamomile are more antioxidant active, while that of Roman chamomile is stronger than chamomile. Flavone extracts from both of the two species of chamomiles contAin apigenin and pigenin-7-glucoside, which are known, while all of the other five antioxidant active components contAined in flavone extracts from chamomile and the other six antioxidant active components contAined in flavone extracts from Roman chamomile are unknown and remAin to be further identified. The method lays a foundation for further identification of antioxidant active components contAined in chamomile.
[Key words] chamomile; Roman chamomile; DPPH; TLC-bioautography; TLC-scanning; antioxidant activity
doi:10.4268/cjcmm20130210
[责任编辑 曹阳阳]
