长吻?养殖群体与野生群体遗传多样性分析
2013-04-19肖明松马玉涵
肖明松 崔 峰 康 健 马玉涵
(安徽科技学院生命科学学院, 凤阳 233100)
长吻?养殖群体与野生群体遗传多样性分析
肖明松 崔 峰 康 健 马玉涵
(安徽科技学院生命科学学院, 凤阳 233100)
长吻?(Leiocassis longirostris)是中国土著珍稀鱼类。近年来, 由于江河水利工程、环境污染及人类生产活动已经对江河的渔业资源造成了难以逆转的破坏, 长吻?的渔业资源已逐渐枯竭。目前, 长吻?在四川、广东等地实现适度规模养殖。以四川眉山、湖北石首和安徽淮南3个人工养殖长吻?群体及4个长江野生长吻?群体(重庆段、武汉段、安庆段和南京段)为实验材料, 利用线粒体DNA (mtDNA)控制区序列作为分子标记对135个个体的遗传结构进行了分析。结果表明, 在790 bp 的同源序列中, 长吻?3个养殖种群共检测到变异位点27个, 占全部序列的3.42%, 66个个体共检测到18种单倍型; 在野生群体中, 69个个体共检测到35个变异位点和36个单倍型, 长吻?野生群体平均单倍型多样性和平均核苷酸多样性(Hd = 0.9736±0.0070, Pi =0.0087±0.0015)高于长吻?养殖群体(Hd =0.8867±0.0013, Pi =0.0056±0.0013); 群体间的遗传分化水平较低(Fst值为0.0014—0.1125)。采用邻接法(NJ法)和统计简约原理对所有单倍型进行系统发育树和统计简约网状图的构建, 结果表明: 各群体内的个体均不能分别构成独立的分支, 而是相互交叉聚在一起。分析结果表明, 长吻?养殖群体与野生群体之间的基因交流充分, 未出现遗传分化, 但相对长吻?野生群体, 长吻?养殖种群多态性偏低。
长吻?; mtDNA; 控制区; 序列分析
长吻?(Chinese longsnout catfish Leiocassis longirostris Günther) 隶属鲶形目(Siluriformes)、鲿科(Bagridae)、?属(Leiocassis), 俗称:?鱼、江团、肥沱、肥王鱼、灰江团鱼等, 为我国鲶形目分布最广且产量较高的特产淡水名贵经济鱼类。其肉质细嫩、肉味鲜美且无细刺, 尤其是鱼鳔特别肥厚, 含大量的胶蛋白, 是高级滋补品, 与燕窝、鱼翅齐名, 被视为肴中珍品, 自古作为贡品之用, 也是一种贵重药材。长吻?分布于中国东部的辽河、淮河、长江、闽江至珠江等水系及朝鲜西部, 以长江水系为主。近年来, 由于江河水利工程、环境污染、人类生产活动对自然资源的无节制掠夺等对江河的渔业资源造成了难以逆转的破坏, 长吻?的渔业资源已逐渐枯竭。为促进长吻?繁殖和养殖迅速发展, 四川、广东等地已获得适度规模养殖[1—4]。目前, 有关长吻?生物学、生态学及养殖技术方面的研究有大量资料报道[5—8], 但与其相关的遗传方面的研究则较少,仅在染色体组型、同工酶、微卫星引物筛选等方面有报道[9—12]。长吻?作为一个优良的养殖种类, 有必要对其种质及遗传多样性进行深入了解。鱼类线粒体DNA(mtDNA)具有分子小、结构简单、母系遗传、进化速度快、几乎不发生重组、不同区域进化速度存在差异等特点, 是一个相对独立的复制单位。一个个体就代表一个母系集团, 便于进行群体分析。已被广泛地应用于类群识别、地理隔离、起源、分化和扩散、遗传多样性等领域[13—17]。本研究利用mtDNA技术在分子水平上对来自安徽、湖北、四川3省长吻?的养殖群体和长江野生群体进行遗传分析, 试图了解天然群体和人工繁殖群体的遗传结构以及遗传多样性, 以评价其种质状况, 为种质资源研究、人工养殖及品种培育提供相关的遗传背景资料和理论依据。
1 材料与方法
1.1 材料
实验鱼 长吻?3个养殖群体分别来自四川眉山市长吻?原种场的子一代(22个个体, 2010年11月取样)、湖北省石首市长吻?原种场的子一代(16个个体, 2010年12月取样)、安徽省淮南市特种水产养殖场(28个个体, 2010年11月取样), 均为1—2 龄的鱼种, 体长8.0—30.6 cm; 体重16.8—351.5 g, 长吻?长江野生群体分别来自重庆段(23个个体, 2008年8月取样)、武汉段(15个个体, 2008年8月取样)、安庆段(16个个体, 2008年10月取样)和南京段(15个个体, 2008年10月取样), 均为2—3 龄的鱼种,体长31.5—60.2 cm, 体重269.5—624.7 g(表1)。标本采用95%乙醇固定, −20℃保存在安徽科技学院。
主要试剂 蛋白酶K、琼脂糖、饱和酚购自上海生工生物工程技术有限公司, 引物DL1 (5′-AC CCCTGGCTCCCAAAGC-3′) 和DH2 (5′-ATCTTAG CATCTTCAGTG-3′)[18]由上海生工生物工程技术有限公司合成, Taq酶、dNTPs 购自大连TaKaRa公司;其他试剂均为国产分析纯。
主要仪器 PCR 仪、核酸分析仪和离心机为Eppendorf (德国), Alphalmager Is-2200凝胶图像分析系统(美国), 电泳仪等常规仪器均为国产。
1.2 方法
模板DNA的制备 每个样品随机取肌肉100—200 mg, 剪碎, 匀浆后置于1. 5 mL 的微量离心管中, 加入含蛋白酶K 的裂解液(10 mmol/ L Tris-HCl, pH 8. 0, 1 mmol/ L EDTA, pH 8. 0, 1%SDS) , 55℃消化过夜。次日分别用Tris-饱和酚、氯仿/异戊醇(24∶1) 提取、纯化DNA, 之后用−20℃冷冻的无水乙醇沉淀DNA, 自然干燥后, 溶于灭菌双蒸水中,所得用基因组DNA 样品用紫外分光光度计测量DNA 样品的浓度和纯度, 同时辅以琼脂糖凝胶电泳检测基因组DNA 的完整性并估测分子量, 置于−20℃冰箱保存备用。
PCR反应 PCR 反应总体积为30 μL, 其中含10×buffer反应缓冲液3.0 μL, 3 μL dNTP (2.5 mmol/L), 0.4 μmol/L 引物, 0.25 μL Taq 酶, 25 ng DNA, 用灭菌双蒸馏水补足体积。PCR反应条件为: 94℃下预变性5min, 94℃下变性30s, 58℃下退火1min, 72℃下延伸1min, 共35个循环, 最后72℃下延伸10min, 4℃保存。
琼脂糖凝胶电泳 PCR 扩增产物在1.2 %的琼脂糖凝胶(含0.5 g/mL EB) 上电泳, 120 V 稳压电泳1h。电泳结果在Alphalmager Is-2200'凝胶图像分析系统中拍照、保存。
DNA序列测定和分析 经2 %琼脂糖凝胶电泳检测后, 将PCR 产物送往上海生工生物工程技术有限公司进行序列测定, 测得的序列用Clustal X 1.81 程序[19]进行比对, 并辅以人工校对, 进行同源性比较。所有序列均递交GenBank (序列号为JN131500-JN131517和AB054127-AY297099)。利用MEGA 3. 0 软件包[20]分析序列特征、统计碱基组成和转换与颠换值、计算遗传差异和遗传距离。采用邻接法(Neighbor-joining tree, NJ)构建分子系统发育树, 系统树各分支的置信度由1000次自举法(Bootstrap)检验。利用DnaSP 4.0软件[21]计算各群体的单倍型多样度(H)、平均核苷酸差异数(K)、核苷酸多态性(Pi); Arlequin 3.1软件[22]进行群体间的欧氏距离平方(Squared euclidean distance) 矩阵分子变异分析(AMOVA), 统计长吻?养殖群体与野生群体间的遗传分化指数(Fst), 并根据Nm≈(1−Fst)/(2Fst)得到群体间的基因流值(Nm)。为进行谱系生物地理学(Phylogeography)分析, 利用TCS 1.21[23]软件, 依据统计简约原理[24], 构建单倍型的网状图。相对于传统的系统发育分析方法, 网状图更能够有效地揭示种群水平上的谱系关系(Genealogical relationship),更清楚地反映与种内基因进化有关的特性, 如是否保持祖先的单倍型、是否存在多重后代的单倍型以及种群间的序列差异较低的特性[25]。
2 结果
2.1 长吻?线粒体控制区序列变异、单倍型和单倍型分布


利用引物DL1和DH2从所有长吻?个体的总DNA 中均成功扩增出790 bp 的线粒体控制区序列片段。在长吻?养殖群体所有可比较的790 bp序列中, 66个个体共检测到27个变异位点(占全部碱基数的3.42%)。其中简约信息位点18个, 单突变位点8个, 缺失位点1个。含有4个转换位点(Ts), 1个颠换位点(Tv), 平均转颠换比(Ts/Tv)为8.27。在长吻?野生群体中, 69个个体共检测到35个变异位点(占全部碱基数的4.43%)。其中简约信息位点24个, 单突变位点10个, 缺失位点1个。含有5个转换位点(Ts), 1个颠换位点(Tv), 平均转颠换比(Ts/Tv)为9.80。在长吻?养殖群体和野生群体中, 135个个体共检测到42个变异位点, 其中简约信息位点28个,单突变位点12个, 缺失位点2个(表1)。长吻?养殖群体和野生群体的碱基变化不大(表2), 其中碱基G的含量显著低于其他碱基的含量, A+T含量(60.6%)明显高于C+G含量(39.4%)。
2.2 单倍型分布及单倍型聚类分析
利用DnaSP 4. 0 软件计算各群体的单倍型(表1)。由表1可知, 在长吻?不同群体中, 135个体共检测出46 个单倍型, 即H-1 - H-46。其中28个独享单倍型, 占20.74%, 18个共享单倍型, 单倍型H-8、H-11、H-12、H-14、H-18、H-24、H-37和H-43为野生群体和养殖群体共享。另外, 在长吻?养殖群体中, 66个体共检测出18 个单倍型, 在野生群体中69个体共检测出36 个单倍型(表略)。TCS 1.21软件生成的统计简约网状图显示出星状的分布态势,没有将46个单倍型区分为对应不同地理区域或者地理种群的单系群。单倍型H- 14位于星状图的中心,其他单倍型则与其依短支相连(图1)。依据溯祖理论 (Coalescence theory), 线粒体控制区单倍型的星状拓扑结构表明所研究的种群经历了明显的种群扩张[26], 单倍型H-14由于其分布最广和享有该单倍型的个体在所有的种群中所占的比重也明显的高于其他单倍型, 而且在网状图中处于基部位置, 说明单倍型H-14可能是原始的单倍型。
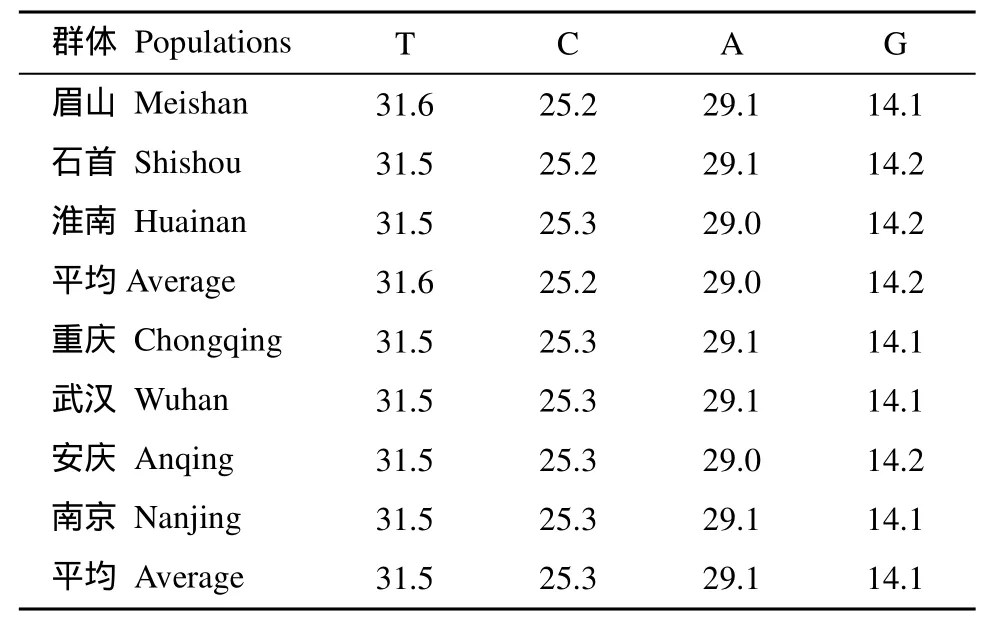
表2 长吻?序列碱基组成Tab. 2 Nucleotide compositions of mtDNA control region in Leiocassis longirostris

图 1 基于线粒体控制区单倍型的统计简约网状图Fig. 1 The statistical parsimony network inferred from mtDNA control region haplotypes
2.3 群体遗传多态性参数统计
利用DnaSP 4. 0 软件计算各群体的单倍型多样性(Hd)、平均核苷酸差异数(K)、核苷酸多态性(Pi)。由表3可知, 长吻?4个野生群体的单倍型多样性Hd值均较高, 而从衡量群体遗传水平的K值和Pi值来看, 重庆野生群体明显高于其他群体。长吻?3个养殖群体的平均单倍型多样性和平均核苷酸多样性相对较低 (Hd =0.8867±0.0013, Pi =0.0056± 0.0013)。
2.4 群体遗传分化
群体间的序列差异反映的是生物间亲缘关系的远近, 使用MAGA 3. 0 软件中Tamura-Nei 模型计算群体内及群体间的遗传距离(表4)。结果表明, 四川眉山和湖北石首人工养殖群体间的亲缘关系较远,而安徽淮南养殖群体与湖北石首和四川眉山人工养殖群体间的亲缘关系较近, 长吻?养殖群体与野生群体存在一定的遗传距离。分子变异分析(AMOVA)的结果表明, 长吻?群体内存在较高的遗传变异(96.42%), 而群体间的遗传变异较小(3.21%) (表5),分子遗传变异主要来自地理区内群体内个体间。7个群体两两比较的遗传分化指数(Fst)显示, 安庆群体和石首群体之间的遗传分化最大(Fst=0.1125), 而武汉群体和安庆群体之间的遗传分化最小(Fst= 0.0014), 其中长吻?养殖群体间的遗传分化高于野生群体间的遗传分化。 此外, 群体间的遗传距离分析与遗传分化指数的分析结果是一致(表4)。Arlequin 3.1 软件统计养殖群体与野生群体间的遗传分化指数和基因流分别为Fst=0.0358、Nm=13.47。
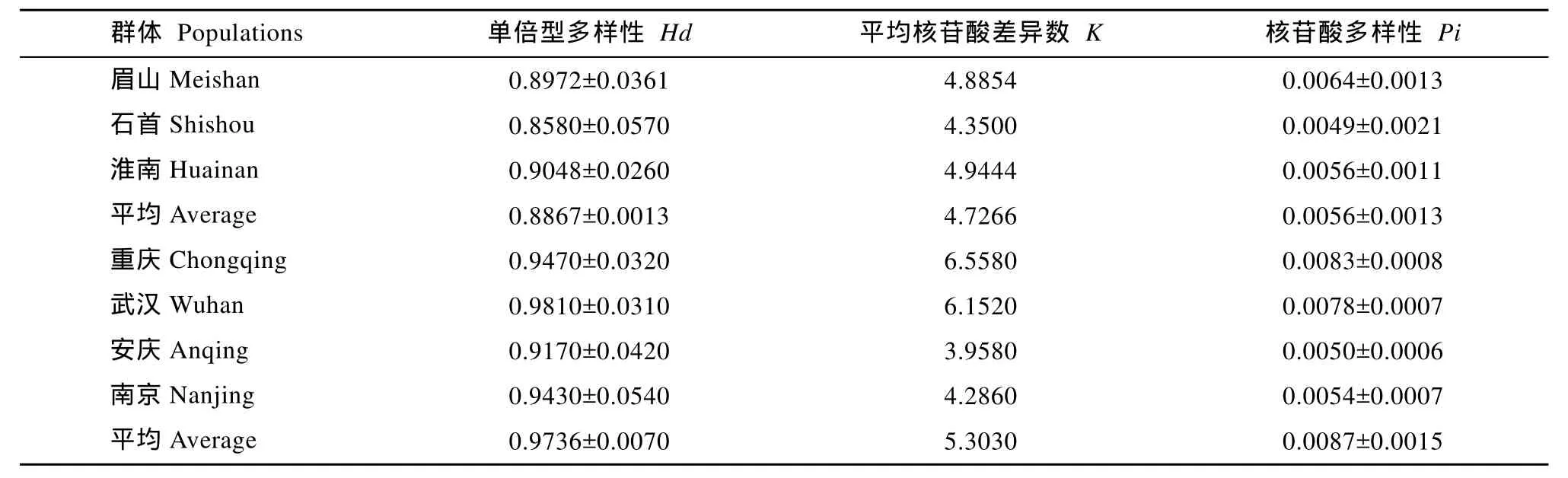
表3 长吻?7个群体遗传多样性统计参数Tab. 3 Demographic parameters estimated from seven Leiocassis longirostris populations
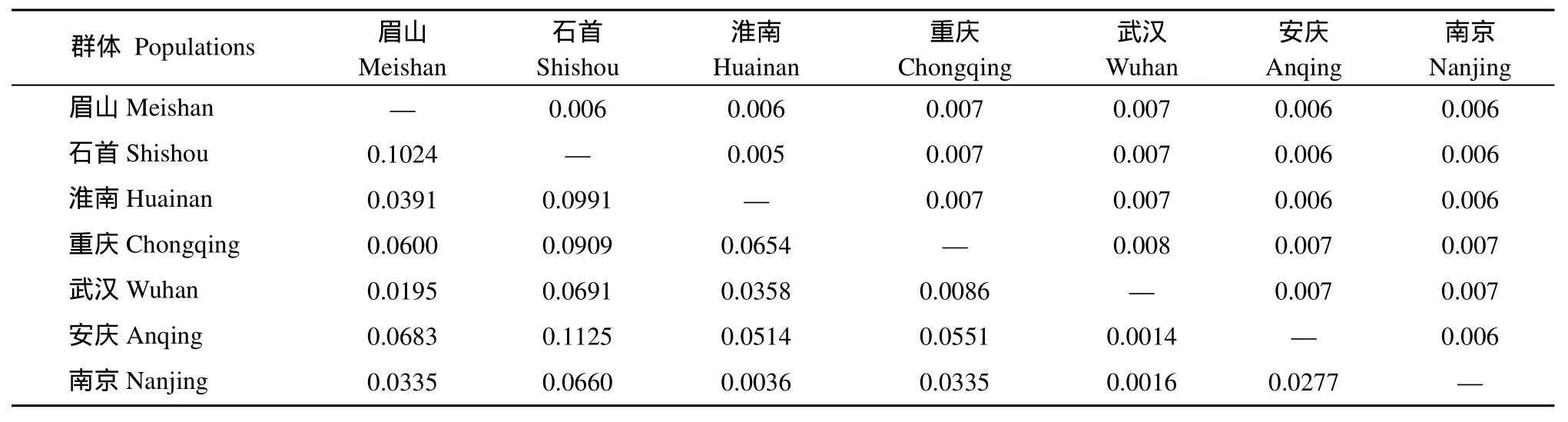
表4 长吻?群体间的遗传分化指数(左下角)和遗传距离(右上角)Tab. 4 Fixation Index (F) (below) and genetic distance (above) in three populations of Leiocassis longirostris

表5 长吻?群体分子变异分析结果Tab. 5 Analysis of molecular variance (AMOVA) for the Leiocassis longirostris populations
2.5 群体间的亲缘关系及聚类分析
利用MEGA 4. 0构建长吻?线粒体控制区核苷酸序列的NJ分子系统树(图2)。由图2和表3 可知,各野生群体和养殖群体内的个体均未单独成群, 而是互有交叉, 表明各野生群体和养殖群体的遗传相似性系数较高, 亲缘关系较近。

图2 长吻?各单倍型基于线粒体控制区序列构建的NJ树Fig. 2 NJ tree based on the control region of 7 populations of Leiocassis longirostris
3 讨论
3.1 长吻?群体的遗传多样性
遗传多样性的研究是生物多样性研究的重要内容, 只有通过遗传多样性的研究才能从本质上揭示物种多样性的起源、变异和进化。核苷酸多态性(Pi)作为一个衡量群体间遗传多态性的重要指标, 表示各种mtDNA 单倍型在群体中所占的比例。由实验结果可知, 在长吻?养殖群体中66个个体线粒体控制区790 bp的序列中, 总核苷酸突变位点为27个,共检测出18个单倍型。长吻?野生群体中69个个体共检测到35个变异位点, 36个单倍型。与长吻?野生群体相比, 养殖群体的单倍型多样性和核苷酸多样性水平均较低(Hd=0.8867±0.0013, Pi=0.0057± 0.0013)。另外, 从3个养殖群体内部的核苷酸位点突变情况来看, 安徽淮南群体内有22个核苷酸位点的变异, 湖北石首群体共产生12个变异位点, 四川眉山群体有17个变异位点, 分别只占总群体变异的81.48%、44.44%和62.96%。这表明遗传变异主要存在于群体内, 群体间的基因变异较小。安徽淮南群体的基因多样性水平最高, 石首和眉山河群体较低。Wang, et al.[27]对取自长江上游和下游的野生长吻?进行PCR–RFLP分析, 发现野生长吻?遗传多样性低, 种群数量下降, 这与已有野生种群的研究相一致[28,29]。而Yang, et al.[30]利用线粒体控制序列和核SSR标记研究长江上游、中游和下游野生长吻?遗传变异和种群结构, 表明长江野生长吻?单倍型多样性较高, 核苷酸多样性水平较低(Hd=0.9770± 0.0041, Pi=0.0081±0.0043)。上述研究结果表明, 长吻?长期的人工养殖已使得该群体的遗传多样性水平明显降低, 反映了长吻?作为我国鲶形目分布最广且产量较高的特产淡水名贵经济鱼类特殊的生命进化历程和适应复杂环境的能力。造成这一现象的主要原因可能是长吻?的基础群体数量较小、养殖过程的近交及遗传漂变等。而相对较高Hd值、低Pi值表明长吻?这个群体可能是由一个较小的有效群体迅速增长, 尽管变异导致单倍型的多态性的积累, 但核苷酸序列的多样化还未能积累[31]。高的Hd为通过分子选育等技术有效防止品种退化提供了前提条件, 并为保持遗传多样性水平, 维持杂交选育优势提供了重要基础。这也在一定程度上说明定期补充不同地区不同群体的个体作为亲鱼进行繁育有利于保持长吻?人工繁殖群体的遗传多样性, 避免近亲繁殖和瓶颈效应。
3.2 长吻?群体的遗传结构分析
长吻?养殖群体的线粒体D-loop序列分析表明,平均(A+T)含量达60.6%, 明显高于(C+G)含量, 该结果与其他鲶形目鱼类线粒体控制区(A+T)含量特别高的研究结果相符[18]。群体间的遗传距离以及种群分化指数是衡量群体多态程度的重要指标, 二者的值越大, 群体多态性程度越高[32]。根井正利利用遗传相似指数IN和遗传距离D 值对物种的不同分类单位间的遗传变异水平作过定量估计,并指出种群间遗传距离D 值的范围是0—0.05; 亚种间是0.02—0.2[33]。本实验结果表明, 3个养殖群体间的平均遗传距离为0.005—0.006, 淮南群体与石首群体间的平均遗传距离最小(0.005), 其他群体间的遗传距离为0.006。4个野生群体间的平均遗传距离为0.006—0.008, 重庆群体与武汉群体间的平均遗传距离最大(0.008), 这反映长吻?养殖群体与野生群体之间的遗传变异程度较小, 群体间的分化程度不大。长吻?7个群体两两比较的遗传分化指数(Fst)显示, 安庆群体和石首群体之间的遗传分化最大(Fst=0.1125), 而武汉群体和安庆群体之间的遗传分化最小(Fst=0.0014), 其中长吻?养殖群体间的遗传分化高于野生群体间的遗传分化, 长吻?养殖群体与野生群体间的遗传分化指数为Fst=0.0358。根据Wright[34]关于遗传分化指数的大小和分化程度的解释, Fst值在0—0.05表示低度遗传分化, Fst值在0.05—0.15表示中度遗传分化, 由此说明长吻?养殖群体与野生群体间的亲缘关系较近, 长吻?养殖群体的遗传分化程度较低。Wright[35]认为群体间基因流大于1, 则能发挥均质化作用, 即能有效抑制由遗传漂变而引起的遗传分化反之, 如果群体间基因流小于1, 则不能有效抑制由遗传漂变而引起的遗传分化, 表明基因流成了遗传分化的主要原因。本研究表明, 长吻?养殖群体与野生群体之间的Nm值达到13.47, 远远大于1, 可见其养殖群体与野生群体之间的基因交流比较充分, 从而抑制了由遗传漂变导致的群体间遗传分化。目前养殖的长吻?来源于野生的种群, 经过20多年的人工养殖和培育,已成为国内重要的淡水养殖鱼类。在人工繁育过程中, 由于亲本数量的限制和遗传漂变, 导致一些多态和稀有位点的丢失, 隐性纯合位点数增加, 使人工繁殖群体遗传多样性降低[36]。造成这种原因一方面可能是人工养殖长吻?时, 为得到其高质量和高产量, 人们经常筛选某一特定基因型的个体, 从而使某些基因从该基因库中流失。此外, 近亲交配也使得人工繁殖的长吻?遗传多样性下降。鱼类遗传多样性是改良鱼类品种和提高鱼类品质的物质基础, 遗传多样性的降低或被破坏会给渔业生产带来损失[37]。因此长期的人工养殖已经对长吻?的遗传结构产生了较大影响, 有必要从野生种群引种, 进一步丰富长吻?人工养殖群体的种质资源和遗传多样性。
[1] He X F, Su L D, Zhou G R, et al. Study on domestication and reproduction test of Leiocassis longirostris [J]. Freshwater Fisheries, 1985, (1): 14—17 [何学福, 苏良栋, 周贵荣, 等.长吻?的蓄养繁殖试验研究. 淡水渔业, 1985, (1): 14—17]
[2] Fang J Q. Collection and domestication of Leiocassis longirostris from the Yangtze River [J]. Scientific Fish Farming, 1999, (7): 19 [方建清. 长江长吻?的收集与蓄养. 科学养鱼, 1999, (7): 19]
[3] Liu J K, He B W. The Chinese Freshwater Fisheries Science (third edition) [M]. Beijing: Science and Technology Press. 1992, 304 [刘建康, 何碧梧. 中国淡水鱼类养殖学(第三版). 北京: 科学技术出版社. 1992, 304]
[4] Gong J H. Test on cage culture wild Leiocassis longirostris in reservoir [J]. Reservoir Fisheries, 2006, 26(1): 54 [龚建辉.水库网箱养殖野生长吻?试验. 水利渔业, 2006, 26(1): 54]
[5] Wu Q J. Population ecology of Leiocassis longirostris (Gunther) (Pisces, Bagridae) with reference to the problem of maximum sustained yield [J]. Acta Hydrobiologica Sinica, 1975, 5(3): 387—408 [吴清江. 长吻?种群生态学及其最大持续渔获量的研究. 水生生物学集刊, 1975, 5(3): 387—408]
[6] Xiao M S, Wan Q. The biology and culture prospect of Leiocassis longirostris in the Yangtze River [J]. Journal of Anhui Technical Teachers College, 2001, 15(3): 49—51 [肖明松, 万全. 长江长吻?的生物学习性及其发展前景. 安徽技术师范学院学报, 2001, 15(3): 49—51]
[7] Zhang Y Y. Researches and development of Leiocassis longirostris Gunther [J]. Southwest China Journal of Agricultural Sciences, 1998, S1(11): 134—139 [张义云. 长吻? (Leiocassis longirostris Gunther) 的研究与开发. 西南农业学报, 1998, S1(11): 134—139]
[8] Mo Y X, Wang X Q, Mo Y L. Morphological and histological observations of digestive system in Leiocassis longirostris [J]. Journal of Hunan Agricultural University (Natu-ral Sciences), 2004, 30(3): 267—271 [莫艳秀, 王晓清, 莫永亮. 长吻?消化系统的形态学与组织学观察. 湖南农业大学学报(自然科学版), 2004, 30(3): 267—271]
[9] Luo M, Jiang L K, Liu Y, et al. Comparative study on isoenzymes in Leiocassis longirostris [J]. Chinese Journal of Applied & Environmental Biology, 2000, 6(5): 447—451 [罗曼, 蒋立科, 刘颖, 等. 野生与养殖长吻?血液及不同器官同工酶的比较. 应用与环境生物学报, 2000, 6(5): 447—451]
[10] Wan Q, Liu E S, Shen D L, et al. Analysis on karyotype of Leiocassis longirostris Gunther [J]. Journal of Anhui Agricultural University, 2002, 29(2): 182—184 [万全, 刘恩生,申德林, 等. 长吻?染色体组型分析. 安徽农业大学学报, 2002, 29(2): 182—184]
[11] Xiao M S, Yang G. Isolation and characterization of 17 microsatellite loci for the Chinese longsnout catfish Leiocassis longirostris [J]. Molecular Ecology Resources, 2009, 9(3): 1039—1041
[12] Yu Y Y, Xiao M S, Chen L, et al. Isolation and characterization of microsatellite loci in the longsnout catfish (Leiocassis longirostris) [J]. Aquaculture Research, 2009, 40(2): 246—248
[13] Bermingham E, Avise J C. Molecular zoogeography of freshwater fishes in the southeastern United States [J]. Genetics, 1986, 113(4): 939—965
[14] Grunwald C, Stabile J, Waldman J R, et al. Population genetics of shortnose sturgeon Acipenser brevirostrum based on mitochondrial DNA control region sequences [J]. Molecular Ecology, 2002, 11(10): 1885—1898
[15] Mabuchi K, Senou H, Suzuki T, et al. Discovery of an ancient lineage of Cyprinus carpio from Lake Biwa, central Japan, based on mtDNA sequence data, with reference to possible multiple origins of koi [J]. Journal of Fish Biology, 2005, 66(6): 1516—1528
[16] Kyle C J, Wilson C C. Mitochondrial DNA identification of game and harvested freshwater fish species [J]. Forensic Science International, 2007, 166(1): 68—76
[17] Teletchea F. Molecular identification methods of fish species: reassessment and possible applications [J]. Reviews in Fish Biology and Fisheries, 2009, 19: 265—293
[18] Zhang Y, Zhang E, He S P. Studies on the structure of the control region of the bagridae in China and its phylogentic significance [J]. Acta Hydrobiologica Sinica, 2003, 27(5): 463—467 [张燕, 张鹗, 何舜平. 中国鲿科鱼类线粒体DNA控制区结构及其系统发育分析. 水生生物学报, 2003, 27(5): 463—467]
[19] Thompson J D, Gibson T J, Plewniak F, et al. The Clustal X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools [J]. Nucleic Acids Research, 1997, 24: 4876—4882
[20] Kumar S, Tamura K, Nei M. Mega 3.0: Integrated software for molecular evolutionary genetics analysis and sequence alignment [J]. Briefings in Bioinformatics, 2004, 5: 150—163
[21] Rozas J, Sánchez-del Barrio J C, Messeguer X, et al. DNA polymorphism analyses by the coalescent and other methods [J]. Bioinformatics, 2003, 19: 2496—2497
[22] Excoffier L, Laval G, Schneider S. Arlequin ver 3.0. An integrated software package for population genetics data analysis [J]. Evolutionary Bioinformatics Online, 2005, 1: 47—50
[23] Clement M, Posada D, Crandall K A. TCS: a computer program to estimate gene genealogies [J]. Molecular Ecology, 2009, 9: 1657—1660
[24] Templeton A K. Crandall K A, Sing C F. A cladistic analysis of phenotypic associations with haplotypes inferred from restriction endonuclease mapping and DNA sequence data. III. Cladogram estimation [J]. Genetics, 1992, 132: 619—633
[25] Posada D, Crandall K A. Evaluation of methods for detecting recombination from DNA sequences: Computer simulations [J]. Proceedings of the National Academyof Sciences of the United States of America, 2001, 98: 13757—13762
[26] Slatkin M, Hudsun R R. Pairwise comparisons of mitochondrial DNA sequences in stable and exponentially growing populations [J]. Genetics, 1991, 129: 555—562
[27] Wang Z W, Zhou J F, Ye Y, et al. Genetic structure and lowgenetic diversity suggesting the necessity for conservation of the Chinese longsnout catfish Leiocassis longirostris Günther (Pisces: Bagriidae) [J]. Environmental Biology of Fishes, 2006, 75: 455—463
[28] Mo Y X, Wang X Q, Mo Y L. RAPD analysis of genetic diversity of Leiocassis longirostris [J]. Journal of Jiangxi Fisheries Science, 2010, 122(2): 13—16 [莫艳秀, 王晓清,莫永亮. 长吻?遗传多样性的RAPD分析. 江西水产科技, 2010, 122(2): 13—16]
[29] Wang H Y, Huang W Q. Preliminary analysis on the genetic diversity in four populations of Leiocassis longirostris by using microsatellite markers [J]. Journal of Henan Agricultural Sciences, 2011, 40(2): 146—148 [王红莹, 黄文清.应用微卫星标记分析长江流域长吻?4 个群体的遗传多样性. 河南农业科学, 2011, 40(2): 146—148]
[30] Yang G, Xiao M S, Yu Y Y, et al. Genetic variation at mtDNA and microsatellite loci in Chinese longsnout catfish (Leiocassis longirostris) [J]. Molecular Biology Reports, 2012, 39(4): 4605—4617
[31] Avise J C. Phylogeography the History and Formation of Species [M]. Cambridge, Massachusetts London, England: Harvard University Press. 2000, 213—285
[32] Meng W, Guo Y, Hai S, et al. Genetic structure and diversity of Schizothorax biddulphi populations [J]. Acta Hydrobiologica Sinica, 2012, 36(5): 851—857 [孟玮, 郭焱, 海萨,等. 塔里木裂腹鱼群体遗传结构及遗传多样性分析. 水生生物学报, 2012, 36(5): 851—857]
[33] Masatoshi N. Molecular Population Genetics and Evolution [M]. Beijing: Agriculture Press. 1975, 121—133 [根井正利. 分子群体遗传学与进化论. 北京: 农业出版社. 1975, 121—133]
[34] Wright S. The gentical structure of population [J]. Annals of Eugenics, 1951, 15: 323—334
[35] Wright S. Evolution in Mendelian populations [J]. Genetics, 1931, 16: 97—159
[36] Han X L, Xu J R, Li X R, et al. Analysis of genetic diversity of Elopichthys bambusa by AFLP Markers [J]. Journal of Nan jing Normal University (Natural Science Edition), 2009, 32(1): 110—114 [韩晓磊, 徐建荣, 李小蕊, 等. 鳡鱼群体遗传多样性的AFLP 分析. 南京师大学报(自然科学版), 2009, 32(1): 110—114]
[37] Yang X, Yang J F, Tang M L, et al. Intraspecific genetic polymorphisms of Siniperca Scherzeri Steindacher and molecular identification with Siniperca chuatis [J]. Acta Hydrobiologica Sinica, 2007, 31(6): 891—895 [杨星, 杨军峰, 汤明亮, 等. 斑鳜种内遗传多态性以及与翘嘴鳜的分子鉴别.水生生物学报, 2007, 31(6): 891—895]
ANALYSIS ON SEQUENCE POLYMORPHISM OF THE MITOCHONDRIAL DNA CONTROL REGION AND POPULATION GENETIC DIVERSITY OF THE CULTIVATED AND NATURAL CHINESE LONGSNOUT CATFISH (LEIOCASSIS LONGIROSTRIS)
XIAO Ming-Song, CUI Feng, KANG Jian and MA Yu-Han
(College of Life Science Anhui Science and Technology University, Fengyang 233100, China)
The Chinese longsnout catfish is a semi-migratory fish which is commercially valuable in China. Due to overfishing, environmental pollution, and other human disturbances, the populations of this species have declined rapidly and disappeared in many river systems in the past decades. Currently, the Chinese longsnout catfish mainly inhabits the main streams of the Yangtze River and rarely found in lakes. At present, the Chinese longsnout catfish achieved appropriate scale farming in Sichuan, Guangdong and other places. However, seldom study was reported about analysis of population genetic structure using molecular markers. To protect and exploit this rare species effectively, investigations on population structures, resources and artificial reproduction have been conducted. In this study, the mitochondrial DNA control region were used to analyze genetic diversity and structure of 7 cultivated and natural populations of Chinese longsnout catfish collected from Meishan, Shishou, Huainan, Chongqing, Wuhan, Anqing and Nanjing named Meishan population, Shishou population, Huainan population, Chongqing population, Wuhan population, Anqing population and Nanjing population separately. The results showed the length of this region (D-loop) contained 790 bp nucleotides and the T, C, A and G contents were 31.5%, 25.3%, 29.1% and 14.1% respectively. Twenty-seven nucleotide sites and 18 haplotypes were found in 3 cultivated populations of Chinese longsnout catfish. Thirty-five nucleotide sites and 36 haplotypes were found in 4 natural populations of Chinese longsnout catfish. The average haplotype diversity and nucleotide diversity of cultivated populations of Chinese longsnout catfish were relatively low (Hd =0.8867±0.0013, Pi =0.0056±0.0013). The level of genetic differentiation was relatively low (0.0014—0.1125). Molecular phylogenetic tree and statistical parsimony network constructed by NJ method and statistical parsimony principles showed individuals from the same stock did not cluster together, and individuals from three different stocks nested with each other. These results suggested gene flow was sufficient between breeding populations and wild populations. They had no obviously genetic differentiation between breeding populations and wild populations. The genetic diversity of the cultivated populations of Chinese longsnout catfish was low.
Leiocassis longirostris; mtDNA; Control region; Sequencing
Q346
A
1000-3207(2013)01-0090-10
10.7541/2013.90
2012-02-09;
2012-09-05
安徽省教育厅重点科研项目(KJ2011Z069); 安徽科技学院稳定人才项目(ZRC2011257); 安徽科技学院预研项目(ZRC 2012312)资助
肖明松(1973—), 男, 安徽定远人; 副教授, 博士; 主要从事渔业生态和分子进化研究。E-mail: xiaomingsong2004@126. com
