吉西他滨联合槲皮素对胰腺癌细胞Panc-1凋亡的影响研究
2013-04-18周小红徐飞龙陈建
周小红 徐飞龙 陈建
吉西他滨联合槲皮素对胰腺癌细胞Panc-1凋亡的影响研究
周小红 徐飞龙 陈建
目的 研究吉西他滨联合槲皮素抑制胰腺癌细胞Panc-1增殖,促进其凋亡的效果。 方法 设立槲皮素(终浓度为50μM)、吉西他滨(50μg/ml)、吉西他滨联合槲皮素和对照组4组,MTS法检测药物对Panc-1细胞凋亡的影响,流式细胞仪检测联合药物处理对细胞凋亡和细胞周期的影响,最后应用荧光定量PCR法测定凋亡相关基因BCL-2家族蛋白的相对表达。 结果 吉西他滨联合槲皮素后,对胰腺癌促凋亡效果增强,同时改变细胞周期,使其S期减少,BCL-2家族促凋亡基因表达上调。 结论 槲皮素能够显著增强吉西他滨抑制胰腺癌恶性增殖的作用。
槲皮素 吉西他滨 胰腺癌细胞 增殖 凋亡
胰腺癌是高病死率肿瘤,新诊断患者的平均生存时间为9~12个月,即使通过外科手术切除,患者平均生存时间最长只有18个月[1-2]。胰腺癌高病死率的原因可能是患者发病后,肿瘤细胞倾向于局部组织浸润及散布到全身,基本上患者在诊断同时或不久之后即发生全身性转移[3]。至今仍缺乏效果明显的药物,也是胰腺癌高致死率的重要原因之一。
吉西他滨(美国礼来公司)被认为是一线抗胰腺癌的化疗药物,但是其效果仍然不是十分理想。据相关报道,患者使用后其平均生存时间大约可以延长6个月左右,这与理想治愈效果相距甚远[4-5],急需新的药物或新的治疗方案来改善目前窘境。槲皮素(Quercetin)化学名称为3,3′,4′,5,7-五羟黄酮,是最常见的黄酮类物质之一,作为植物的二级代谢物,具显著抗氧化和抗肿瘤的作用。本研究即基于此,探讨在体外槲皮素联合吉西他滨是否能够增强治疗胰腺癌的作用。
1 材料和方法
1.1 材料和试剂 胰腺癌细胞Panc-1购自中国科学院典型培养物保藏委员会细胞库(上海),槲皮素购自美国Sigma公司,吉西他滨购自美国礼来公司,细胞培养基RPMI 1640及青-链霉素购自杭州吉诺生物医药科技有限公司,胎牛血清购自美国Hyclone公司,细胞培养耗材购自美国Corning公司,细胞凋亡检测试剂盒(Annextin-V/PI)和细胞周期检测试剂盒(PI)购自南京凯基生物科技发展有限公司,RNA抽提用Trizol购自美国Invitrogen(上海)公司,逆转录试剂盒及SYBR green荧光定量试剂盒购自日本TAKARA(大连)公司,MTS试剂购自美国Promega公司等。
流式细胞仪(美国BD公司),酶标仪(美国Bio-Rad公司),二氧化碳培养箱(美国Thermo公司),倒置显微镜(日本Olympus公司)等。
1.2 细胞培养和传代 胰腺癌细胞Panc-1在含有10%胎牛血清和1%双抗(青-链霉素)的RPMI 1640培养基的细胞培养瓶中,37℃,5%CO2培养箱培养。当细胞汇合度约为80%~90%时,弃细胞培养液,PBS洗一遍后加入1ml胰酶消化室温消化2~5min,加入完全培养基,吹打完全成单细胞悬液,并转至其他细胞培养瓶培养。1.3 方法
1.3.1 吉西他滨联合槲皮素抑制Panc-1细胞增殖 将对数生长期的胰腺癌细胞Panc-1胰酶消化后制成单细胞悬液,以5×103/孔的细胞数量接种入96孔板,孵育6~10h之后,分别加入槲皮素(终浓度为50μM)[6]、吉西他滨(50μg/ml)[7]、槲皮素+吉西他滨(终浓度分别为50μM和50μg/ml),设置空白对照且各做6个复孔。于37℃,5%CO2培养箱中继续培养24、48、72、96h后,每孔加入20μl的MTS溶液,培养箱37℃,5%CO2孵育2h之后,在酶标仪A490nm下,测得吸光值。相同实验,平行重复3次。
1.3.2 利用流式细胞仪检测吉西他滨联合槲皮素导致的细胞凋亡 将对数生长期的Panc-1细胞胰酶消化,以5×105个细胞/孔铺于6孔板中,培养24h后分3组:槲皮素组、吉西他滨组和槲皮素+吉西他滨联合组,分别加入相应药物,并设空白对照组。待到细胞刺激48~72h后,将细胞培养液吸出,用PBS清洗细胞,然后加入适量不含有EDTA的0.25%胰酶,室温下消化细胞2~5min,加入适量体积的完全培养基中和胰酶作用,轻柔反复吹打,直至细胞分散完全,将细胞转入离心管内,以1 500r/min速度离心5min,弃上清液,收集细胞。然后,加入PBS重悬细胞,再次离心后弃上清液,用Annexin-V/PI细胞凋亡试剂中binding buffer适当体积重悬细胞(保持细胞浓度为1×106/ml左右),加入10μl的Annexin-V溶液冰上静止20min,最后加入10μl的PI溶液,300目滤网过滤,上流式细胞仪检测细胞凋亡。实验结果重复3次。
1.3.3 细胞周期的影响 方法同上,将6孔板中的4组细胞:槲皮素组、吉西他滨组、槲皮素+吉西他滨联合组和对照组分别加入相应药物并处理72h后,收集细胞,离心,PBS重悬并离心,弃上清液,最后重悬于-20℃预冷的75%冰乙醇中固定30min以上。2 000r/min离心5min,加入PBS重悬,再次离心,弃上清液,然后加入含有RNA酶的PBS重悬细胞,37℃水浴20min,然后按照细胞周期检测试剂盒的要求加入PI试剂染色,后滤网过滤,上流式细胞仪检测细胞周期。实验重复3次。
1.3.4 凋亡相关基因的表达检测
1.3.4.1 RNA抽取 方法同样,将铺于6孔板中的4组细胞:槲皮素组、吉西他滨组、槲皮素+吉西他滨联合组和对照组,药物处理72h后,弃掉培养基,加入PBS洗3次,吸干,每孔加入1 000μlTrizol,反复吹打,将细胞溶解充分并移入1.5ml离心管中静止3~5min,加入200μl氯仿,振荡器剧烈震荡后12 000r/min,4℃离心10min,将上清液移入新的离心管中,并加入等体积的异丙醇,混合均匀,室温静止30min沉淀RNA,12 000r/min,4℃离心15min,倒掉上清液,用DEPC水配置的75%乙醇洗1次,风干并溶于DEPC水中,定量。
1.3.4.2 逆转录 应用逆转录试剂盒,按照生产商的说明书操作,具体步骤如下:在冰浴的PCR中加入如下反应混合物[小于1μg的模板RNA、1μl的Oligo(dT)、H2O(RNAase free)至12μl],反应混合物在70℃水浴5min后,冰浴30s,短暂离心数秒。将试管冰浴,再加入如下组分:5×Reaction Buffer(4μl)、RNase Inhibitor(1μl)和dNTP Mix(2μl),逆转录酶(1μl),混匀并离心,反应混合物42℃水浴60min。在70℃加热10min结束反应,置冰上进行后续实验或冷冻保存。
1.3.4.3 实时荧光定量PCR 实时荧光定量PCR的步骤是:第一步,95℃10min;第二步,95℃15s,60℃1min,重复40循环;第三步,溶解曲线从60℃~95℃每0.5℃采集信号一次。定量PCR的引物分别为:BAX-F:3′-GATGCGTCCACCAAGAAGCT-5′,BAX-R:3′-CGGCCCCAGTTGAAGTTG-5′;BCL2L1-F:3′-ACCCCAGGGACAGCATATCA-5′,BCL2L1-R:3′-TGCGATCCGACTCACCAATA-5′;BCL2-F:3′-TCCGCATCAGGAAGGCTAGA-5′,BCL2-R:3′-AGGACCAGGCCTCCAAGCT-5′;BIK-F:3′-CTTGATGGAGACCCTCCTGTATG-5′,BIK-R:3′-AGGGTCCAGGTCCTCTTCAGA-5′;PUMAF:3′-GACCTCAACGCACAGTACGAG-5′,PUMA-R:3′-AGGAGTCCCATGATGAGATTGT-5′。
1.4 统计学处理 采用SPSS 19.0软件处理,组间计量资料比较,采用独立样本t检验。
2 结果
2.1 槲皮素能够增强吉西他滨对胰腺癌细胞的增殖抑制作用 胰腺癌细胞Panc-1接种入96孔板,4组实验分别为槲皮素(终浓度为50μM)组,吉西他滨(50μg/ml)组和槲皮素+吉西他滨联合组,同时还有空白对照组。加药后继续培养,分别在24、48、72和96h时间点检测细胞的存活情况。结果发现,癌细胞在空白对照组持续增殖,至72~96 h,增值速度减缓,而另外3个处理组,癌细胞增殖抑制、凋亡明显。槲皮素和吉西他滨能够诱导胰腺癌细胞凋亡,而槲皮素能够增强吉西他滨的抗胰腺癌的能力,与单独吉西他滨组和槲皮素组比较差异均有统计学意义(均P<0.01),同时联合效果大于两者单独处理细胞的效果之和(见图1)。实验结果说明槲皮素能够增强吉西他滨杀伤胰腺癌细胞的作用,且与吉西他滨单独使用差异极其显著。
2.2 吉西他滨联合槲皮素比单独使用更能促进胰腺癌细胞凋亡 胰腺癌细胞在槲皮素(终浓度为50μM)组,吉西他滨(50μg/ml)组和槲皮素+吉西他滨联合处理后72h,收集细胞,上流式细胞仪检测细胞凋亡情况。如图2所示,空白对照组(图2A)和槲皮素组(图2B)凋亡率分别为18.49%和21.28%,差别不显著。而吉西他滨和吉西他滨联合槲皮素的处理,与对照组比较,能够显著诱导胰腺癌细胞凋亡,凋亡率分别为38.4%和52.2%。吉西他滨联合槲皮素后诱导胰腺癌细胞凋亡的效果明显高于吉西他滨单独使用。

图1 槲皮素、吉西他滨、槲皮素+吉西他滨联合对Panc-1细胞处理后细胞存活检测
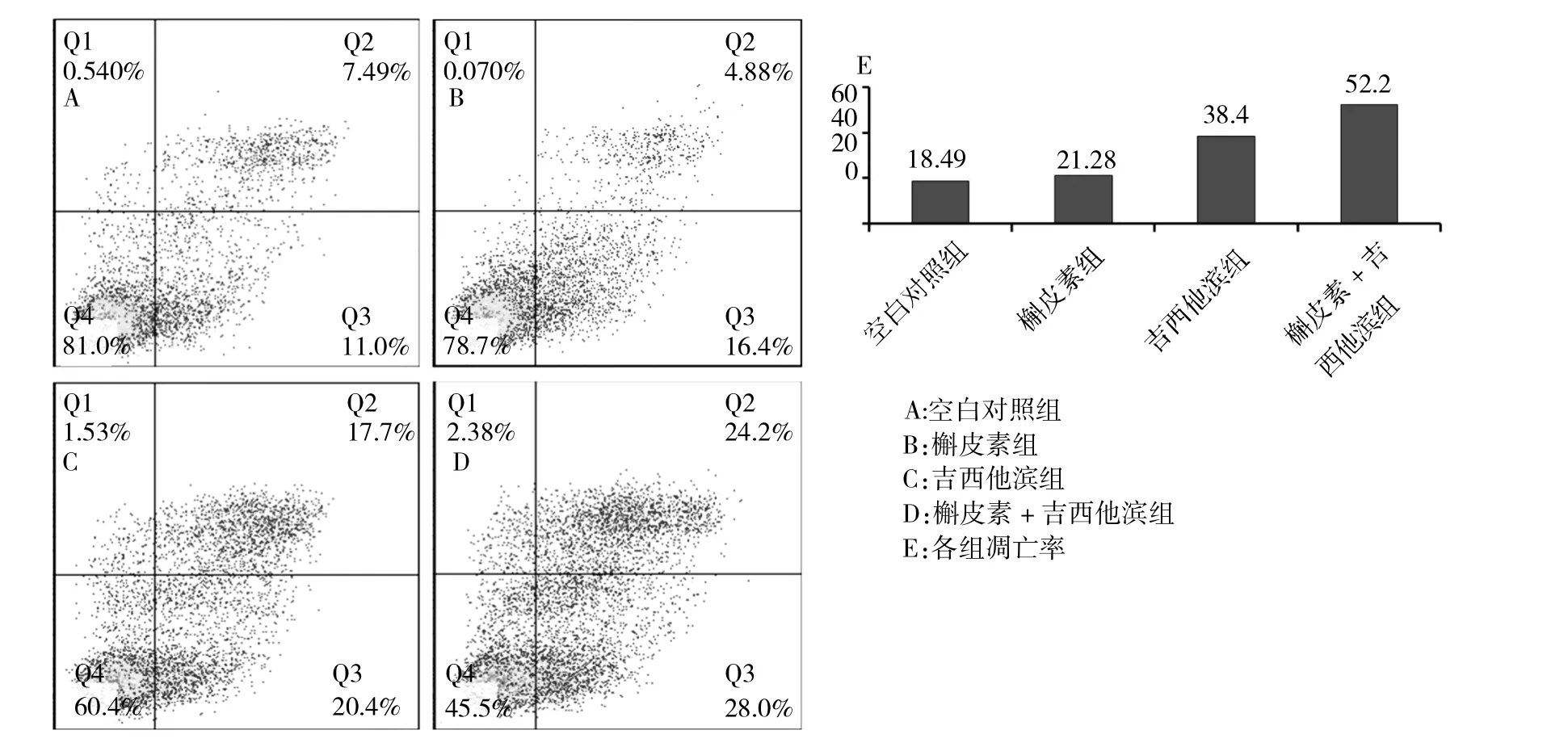
图2 流式细胞术检测凋亡情况
2.3 吉西他滨联合槲皮素能够减少S期胰腺癌细胞的比例 在吉西他滨联合槲皮素能够显著诱导凋亡的基础上,进一步做了细胞周期检测,确定是否联合用药能够改变胰腺癌细胞的细胞周期。如图3所示,对照组(45%)和槲皮素组(41%)的S期细胞量明显多于吉西他滨(36%)和联合用药(34%)。可见吉西他滨联合槲皮素后较其他处理组更能减少S期胰腺癌细胞的比例。
2.4 联合用药可能通过BCL-2家族影响细胞凋亡在细胞凋亡过程中,BCL-2家族充当了重要角色。Bcl-2家族蛋白中有抑制凋亡的基因,如BCL-2、BCL-xl等;也有促进凋亡基因BIK、BAX等[8]。为了检测药物在诱导Panc-1细胞凋亡过程,其分子机制是否通过BCL-2家族基因而导致,为了确定此问题,我们用荧光定量PCR方法,检测了4组(槲皮素组、吉西他滨组、槲皮素吉西他滨联合组以及空白对照组)处理细胞中凋亡相关BCL-2家族部分成员的相对表达情况。如图4所示,联合用药能够显著增强促凋亡基因(BAX和BIK)和减少抑制凋亡基因(BCL-1和BCL-xl)的表达。槲皮素增强吉西他滨对胰腺癌细胞Panc-1诱导凋亡的作用,可能是通过影响凋亡基因的表达而实现的[9]。
3 讨论
胰腺癌是威胁国人健康的重要元凶之一,至今缺乏有效的治疗手段,患者5年生存率极低[1-2]。吉西他滨是临床上治疗胰腺癌的首选药物之一,但是其疗效还未尽人意。槲皮素具有高效抗氧化、抗炎症、降血压、降血脂、改善动脉病变和心律失常以及抗肿瘤等功效[10-11]。其抗肿瘤功能主要表现在能够诱导肿瘤细胞凋亡、细胞周期停滞,同时下调原癌基因(如Mcl-1、Ras、MEK和PI3K等)和上调肿瘤抑制基因(如p53和p21等)。在前列腺癌、宫颈癌、肺癌、乳腺癌和肠癌中,槲皮素都表现出了抑制细胞生长和增殖的能力[12]。

图3 药物对胰腺癌细胞细胞周期的影响
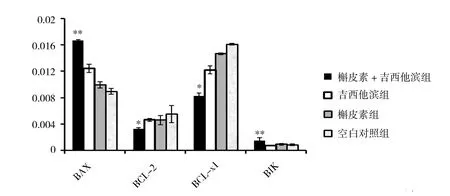
图4 药物诱导胰腺癌细胞凋亡相关基因BCL-2家族的表达情况
本研究利用吉西他滨联合槲皮素共同诱导胰腺癌细胞系Panc-1凋亡。通过细胞存活实验和流式细胞术检测凋亡实验,结果显示槲皮素能够显著增强吉西他滨诱导的杀伤能力,高于吉西他滨单独使用。实验证实槲皮素增强吉西他滨杀伤能力可能是通过调节BCL-2家族相关基因的表达而影响的。
目前临床上的化疗药物种类已经很多,但是肿瘤的治疗还未达到预期的效果,合理组合目前临床上的药物,是一条探索和开发更佳治疗肿瘤方案的途径之一[13-14]。本研究利用一种作为保健品的天然抗氧化剂联合吉西他滨处理胰腺癌细胞,发现此组合能够显著增强化疗药物的杀伤效果,这将为胰腺癌治疗药物吉西他滨与其他药物联合提供了参考借鉴。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[2]Chrystoja C C,Diamandis E P,Brand R,et al.Pancreatic cancer [J].Clin Chem,2013,59(1):41-46.
[3]Bardeesy N,DePinho R A.Pancreatic cancer biology and genetics[J].Nat Rev Cancer,2002,2(12):897-909.
[4]Zhou B,Zhang J,Chen G,et al.Therapy of Smac mimetic SM-164 in combination with gemcitabine for pancreatic cancer[J].Cancer Lett,2013,329(1):118-124.
[5]Ali S,Ahmad A,Banerjee S,et al.Gemcitabine sensitivity can be induced in pancreatic cancercellsthrough modulation of miR-200 and miR-21 expression by curcumin or its analogue CDF[J].Cancer Res,2010,70(9):3606-3617.
[6]Wang P,Zhang K,Zhang Q,et al.Effects of quercetin on the apoptosis of the human gastric carcinoma cells[J].Toxicol In Vitro,2012,26(2):221-228.
[7]Guillermet-Guibert J,Davenne L,Pchejetski D,et al.Targetingthe sphingolipid metabolism to defeat pancreatic cancer cell resistance to the chemotherapeutic gemcitabine drug[J].Mol Cancer Ther,2009,8(4):809-820.
[8]Garcia-Saez A J.The secrets of the Bcl-2 family[J].Cell Death Differ,2012,19(11):1733-1740.
[9]Thomas S,Quinn B A,Das S K,et al.Targeting the Bcl-2 family for cancer therapy[J].Expert Opin Ther Targets,2013,17(1):61-75.
[10]Ranawat P,Pathak C M,Khanduja K L.A New Perspective on the Quercetin Paradox in Male Reproductive Dysfunction[D].Phytother Res,2012.
[11]Dajas F.Life or death:neuroprotective and anticancer effects of quercetin[J].J Ethnopharmacol,2012,143(2):383-396.
[12]Russo M,Spagnuolo C,Tedesco I,et al.The flavonoid quercetin in disease prevention and therapy:facts and fancies[J].Biochem Pharmacol,2012,83(1):6-15.
[13] Sullivan K M,Kozuch P S.Chemotherapy and other supportive modalities in the palliative setting for pancreatic cancer[J].Cancer J,2012,18(6):633-641.
[14] Smaglo B G,Pishvaian M J.Postresection chemotherapy for pancreatic cancer[J].Cancer J,2012,18(6):614-623.
Quercetin enhances gemcitabine-induced apoptosis in pancreatic cancer cells panc-1
Quercetin Gemcitabine Pancreatic cancer cellProliferation Apoptosis
2012-12-28)
(本文编辑:田云鹏)
310009 杭州市第三人民医院药剂科(周小红);浙江大学医学院附属第一医院药剂科(徐飞龙、陈建)
【 Abstract】Objective To evaluate the effect of gemcitabine combined with quercetin on pancreatic cancer Panc-1 cells.Methods The cultured pancreatic cancer Panc-1 cells were divided into 4 groups:gemcitabine group (50μg/ml),quercetin group (50μM),gemcitabine+quercetin group and control group.Cell viability was assessed with MTT method on 24,48,72 and 96h after treatment.Cell apoptosis and cell cycle were examined by using flow cytometry.The expression of Bcl-2 genes was determined by quantitative real time PCR.Results The combination of gemcitabine and quercetin induced apoptosis of pancreatic cancer cells and blocked cell cycle and up-regulated the expression of apoptosis-related Bcl-2 gene family.Conclusion Gemcitabine combined with quercetin can significantly enhance the apoptosis of pancreatic cancer Panc-1 cells,which is associated with the up-regulated expression of Bcl-2 genes.
