杜仲EuHMGRS基因家族的鉴定及生物信息学分析
2013-04-03乌云塔娜叶生晶
王 淋,乌云塔娜,叶生晶
(1.中南林业科技大学 a.经济林育种与栽培国家林业局重点实验室;b.林学院,湖南 长沙 410004;2.中国林业科学研究院经济林研究开发中心,河南 郑州 450003;3.国家林业局杜仲工程技术研究中心,河南 郑州 450003;4.国家林业局中南林业调查规划设计院,湖南 长沙 410014)
杜仲Eucommia ulmoidesOliv.是落叶乔木,高达20 m,皮、枝及叶均含胶质[1]。杜仲是我国特有的物种,也是名贵的药材,富含大量绿原酸、类胡萝卜素等活性成[2-3],不仅如此,杜仲还是宝贵的天然橡胶资源[4]。杜仲胶独有的橡塑二重性,广泛应用于工业、建筑以及人们的日常生活中,作为我国特有的经济物种,栽培面积广泛,不仅在北京、河南、河北,而且在新疆的喀什等地区都能生长[5],我国杜仲的栽培面积占世界总栽培面积的90%以上,因此我国被誉为是世界上温带胶资源最为丰富的国家[6-7]。
杜仲胶的化学成分为聚异物二烯,与天然橡胶的顺势异戊二烯相比,杜仲胶为反式异戊二烯,分子式相同,但结构始不同,均属于多萜类化合物[8]。萜类化合物(isoprenoid)是植物生长发育中重要的次生代谢产物[9]。天然萜类化合物都来源于2个基本的植物萜类物质合成途径,一是位于质体的丙酮酸/磷酸甘油醛(MEP)途径,另一个是位于细胞质的甲羟戊酸为前体的甲羟戊酸(MVA)途径[10],这2个途径均能合成萜类物质前体异戊烯基焦磷酸(IPP)及其异构物二甲基烯丙基焦磷酸(DMAPP)[11]。3-羟基-3-甲基戊二单酰辅酶A还原酶(HMGR)是位于MVA途径中的第1个限速酶,对于萜类生物合成的重要的调控作用[12-13]。在HMGR的催化作用下,3-羟基,3-甲基戊二单酰辅酶A(HMG-CoA)可以生成甲羟戊酸(MVA),这一过程是不可逆转过程[14]。在MVA途径中,HMGR家族基因对萜类物质合成的“碳流”变化起到了决定性的作用[15]。Harker等对HMGR进行了相关研究,得出HMGR的表达量与植物体内萜类物质的含量成正相关,因此提高HMGR的表达量有利于提高植物中萜类物质的含量[16-20]。近年来,对其它植物HMGR的基因报道较多,但就杜仲HMGR基因的研究较少,从全基因组和转录组的角度对整个杜仲HMGR基因家族的分析和研究鲜见报道。
杜仲各个组织器官中含优质天然橡胶-杜仲胶,是目前极具发展潜力的优质天然胶资源。目前,杜兰英等[21]通过环剥与环割技术,大幅度提高杜仲产果量以及产胶量,但是没有阐述杜仲胶的分子合成机制。
杜仲胶属于多萜类化合物,3-羟基-3-甲基戊二酰辅酶A还原酶基因(HMGRS)是萜类化合物合成重要途径MVA途径的关键酶之一。本研究在杜仲转录组和基因组测序的基础上,对EuHMGRS基因家族的一级结构特征、二级结构、三级结构、理化性质、保守结构域、系统进化关系、内含子/外显子、启动子相关元件进行了系统分析,旨在为其功能研究和生物合成杜仲胶研究提供分子基础。
1 材料与方法
1.1 数据来源
文中数据来源于杜仲转录组以及全基因组数据库[22-23]。
1.2 生物信息学分析方法
文中根据相关生物信息学分析软件及数据库 phytozome(http://www.phytozome.net/search.php) 数据库、ExPASyProtParam(http: //cn.expasy.org)、TMHMM(http://www.cbs.dtu.dk/services/TMHMM2.0/)、PSIPRED(http: //bioinf.cs.ucl.ac.uk /psipred)、Swiss model(http://swissmodel.expasy.org/)、MEME(http://meme.nbcr.net/meme/)、GSDS(http://gsds.cbi.pku.edu.cn/index.php)、PLACE (http://www.dna.affrc.go.jp/PLACE/signalscan.html)、PLANT CARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)、MEGA5.1和ClustalX2对杜仲HMGSR蛋白的结构,理化性质、系统进化树、保守结构域以及启动子元件等进行了预测和详尽的分析[24-25]。
2 结果与分析
2.1 HMGRS基因家族序列分析
对HMGRS基因进行多序列比对分析(见图1)。在HMGRS基因均存在HMGRS蛋白特有的保守的活性位点,其中包括2个HMG-CoA结合位 点 EMPVGYVQIP、TTEGCLVA和 2个 NADP(H)结合位点DAMGMNM、GTVGGGT[26],因此可以确定为杜仲HMGRS基因家族,在杜仲中该家族成员至少包含3个基因,记为EuHMGR12、EuHMGR18、EuHMGR19[27]。杜仲 HMGRS 与其它植物的HMGRS蛋白相比在中间区域和C端保守性高,在N端的序列相似性较低,预示不同的HMGRS基因功能上具有高度的保守性,但是对于在亚细胞定位可能会具有多样性[28]。
2.2 HMGRS基因家族聚类分析
杜仲HMGRS基因家族与其它植物HMGRS基因的聚类分析(见图2)。不同植物的HMGR基因之间同源性很高,其在进化上具有很强的保守性。根据系统进化树可知,19个HMGR基因的氨基酸序列分为3个分支:单子叶植物、双子叶植物以及苔藓类植物,这3个分支完全符合植物的分类规律。杜仲HMGRS基因家族与双子叶植
物葡萄和拟南芥的HMGS基因家族同为一个大分支,EuHMGS12与EuHMGS18和EuHMGS19不属于同一分支,EuHMGS12与VvHMGR3的遗传距离较为接近,而EuHMGS18和EuHMGS19与VvHMGR2的遗传距。

图1 全长HMGRS蛋白多序列对比Fig.1 Multiple sequence alignment of the full length HMGRS proteins
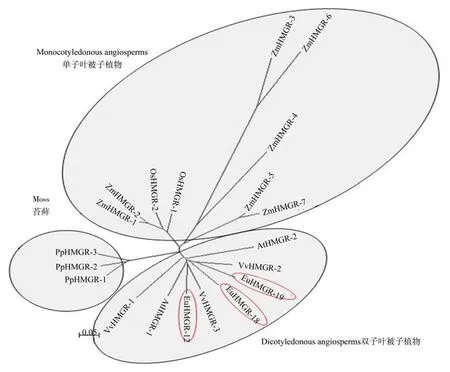
图2 HMGRS蛋白的聚类分析Fig.2 Cluster analysis of HMGRS proteins
2.3 HMGRS基因家族的蛋白质理化性质分析
对HMGRS基因家族的蛋白质理化性质进行了预测,结果见表1。HMGRS基因编码氨基酸为404~642之间;相对分子质量为44~69;理论等电点为5.9~10.0;其中EuHMGRS基因编码氨基酸为580~590之间。由不稳定系数可 知,EuHMGS19、PpHMGR1、PpHMGR2、PpHMGR3、VvHMGER2、ZmHMGR3为 稳 定 蛋白, 而 AtHMGR1、AtHMGR2、EuHMGR12、EuHMGR18、OsHMG2、OsHMGR1、VvHMGR1、VvHMGR3、ZmHMGR1、ZmHMGR2、ZmHMGR4、ZmHMGR5、ZmHMGR6、ZmHMGR7为不稳定蛋白。由蛋白质的亲水/疏水性可知,AtHMGR1、EuHMGR18、EuHMGR19、OsHMG2、OsHMGR1、 PpHMGR1、PpHMGR3、VvHMGR2、VvHMGR1、ZmHMGR3、ZmHMGR4为亲水性蛋白,而AtHMGR2、EuHMGR12、PHMGR2、VvHMGR3、ZmHMGR1、ZmHMGR2、ZmHMGR5、ZmHMGR6、ZmHMGR7为疏水性蛋白。因此,同一家族的HMGRS基因理化性质参数也有很大不同。
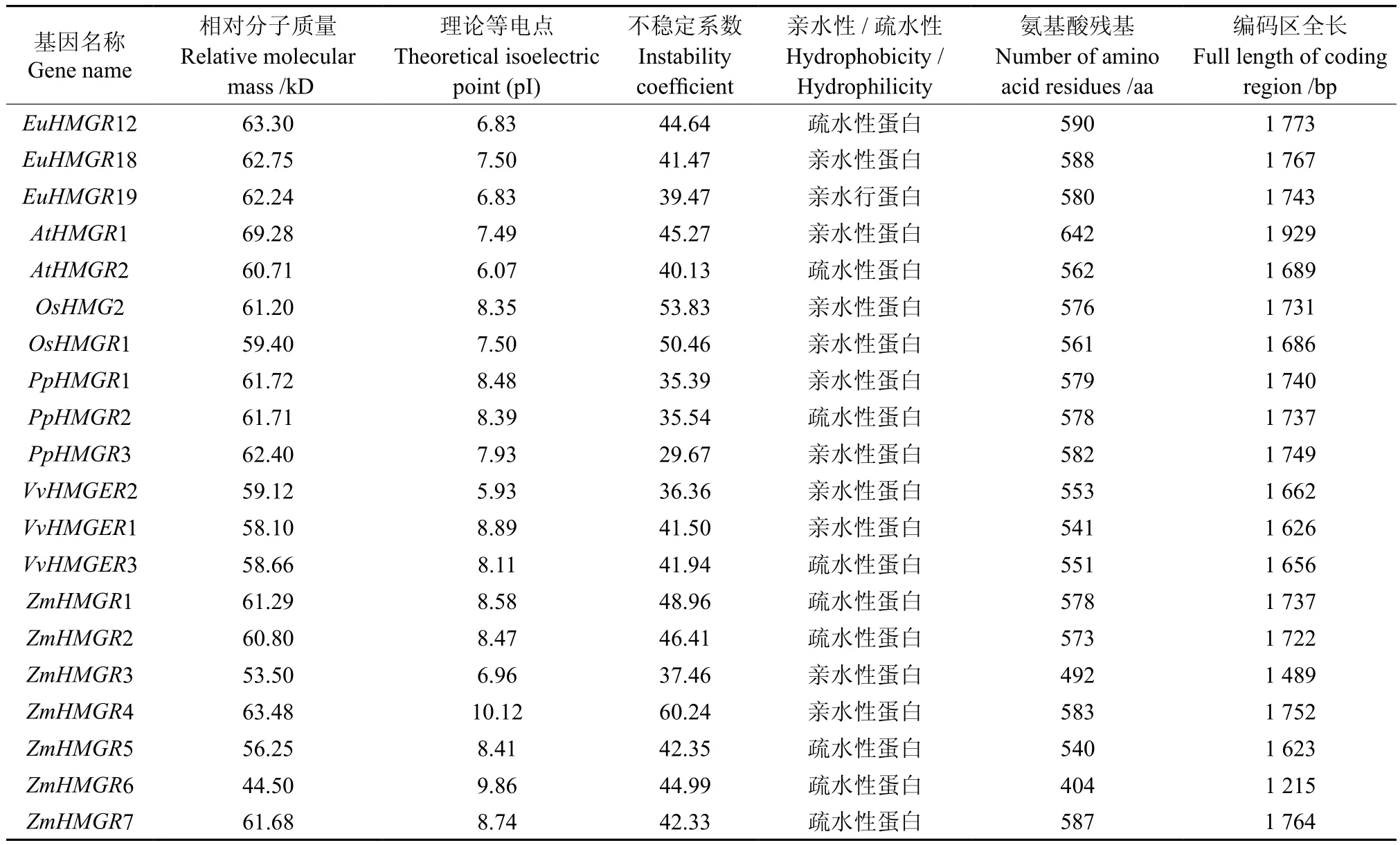
表1 EuHMGRS编码蛋白质的基本理化参数Table 1 Some basis physical and chemical parameters of EuHMGRS
2.4 HMGRS基因蛋白结构保守域预测
利用MEME在线工具分析HMGRS氨基酸序列的功能结构(见图3、图4)。除了ZmHMGR3以外,其它植物HMGR的氨基酸序列均含有3个HMG-CoA-reductaseclass功 能 域:RfSCsTGDaMGmNmV、VGtVGGGT、AIaAgqLvKSHMkY, 其 中RfSCsTGDaMGmNmV、VGtVGGGT包含了2个NADP(H)结合位点,其中EuHMGR12的3个功能域分别位于355~369 aa、 510~517 aa、564~577 aa;EuHMGR18的3个功能域分别位于 354~ 368 aa、509~ 516 aa、563~ 576 aa;EuHMGR19的3个功能域分别位于350~364 aa、505~512 aa、559~572 aa。
2.5 EuHMGRS基因家族的蛋白质基因跨膜结构域的预测
应用TMHMM-2.0对EuHMGS12、EuHMGS18和EuHMGS19跨膜结构域进行分析(见图5)。结果表明杜仲HMGRS均具有2个跨膜区,EuHMGS12的跨膜区为:TMhelix1(46~68)、TMhelix2(89~111);EuHMGS18的跨膜区为:TMhelix1(42~ 64)、TMhelix2(85~ 107);EuHMGS19的跨膜区为:TMhelix1(41~63)、TMhelix2(84~106)。EuHMGS的2个跨膜区均含有22个氨基酸残基;跨膜区氨基酸数位置极为相似,2个跨膜区均位于N端,C端无明显的跨膜区。已知大多数植物HMGR蛋白在内质网中运转,具有相同的拓扑跨膜结构,HMGR蛋白行使功能不是完全在细胞质中进行,而是通过短氨基酸链连接2个跨膜区,经蛋白运转,完成萜类物质的生物合成[24-25]。
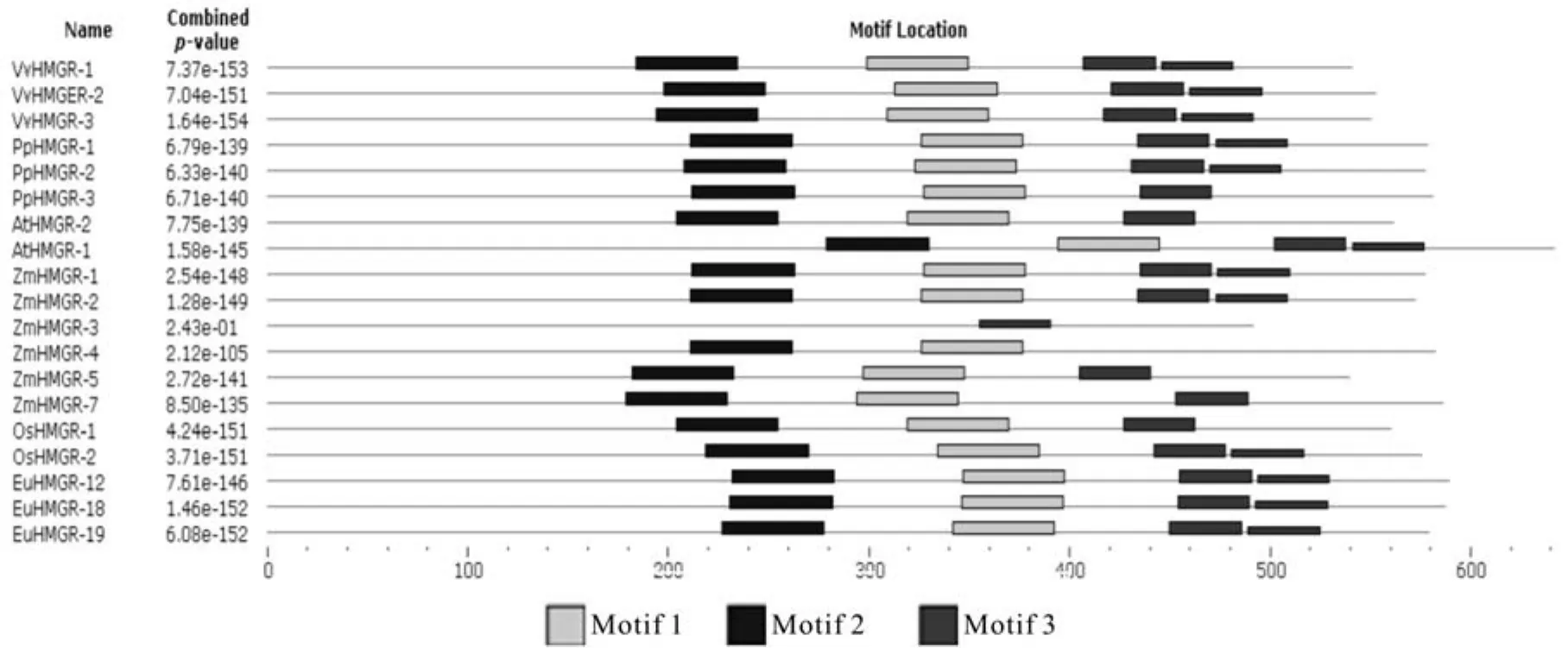
图3 HMGRS基因的保守结构域Fig.3 The conserved domains in HMGRS gene
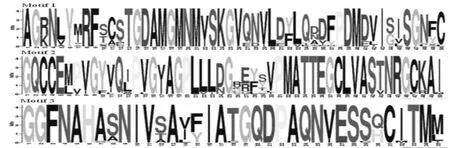
图4 HMGR蛋白的功能结构域Fig.4 The functional domains in HMGR protein

图5 EuHMGRS蛋白的跨膜区预测Fig.5 Predicted transmembrane region of the deduced protein of EuHMGRS protein
2.6 EuHMGRS基因家族蛋白的二级结构的预测
通过GOR4在线预测EuHMGRS蛋白二级结构(见图6)。结果表明,EuHMGR12蛋白二级结构为α-螺旋占42.88%,β-折叠占12.88%,螺环结构占44.24%;EuHMGR18蛋白二级结构中α-螺旋占42.88%,β-折叠占12.88%,螺环结构占44.24%;EuHMGR19蛋白二级结构中α-螺旋占43.45%,β-折叠占13.79%,螺环结构占42.76%;EuHMGRS蛋白二级结构较为相似,均属于混合型结构的蛋白质。
2.7 EuHMGRS基因家族蛋白的三级结构的预测
通过在线SWISS-MODEL中的Automated Mode进行同源建模得到EuHMGRS蛋白的三级结构模型(见图7)。ExPAsy structure assessment 程序评测推导的EuHMGR12蛋白模型QMEAN6 得分为0.63,蛋白序列的相似性为55.37 %;EuHMGR18蛋白模型QMEAN 6 得分为0.62,蛋白序列的相似性为57.92 %;EuHMGR19蛋白模型QMEAN 6 得分为0.61,蛋白序列的相似性为57.14 %。

图6 EuHMGRS蛋白二级结构预测Fig.6 Predicted secondary structure of the deduced EuHMGRS protein
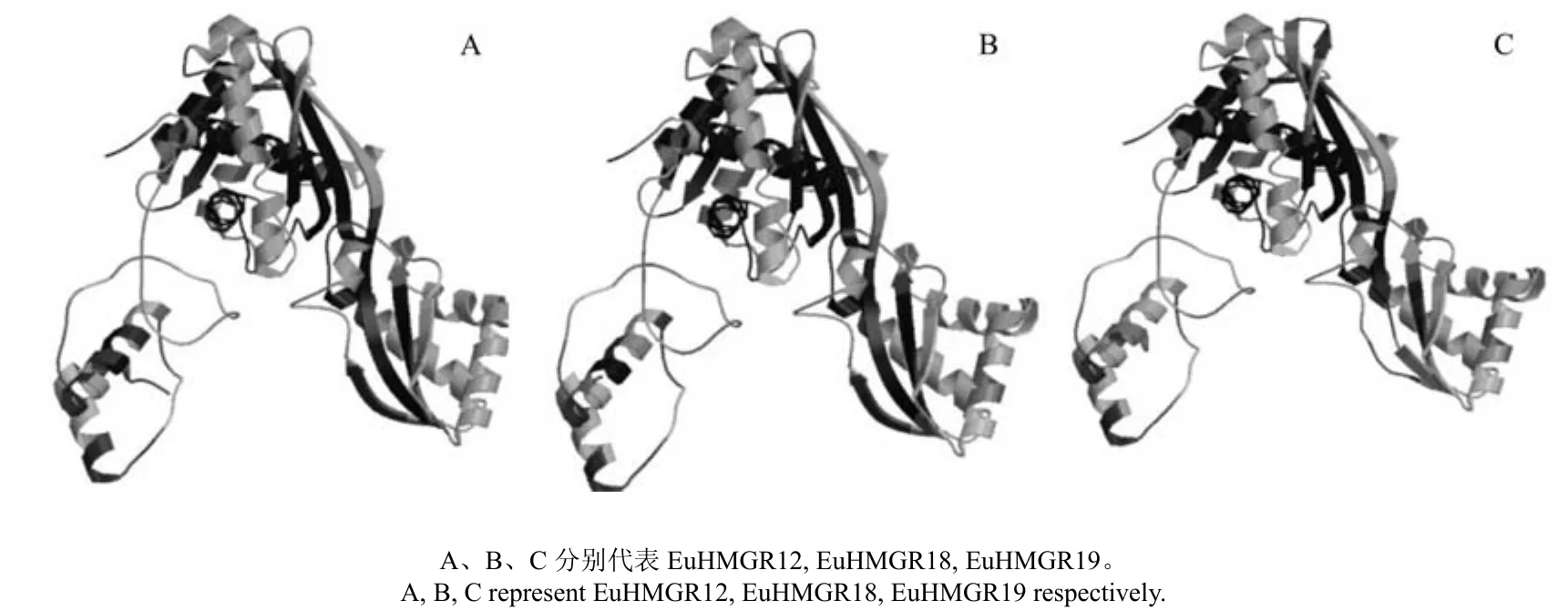
图7 EuHMGRS蛋白三级结构预测Fig.7 Predicted tertiary structure of the deduced EuHMGRS protein
2.8 EuHMGRS基因的内含子和外显子预测及分析
将杜仲HMGRS基因组序列及其对应的完整编码序列(coding sequence CDS)提交到GSDS在线网站预测基因组的序列特征(见图8,表2)。EuHMGS基因家族不同的基因具有不同的外显子和内含子数量。EuHMGR12有4个外显子,3个内含子,其中位于0、1、2相位的内含子各占1个;EuHMGR18有4个外显子,2个内含子,其中位于0、2相位的内含子各占1个,无1相位的内含子;EuHMGR19有2个外显子,1个内含子,内含子属于1相位。
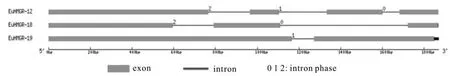
图8 EuHMGRS基因内含子和外显子预测Fig.8 Prediction of the introns and exons in EuHMGRS
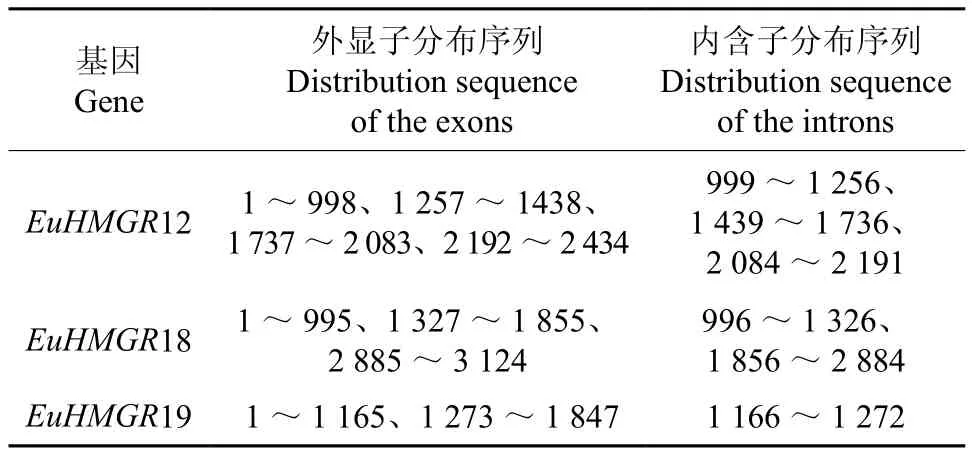
表2 EuHMGRS外显子和内含子分布序列Table 2 Distribution sequence of the introns and exons in EuHMGRS bp
2.9 EuHMGRS基因家族启动子的顺式元件作用分析
利用PLACE 和plantCARE 在线数据库,预测EuHMGRS启动子(5′UTR 2 000 bp)的主要顺式元件潜在的分布以及功能,EuHMGRS家族基因启动子主要顺式元件潜在的分布以及功能见表3。EuACOTS家族启动子含有大量基本顺式作用元件TATAbox、CAATbox,参与生理调节(circadian)、防御与胁迫(TC-rich repeats)、热胁迫(HSE)、脱落酸(ABRE)应答相关调控元件。其中EuHMGR12特有低温(LTR)和厌氧(ARE)响应作用元件;EuHMGR12可能参与受低温胁迫或厌氧基因的表达调控;EuHMGR18特有赤霉素(TATC-box)、水杨酸(TCA-element)以及真菌诱导(Box-W1)响应元件响应元件,EuHMGR18可能参与生长素相关基因的调控,此外EuHMGR18还具有6个增强子(TA-rich region)可大大的提高了基因的转录频率;而EuHMGR19中的顺式作用元件与分生组织(CAT-box)以及种子特异表达(RY-element)等相关。
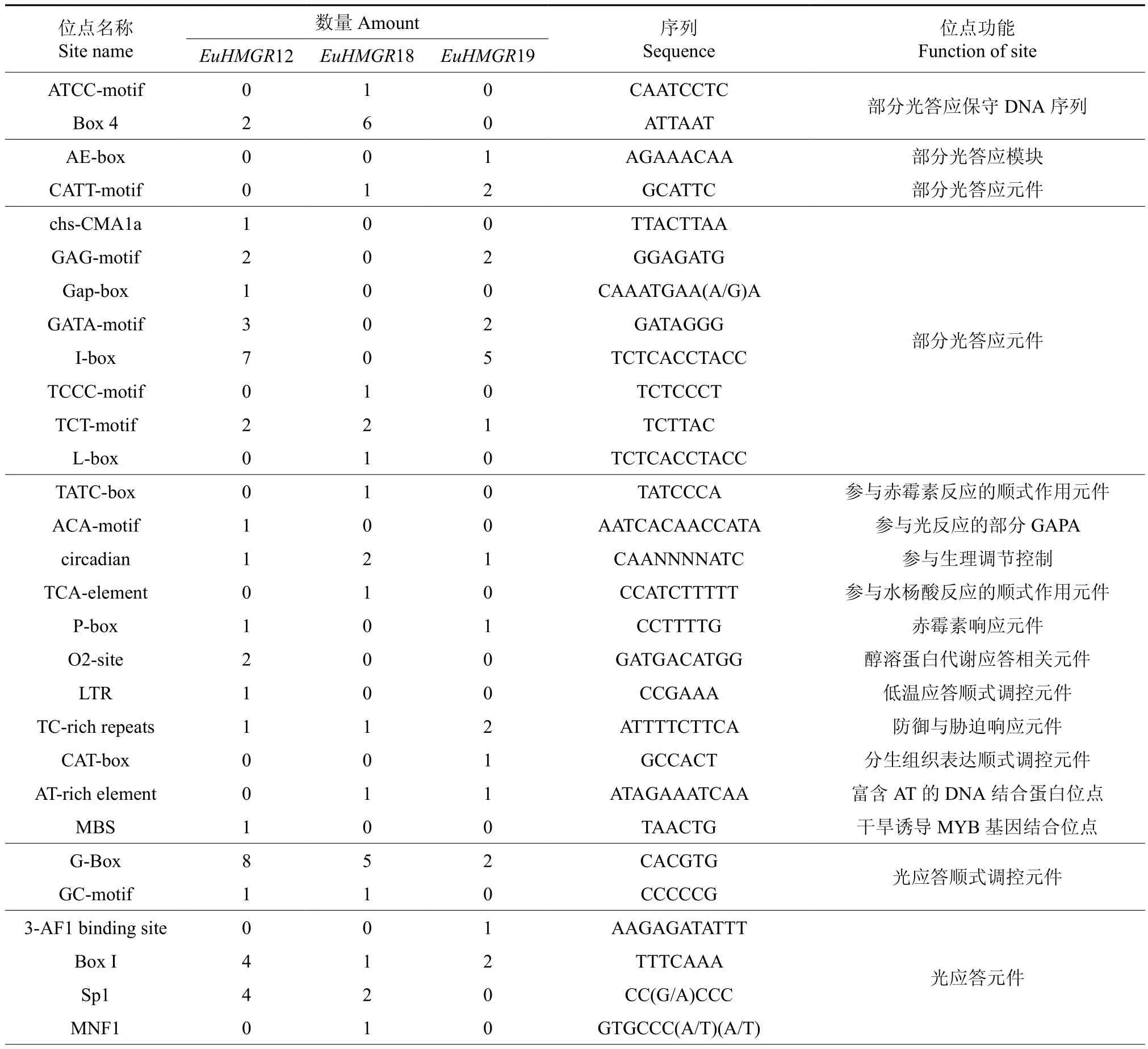
表3 EuHMGRS基因启动子区顺式元件作用预测Table 3 Function prediction of the cis-elements of promoter in EuHMGRS
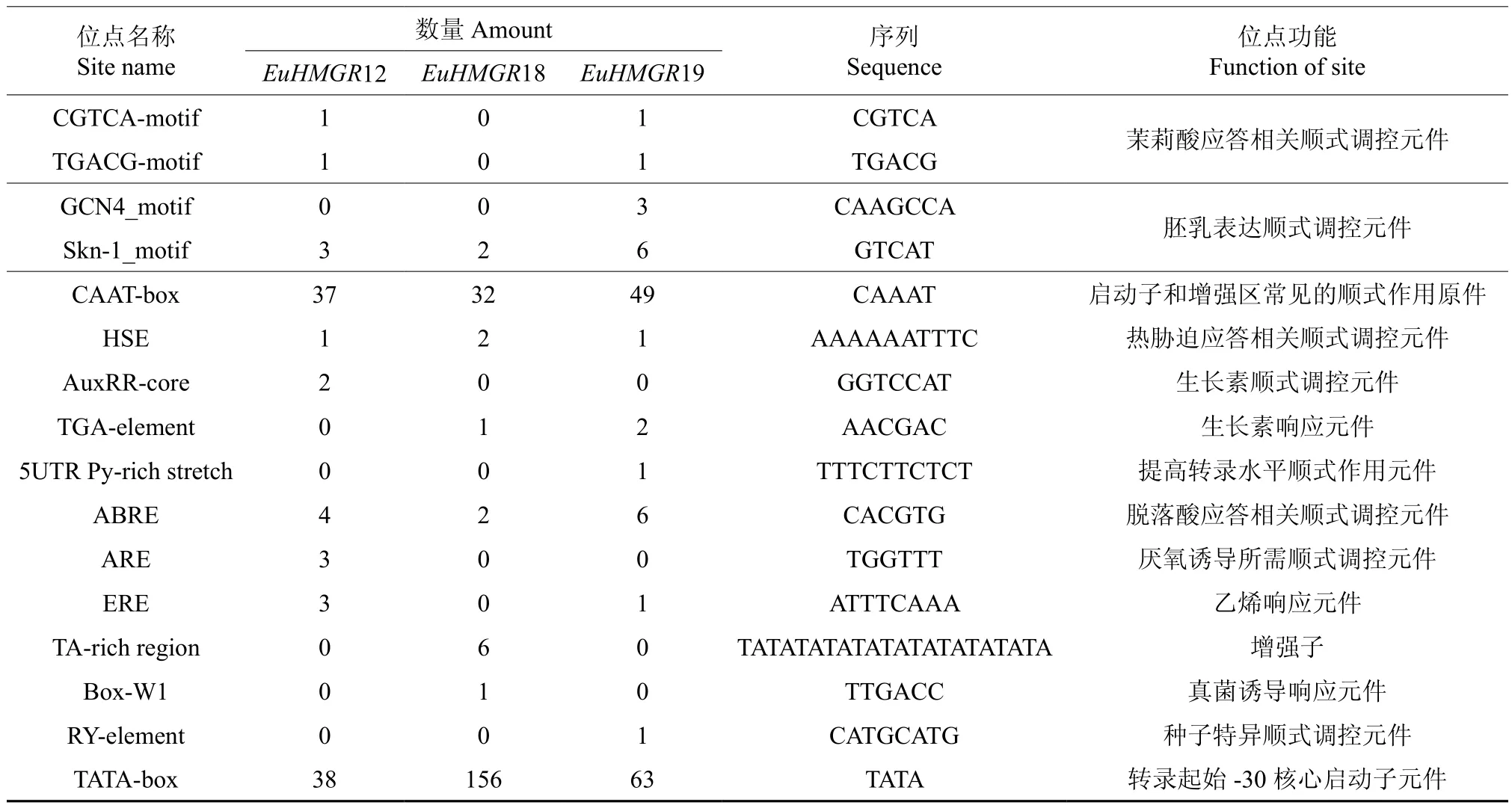
续表3Table 3 Continuation
3 结论与讨论
随着越来越多的植物全基因组测序的完成,从全基因组的角度来分析和研究基因家族成为可能。植物体内的萜类代谢是植物体内重要的代谢途径,是植物中不可少的部分[29]。HMGR是植物甲羟戊酸代谢途径的第1个关键酶,对甲羟戊酸代谢碳流的调控起决定作用[30]。根据葡萄、拟南芥、水稻、玉米等HMGR基因序列相似分析可知,杜仲HMGRS家族基因在N端较低,而中间和C端区域的保守型较高,且具有2个HMG-CoA结合位点(EMPVGYVQIP、TTEGCLVA)和2个NADP(H)结合位点(DAMGMNM、GTVGGGT),这些序列特征与其它植物的HMGR基因家族相一致。EuHMGRS基因家族3个基因的遗传距离较近,但是属于不同的进化分支。马铃薯HMGR基因家族中HMGR1基因的表达与甾类化合物合成相关,而HMGR2和HMGR3基因的表达与倍半萜植保素合成相关[31]。因此,推测EuHMGR12、EuHMGR18、EuHMGR19在参与萜类物质合成时功能具有多样性。
目前,HMGR被认为是该合成途径中第1个最关键的限速酶[32]。Wititsuwannakul[33]等提出调节巴西橡胶HMGR基因的表达量会影响橡胶的生物合成量。因此推断,提高杜仲HMGRS基因,势必会对杜仲胶的生物合成产生一定影响。
转录因子结合位点主要在转录起始位点上游附近出现[34],本研究选取转录起始位点上游2 000 bp 启动子序列进行启动子元件预测分析。EuHMGR基因家族含有大量基本元件TATA 框(TACATAAA)和CAAT框(CAAT),同时还含有光(BoxⅠ等)、热胁迫(HSE)、脱落酸(ABRE)等相关元件,EuHMGR家族基因不是含有大量相同的作用元件,且每个家族成员还存在特异的启动元件,不同的基因启动子顺式作用元件使基因对不同环境的响应及基因表达的能力均有所不同。
参考文献:
[1] 张玲玲,苏印泉,何德飞.杜仲不同栽培模式的光合、水分生理及负离子效应对比[J].中南林业科技大学学报, 2012,32(10): 24-28.
[2] 杜红岩.杜仲活性成分与药理研究的新进展[J].经济林研究,2003,21(2):58-61.
[3] 杜红岩,刘昌勇,李 钦,等.杜仲叶中3种主要活性成分含量的季节变化[J].中南林业科技大学学报,2011, 31(8): 6-9.
[4] 申 延,何 泼,秦俊哲.杜仲含胶细胞的整体观察[J].西北林学院学报,2006, 21(3): 41-44.
[5] 何 方,张康健,王承南,等.杜仲产区划分[J].经济林研究,2010, 28(2):15-17.
[6] 方世壁.杜仲胶的研究与开发[J].中外科技信息, 1998, (8):10-11.
[7] 杜红岩,胡文臻,俞 锐.杜仲产业绿皮书:中国杜仲橡胶资源与产业发展报告[M].北京:社会科学文献出版社, 2013:1-5.
[8] 宋 磊,张学俊,董大鹏,等.杜仲胶性质及提取研究的进展[J].贵州化工, 2006,31(4):4-8.
[9] Holstein SA, H oh R J.Isoprenoids: remarkable diversity of formand function [J].Lipids, 2004, 39(4): 293-311.
[10] Lichtenthaler H K, Schwender J, Disch A.Biosynthesis of isoprenoids in higher plant chloroplasts proceeds via a mevalonate independent pathway [J].FEBS Lett,1997, 400: 271-27.
[11] Dewick P M.The biosynthes is of C5-C25 terpenoid compounds[J].Nat Prod Rep, 2002, 19: 181-222.
[12] Bach T J.Hydroxy methylglutary-CoA reductase, a key enzyme in phytosterol synthesis [J].Lipids, 1986, 21: 82-88.
[13] Choi D, Ward B L, Bostock R M.Differential induction and suppress ion of potato 3-hydroxy-3-m ethylglutaryl coenzyme A reductase genes in response toPhytophthora infestansand to its elicitor arachidonic acid [J].Plant Cell, 1992, 4: 1333.
[14] 陈大华,叶和春,李国凤.马铃薯HMGR基因的克隆、序列分析及其表达特征[J].植物学报,2000, 42(7):724-727.
[15] Chen DH, Ye HC, Li GF,et al.Advances in molecular biology of plant isoprenoid metabolic pathway [J].Acta BotSin, 2000, 42:551-558.
[16] Harker M, Holmberg N, Clayton JC,et al.Enhancement of seed phytosterol levels by expression of an N-terminal truncated Hevea brasiliensis (rubber tree) 3-hydroxy-3-methylglutaryl-CoA reductase [J].Plant Biotechnol J, 2003, 1: 113-121.
[17] Wang YY, Jing FY, Yu SY,et al.Co-overexpression of the HMGR and FPS genes enhances artemisinin content inArtemisia annuaL [J].J Med Plants Res, 2011, 5: 3396-3403.
[18] Aquil S, Husaini AM, Abdin MZ,et al.Over-expression of the HMG-CoA reductase gene leads to enhanced artemisinin biosynthesis in transgenicArtemisia annuaplants [J].Planta Med, 2009, 75: 1453-1458.
[19] Alam P, Abdin MZ.Over-expression of HMG-CoA reductase and amorpha-4,11-diene synthase genes inArtemisia annuaL and its influence on artemisinin content [J].Plant Cell Rep, 2011, 30:1919-1928.
[20] Ram M, Khan MA, Jha P,et al.HMG-CoA reductase limits artemisinin biosynthesis and accumulation inArtemisia annuaL pants [J].Acta Physiol Plant, 2010, 32: 859-866.
[21] 杜兰英,刘攀峰,朱景乐,等.环剥与环割强度对果园化栽培条件下杜仲生长和结果的影响[J].中南林业科技大学学报,2013,33(8):14-18.
[22] 李铁柱,杜红岩,刘慧敏,等.杜仲果实和叶片转录组数据组装及基因功能注释[J].中南林业科技大学学报, 2012, 32(11):122-130.
[23] 李铁柱,杜红岩,刘慧敏,等.杜仲幼果和成熟果实转录组数据组装及基因功能注释[J].中南林业科技大学学报, 2012 ,32(10): 9-17.
[24] 龙甜甜,张红梅,王 婕,等.毛果杨全基因组ANK基因的鉴定及表达分析[J].安徽农业大学学报,2013,40(2):210-218.
[25] 刘攀峰,杜红岩,杜兰英,等.杜仲1-羟基-2-甲基-2-(E)-丁烯基-4-二磷酸合酶基因cDNA全长克隆与序列分析[J].植物研究, 2012, 32(4): 444-451.
[26] Ruiz-Albert J, Cerda-Olmedo E, Corrochano L M.Gene for mevalonate biosynthese inPhycomyces[J].Molecular Genetics and Genomics, 2002, 266(5):768-777.
[27] 叶生晶.杜仲MVA途径相关基因表达差异及全长cDNA序列特征[D].长沙:中南林业科技大学,2012.
[28] 郑 鹏,化文平,王喆之.秦艽HMGR基因家族的克隆及序列分析[J].陕西师范大学学报:自然科学版, 2012, 140(6):67-72.
[29] Campos N, Boronat A.Targeting and topology in the membrane of plant 3-hydroxy-3-methylglutrane coenzyme A reductase[J].Plant Cell, 1995,7(12):2163-2174.
[30] 雷 桅,汤绍虎,周启贵,等.桑萜类生物合成酶HMGR的生物信息学分析[J].蚕业科学,2008,24(3):393-399.
[31] Leivar P, Antolin-Llovera M, Ferrero S,et al.Multilevel control of Arabidopsis 3-hydroxy-3-methylglutrane coenzyme A reductase by protein phosphatase 2A[J].Plant Cell, 2001,23(4):1494-1511.
[32] Chappell J.Biochemistry and molecular biology of the isoprenoid biosynthesis pathway in plants[J].Ann Rev Plant Physio Plant Mol, 1995, 46: 521-547.
[33] Wititsuwannakul R, Wititsuwannakul D, Suwanmanee P.Puri fi cation and characterization of 3-hydroxy-3-methylglutaryl coenzyme A reductase from latex ofHevea brasiliensis[J].Phytochem,1990,29: 1401-1403.
[34] 姜志磊,李淑芳,胡庆才,等.水稻、拟南芥组织特异性启动子的序列特征分析[J].中国农学通报, 2013,29(15):142-148.
