响应面法优化木薯淀粉制备低聚异麦芽糖工艺
2013-03-28王镇发李夏兰陈培钦
王镇发 李夏兰 陈培钦
(华侨大学化工学院生物工程系,厦门 361021)
低聚异麦芽糖(isomaltooligosaccharide,IMO),是淀粉糖的一种,主要成分为α-1,6-糖苷键结合的异麦芽糖(IG2)、潘糖(P)、异麦芽三糖(IG3)及四糖(含四糖)以上(Gn)的低聚糖[1]。低聚异麦芽糖具有促进双歧杆菌超强增殖、抗龋齿、消除疲劳、促进钙的吸收、增强机体免疫力、润肠通便等生理功能[2-4]。又因其具有低甜度、低热值、低黏度、保湿性、非发酵性、耐酸热性等特性,所以被广泛应用于各类保健品、饮品、奶制品、糖果和面食等[5]。它是功能性低聚糖中产量最大,应用最广泛,集营养、保健、疗效于一体的被称为21世纪的新型生物糖源。
以玉米淀粉为原料制备低聚异麦芽糖目前已经实现工业化,但是以木薯淀粉为原料制备低聚异麦芽糖的研究较少。木薯淀粉的粗蛋白、脂肪和灰分含量比玉米淀粉少,而支链淀粉比玉米高,水解产物的分支低聚糖含量更高,这些特性对生产分支低聚糖都非常有利[6-8]。我国木薯资源丰富,利用木薯淀粉为原料采用多种酶联合作用制备低聚异麦芽糖,可以大幅度提高木薯淀粉资源的附加值,同时为木薯资源的综合利用开辟一条新的途径。
1 材料与方法
1.1 原料与试剂
木薯淀粉:聚祥(厦门)淀粉有限公司。葡萄糖,麦芽糖,异麦芽糖,麦芽三糖,潘糖,异麦芽三糖:均为色谱纯,美国sigma公司;乙腈:霍尼韦尔中国有限公司;耐高温α-淀粉酶(酶活为68 U/mL,自制稀释)、真菌α-淀粉酶(酶活为306 U/mL)、β-淀粉酶(酶活为13 U/mL):诺维信中国有限公司;普鲁兰酶(酶活为11 U/mL,自制稀释):无锡杰能科生物工程有限公司;α-转葡萄糖苷酶(酶活为13 U/mL,自制稀释):日本天野制药株式会社;其他常规试剂均为国产或进口分析纯。
1.2 试验设备
Agilent1100高效液相色谱仪:美国 Agilent公司;电热恒温振荡水槽DKZ-2型:上海精宏实验设备有限公司;奥立龙CHNO60型pH计:上海华东电器集团有限公司。
1.3 试验方法
1.3.1 木薯淀粉制备低聚异麦芽糖工艺流程
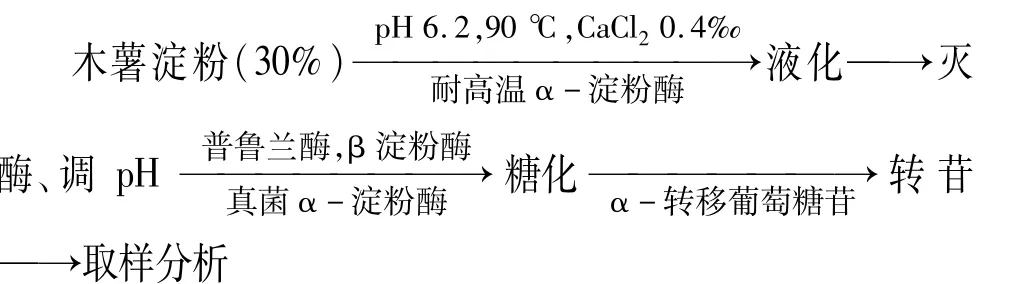
需要说明的是,在木薯淀粉制备低聚异麦芽糖过程中糖化和转苷的温度和pH相同;低聚异麦芽糖的主要成分为异麦芽糖、潘糖和异麦芽三糖[9],分析对象为这3种糖之和。
1.3.2 响应面法试验设计
单因素试验考虑了液化时间、糖化时间、真菌α-淀粉酶酶量、β-淀粉酶酶量、普鲁兰酶酶量、糖化转苷温度、糖化转苷pH、α-转移葡萄糖苷酶酶量对异麦芽糖、潘糖以及异麦芽三糖之和(简称:IG2+P+IG3)的影响。根据单因素试验结果选取真菌α-淀粉酶酶量、β-淀粉酶酶量、普鲁兰酶酶量、糖化转苷温度、糖化转苷pH、α-转移葡萄糖苷酶酶量6个因素和IG2+P+IG3作为响应值进行6因素三水平的Box-Behnken响应面设计。采用高效液相色谱法分析异麦芽糖、潘糖以及异麦芽三糖的含量[1]。
1.3.3 响应面法试验数据分析
利用Design Expert 8.0.6软件中的Box-Behnken Design模型,对上述6个因素进行响应面分析,并对所获得的响应面回归模型进行显著性检验。
2 结果与讨论
2.1 单因素试验
液化时间从50到190 min,IG2+P+IG3在不断降低,这是因为随着时间的增加淀粉液化的DE值不断增加,而低的DE值有利于生成较多的低聚异麦芽糖和较少的葡萄糖;又当液化时间为40 min时液化后的木薯淀粉液很容易退化,不易进行试验,所以液化时间选为50 min。糖化时间从0~8 h,间隔2 h做一组试验,结果糖化时间为4 h时IG2+P+IG3最大且所用时间最短。糖化转苷在pH 4.0~5.4这个范围内,IG2+P+IG3随着pH的增大而增加;当pH大于5.4,IG2+P+IG3随着pH的增大而减少。糖化转苷温度范围35~60℃,在40℃时IG2+P+IG3最大。当β-淀粉酶添加量从0~0.20 mL时,IG2+P+IG3随着添加量的增加而迅速增加;当添加量大于0.20 mL时,IG2+P+IG3稍微减少一些,当添加量大于0.30 mL时,IG2+P+IG3趋向平衡,基本不变。当普鲁兰酶添加量从0~0.20 mL时,IG2+P+IG3随着添加量的增加而迅速增加;当添加量大于0.20 mL时,IG2+P+IG3随之减少。当 α-淀粉酶添加量从0~0.30 mL时,IG2+P+IG3随着添加量的增加而迅速增加;当添加量大于0.30 mL时,IG2+P+IG3稍微减少一些,当添加量大于0.40 mL时,IG2+P+IG3趋向平衡,基本不变。当α-转移葡萄糖苷酶添加量从0.02~0.10 mL时,IG2+P+IG3随着添加量的增加而迅速增加;当添加量大于0.10 mL时,IG2+P+IG3随着添加量的增加而减少。
2.2 Box-Behnken试验
根据单因素考察结果选取温度(X1,℃)、pH(X2)、α-淀粉酶酶量(X3,mL)、β-淀粉酶酶量(X4,mL)、普鲁兰酶酶量(X5,mL)和 α-转移葡萄糖苷酶酶量(X6,mL)作为考察因素,采用 Box-Behnken法6因素3水平进行试验,以IG2+P+IG3(R,mg/mL)作为响应值。试验安排及试验结果如表1。
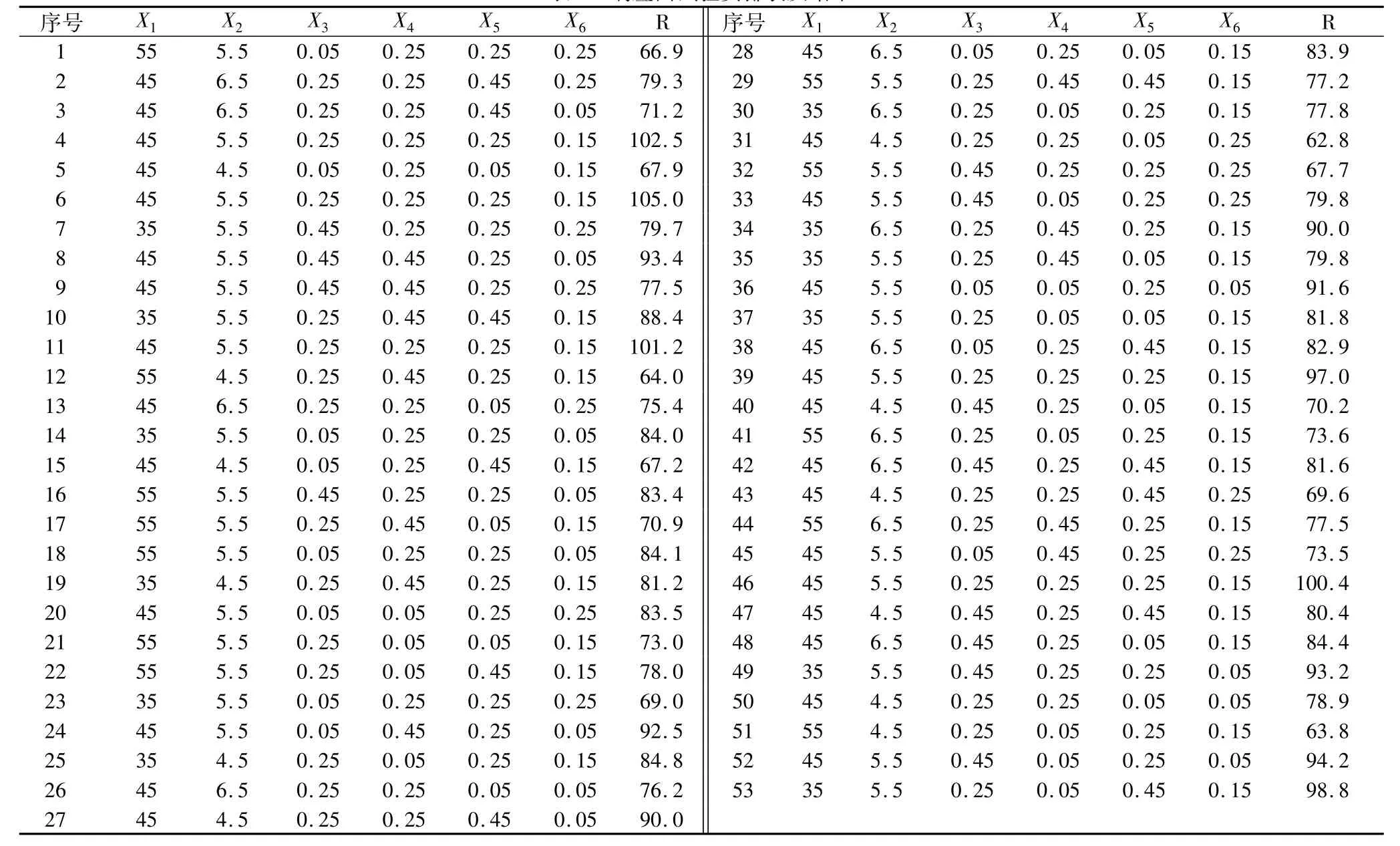
表1 响应面试验安排表及结果
利用Design Expert软件,对数据进行多元回归拟合,获得以IG2+P+IG3对温度、pH、α-淀粉酶酶量、β-淀粉酶酶量、普鲁兰酶酶量和α-转移葡萄糖苷酶酶量的二次多项回归方程:R=101.22-5.37X1+3.05X2+1.61X3-0.61X4+2.47X5-6.16X6+2.70X1X2-2.48X1X3+0.31X1X4-1.79X1X5-0.55X1X6-2.03X2X3+2.43X2X4-2.02X2X5+5.47X2X6+0.74X3X4+1.14X3X5-0.018X3X6-0.89X4X5-1.55X4X6+0.57X5X6-10.17X12-11.50X22-5.33X32-2.95X42-7.09X52-7.21X62
从回归模型方差(表2)可知,试验所选用的二次多项模型 F值为9.033,“Prob>F”<0.000 1,具有显著性;失拟项为0.158 0,影响不显著,说明模型不失拟;整个模型R2=0.907 0,变异系数5.79%,表明方程的因变量与全体自变量之间的回归效果显著,此模型拟合较好。
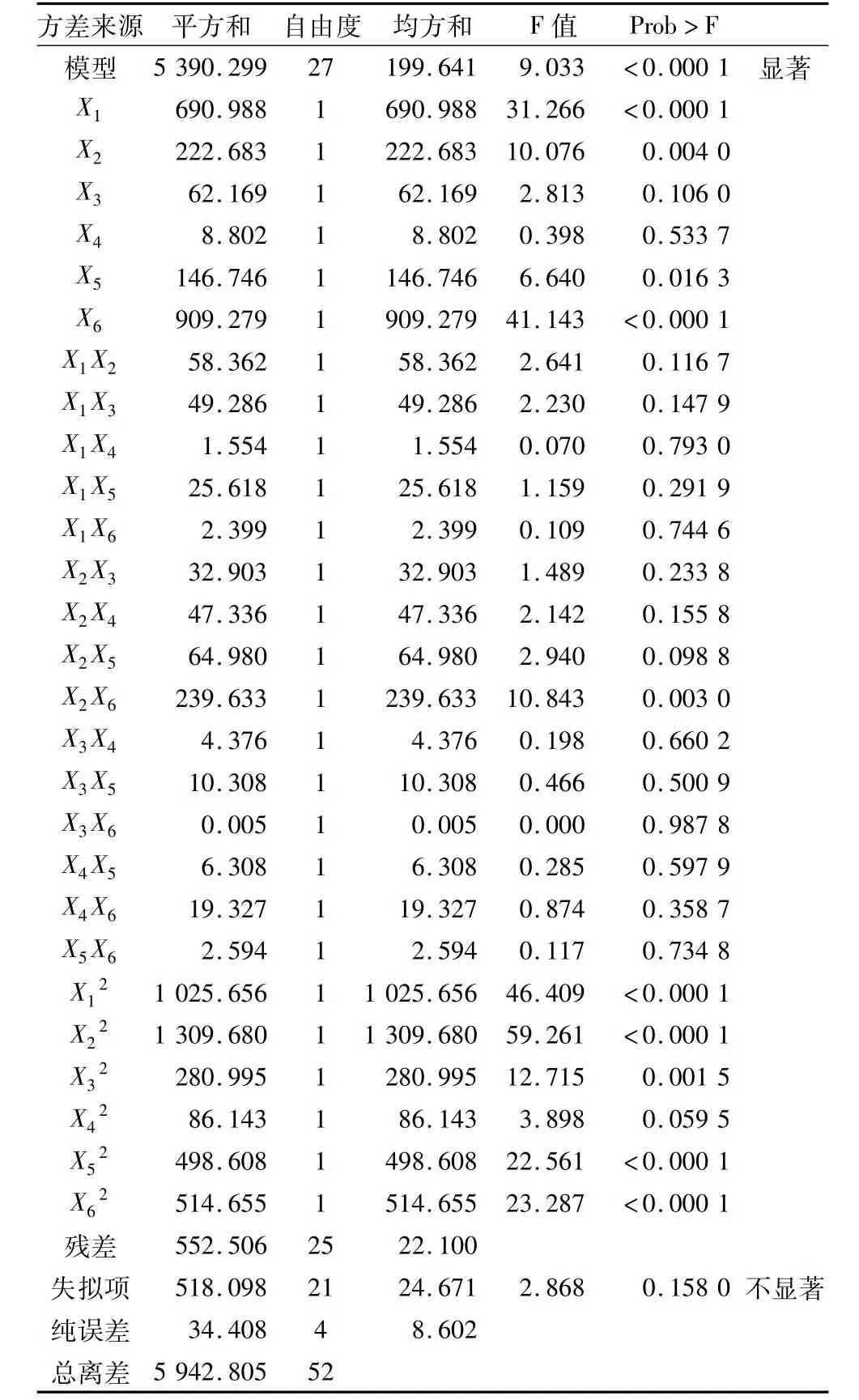
表2 响应面试验方差分析结果
由表 2方差分析结果可知,X1、X2、X5、X6、X2X6、X12、X22、X32、X52、X62对生成IG2+P+IG3有显著或极显著的影响,其他因素影响相对较小;方程的一次项和二次项(P<0.05)比较显著,因素的交叉项(P>0.05)相互作用不显著,说明各个具体试验因素对响应值的影响是二次抛物面的关系,而各个因素之间的交互作用在试验中影响不大。
2.3 响应面分析
通过Design-Expert统计分析软件作响应曲面,可以直观地分析温度、pH、α-淀粉酶酶量、β-淀粉酶酶量、普鲁兰酶酶量和α-转移葡萄糖苷酶酶量6个因素之间交互作用对IG2+P+IG3的影响,结果见图1~图15所示。
从图1可知,IG2+P+IG3量受pH和温度共同影响,随着pH的增大,IG2+P+IG3量不断增加,但pH超过5.5,则不利于IG2+P+IG3量的增加;随着温度的升高,IG2+P+IG3量不断增加,在40℃左右达到最大值,之后随着温度的升高,IG2+P+IG3量不断下降;pH 5.50,温度为40℃时,IG2+P+IG3量达到最大值。从图2可知,IG2+P+IG3量受α-淀粉酶酶量和温度共同影响,当温度为35℃或者55℃时,增加α-淀粉酶酶量对IG2+P+IG3量的增加影响不大;当温度为40℃、α-淀粉酶酶量为0.25 mL(76.5 U)时,IG2+P+IG3量达到最大。从图3可知,β-淀粉酶酶量与温度相比,温度的改变对IG2+P+IG3量的影响更大;当温度为45℃、β-淀粉酶酶量为0.15 mL(1.95 U)时,IG2+P+IG3量达到最大。从图4可知,IG2+P+IG3量受普鲁兰酶酶量和温度共同影响,当普鲁兰酶酶量为0.25 mL(2.75 U)、温度为45℃时,IG2+P+IG3量达到最大。从图5可知,IG2+P+IG3量受α-转移葡萄糖苷酶酶量和温度共同影响,当α-转移葡萄糖苷酶酶量为0.10~0.15 mL(1.3~1.95 U)、温度为40~45℃时,IG2+P+IG3量达到最大。从图6至图9可知,IG2+P+IG3量受α-淀粉酶酶量、β-淀粉酶酶量、普鲁兰酶酶量、α-转移葡萄糖苷酶和温度共同影响,适当的酶量和温度有利于IG2+P+IG3量的增加。从图10可知,α-淀粉酶和β-淀粉酶相互作用对IG2+P+IG3的影响不大。从图11可知,普鲁兰酶酶量的变化比α-淀粉酶酶量的变化对IG2+P+IG3量的影响更大。从图12可知,α-转移葡萄糖苷酶酶量的变化比α-淀粉酶酶量的变化对IG2+P+IG3量的影响更大。从图13可知,普鲁兰酶酶量的变化比β-淀粉酶酶量的变化对IG2+P+IG3的影响更大。从图14可知,α-转移葡萄糖苷酶酶量的变化比β-淀粉酶酶量的变化对IG2+P+IG3量的影响更大。从图15可知,α-转移葡萄糖苷酶和普鲁兰酶共同影响IG2+P+IG3的量,α-转移葡萄糖苷酶酶量为0.10~0.15 mL(1.3~1.95 U)、普鲁兰酶酶量为0.25~0.35 mL(2.75~3.85 U)时,更有利于IG2+P+IG3量的增加。从上述分析可知pH和温度与酶的相互影响比较大,酶与酶之间的相互影响比较小。
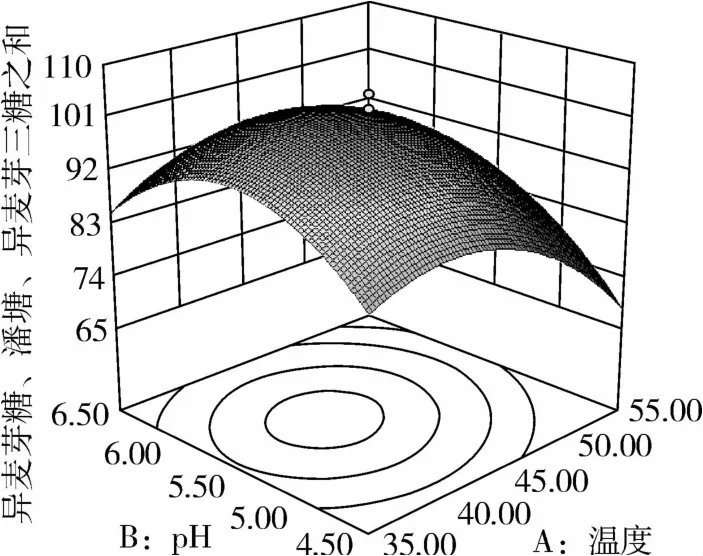
图1 pH和温度对IG2+P+IG3的影响
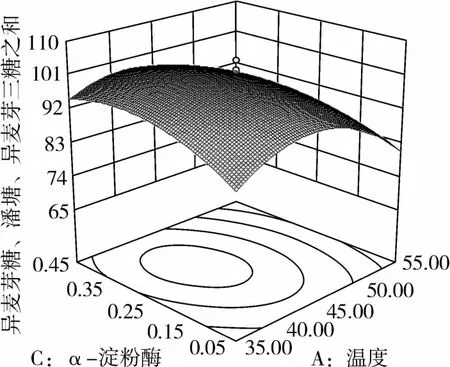
图2 α-淀粉酶和温度对IG2+P+IG3的影响

图3 β-淀粉酶和温度对IG2+P+IG3的影响
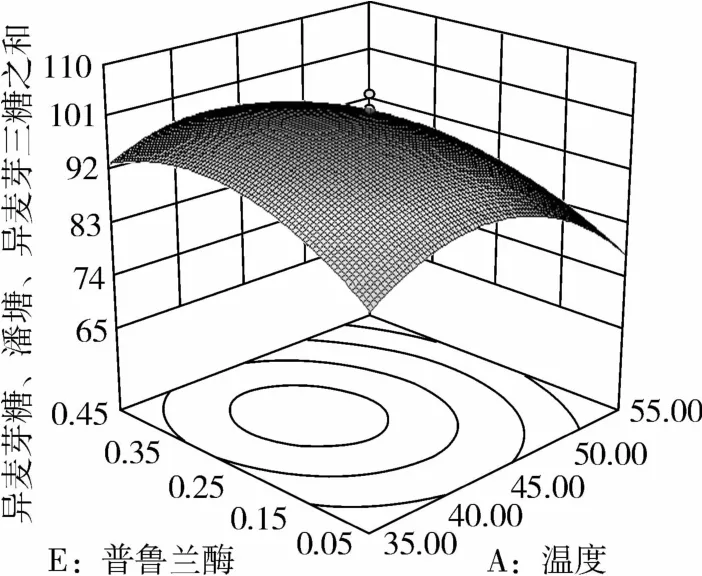
图4 普鲁兰酶和温度对IG2+P+IG3的影响
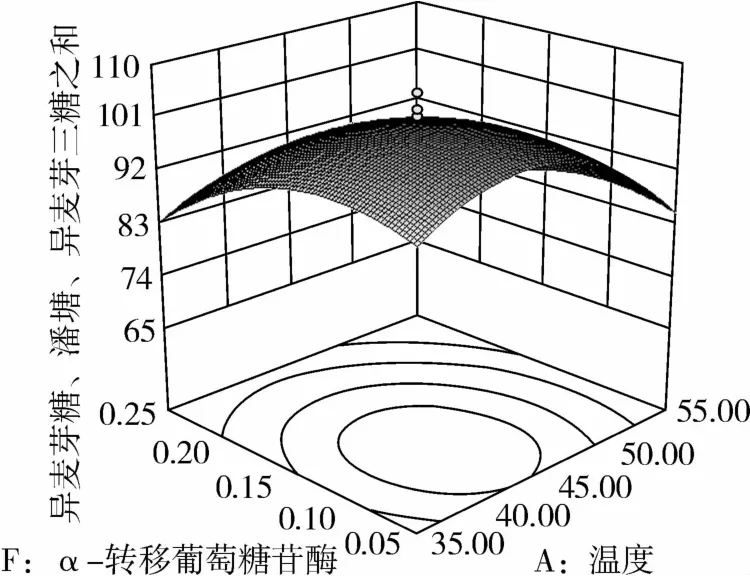
图5 α-转移葡萄糖苷酶和温度对IG2+P+IG3的影响

图6 α-淀粉酶和pH对IG2+P+IG3的影响
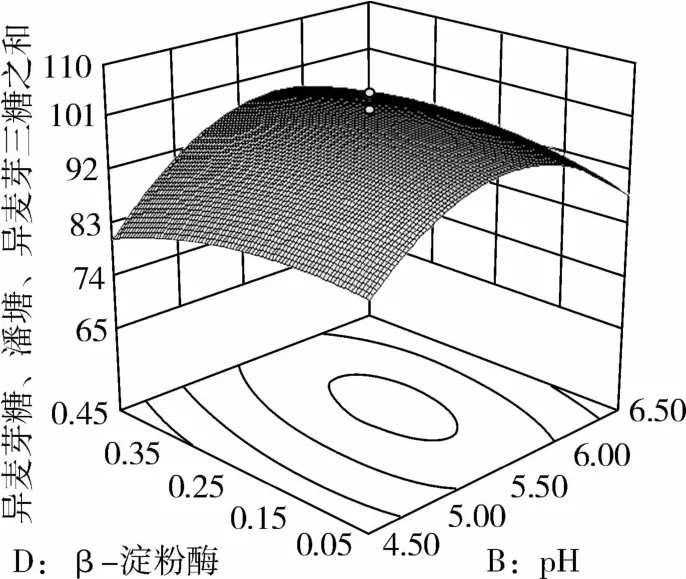
图7 β-淀粉酶和pH对IG2+P+IG3的影响
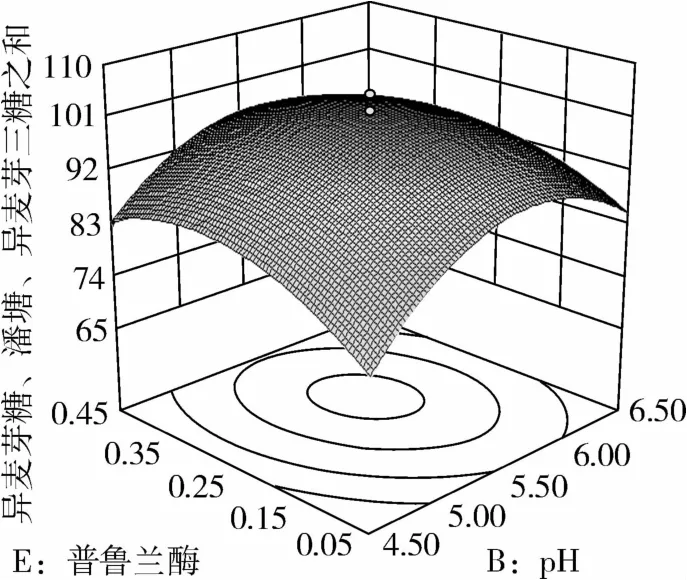
图8 普鲁兰酶和pH对IG2+P+IG3的影响
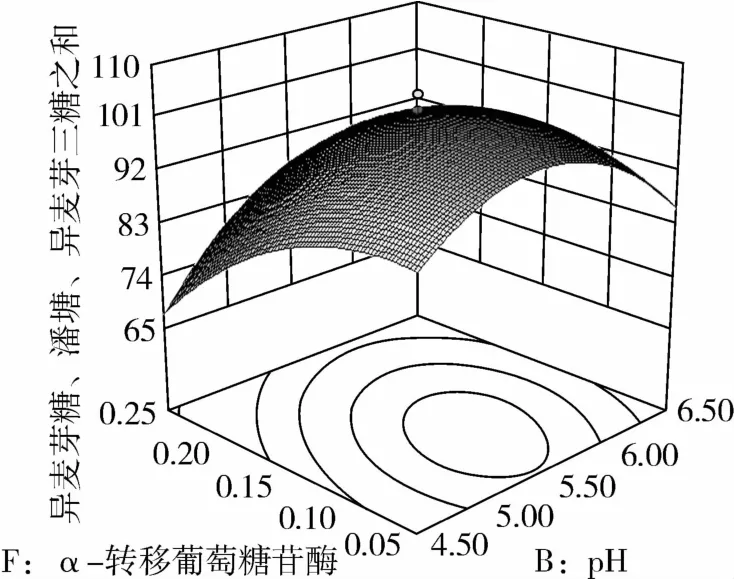
图9 α-转移葡萄糖苷酶和pH对IG2+P+IG3的影响

图10 α-淀粉酶和β-淀粉酶对IG2+P+IG3的影响
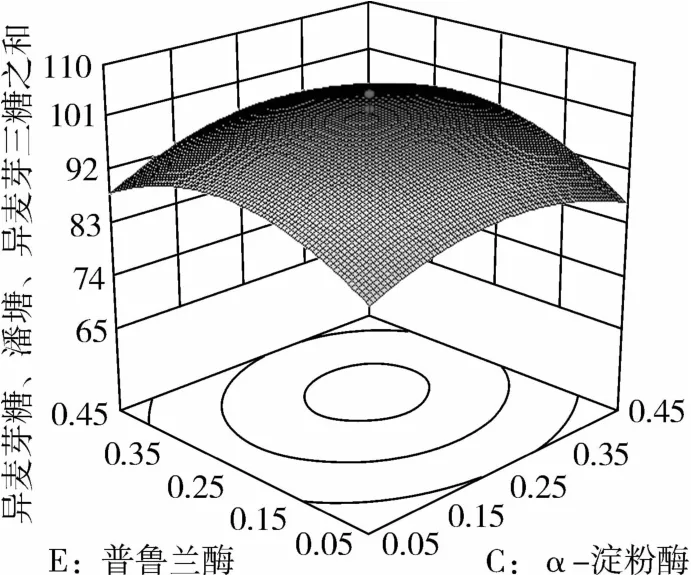
图11 普鲁兰酶和α-淀粉酶对IG2+P+IG3的影响
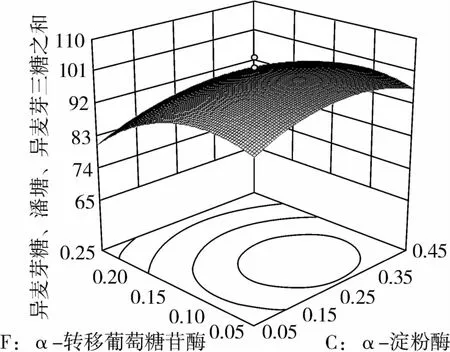
图12 α-转移葡萄糖苷酶和α-淀粉酶对IG2+P+IG3的影响
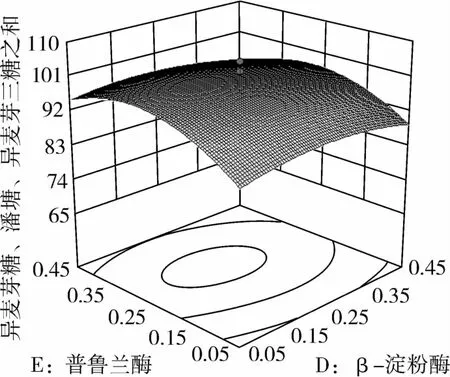
图13 普鲁兰酶和β-淀粉酶对IG2+P+IG3的影响
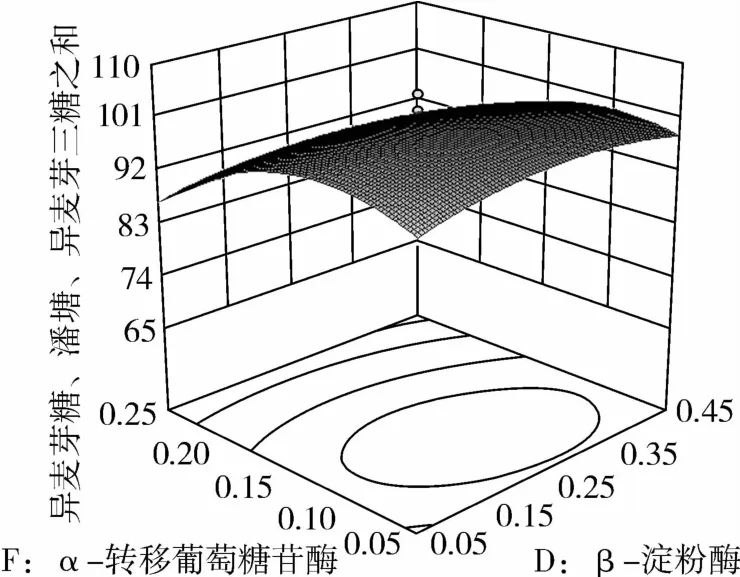
图14 α-转移葡萄糖苷酶和β-淀粉酶对IG2+P+IG3的影响
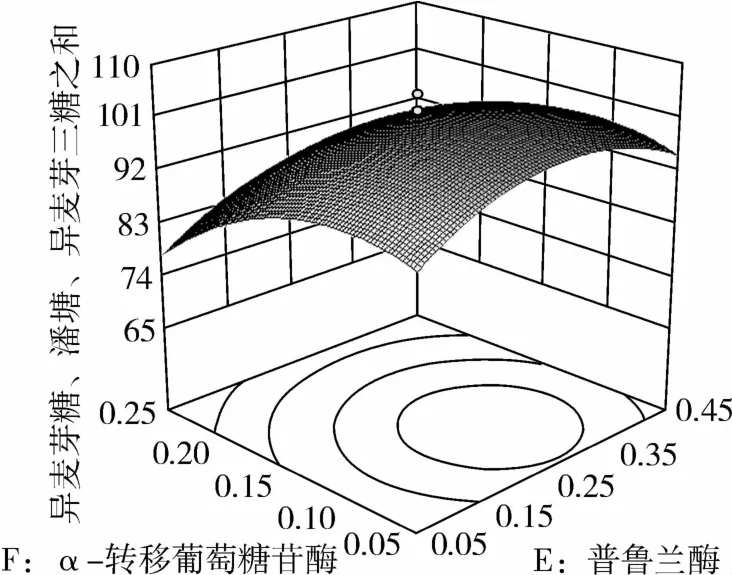
图15 α-转移葡萄糖苷酶和普鲁兰酶对IG2+P+IG3的影响
2.4 优化工艺条件验证
通过Design-expert软件建立模型分析,得出以木薯淀粉(30%)为原料制备低聚异麦芽糖的最佳工艺条件:糖化转苷温度为41.9℃,糖化转苷pH 5.45,真菌α-淀粉酶酶量为30.60 U/g(淀粉)、β-淀粉酶酶量为1.04 U/g(淀粉)、普鲁兰酶酶量为1.10 U/g(淀粉)和α-转移葡萄糖苷酶酶量为0.48 U/g(淀粉)。液化条件固定为:耐高温α-淀粉酶酶量为2.27 U/g(淀粉)、液化时间为50 min、液化温度为90℃、液化pH 6.2。该条件下反应24 h,IG2+P+IG3的预测值为103.8 mg/mL。采用上述优化工艺进行验证试验,为104.3 mg/mL,与预测值的相对误差0.48%。可见此模型可以较好地预测IG2+P+IG3的量。
3 结论
在研究单因素影响IG2+P+IG3的基础上,进一步采用Box-Behnken法响应面优化。响应面优化模型显著,失拟项不显著。优化后6个因素糖化转苷温度为41.9℃,糖化转苷pH 5.45,真菌α-淀粉酶酶量为30.60 U/g(淀粉)、β-淀粉酶酶量为1.04 U/g(淀粉)、普鲁兰酶酶量为 1.10 U/g(淀粉)和α-转移葡萄糖苷酶酶量为0.48 U/g(淀粉)。该条件下IG2+P+IG3为104.3mg/mL,即异麦芽糖、潘糖以及异麦芽三糖总和为0.417 2 g/g(淀粉),与预测值的相对误差为0.48%。说明该模型具有一定的应用价值。
[1]GB/T 20881—2007低聚异麦芽糖[S]
[2]Kohmoto T,Fukui F,Takaku H,et al.Dose-response test of isomaltooligosaccharides for increasing fecal bifidobacteria[J].Agricultural and biological chemistry,1991,55(8):2157-2159
[3]Valette P,Pelenc V,Djouzi Z,et al.Bioavailability of new synthesised glucooligosaccharides in the intestinal tract of gnotobiotic rats[J].Journal of the Science of Food and Agriculture,1993,62(2):121-127
[4]赵晋,王娇,阚健全.低聚异麦芽糖生理功能及应用的研究进展[J].食品研究与开发,2007,28(2):166-170
[5]王良东.低聚异麦芽糖性质、功能、生产和应用[J].粮食与油脂,2008(4):43-47
[6]张齐军,覃兰芳,陶静,等.木薯淀粉生产异麦芽低聚糖粉的工艺研究[J].广西轻工业,2000(2):5-7
[7]阚翠姝,白玉玲.不同品种淀粉特性的研究与应用[J].现代面粉工业,2009,23(4):41-45
[8]陈玲,温其标,叶建东.木薯淀粉微细化及颗粒形貌的研究[J].粮食与饲料工业,1999(12):41-43
[9]邹耀洪,孙佳.低聚异麦芽糖制备工艺研究[J].常熟高专学报,2003,17(2):41-46.
