盐酸左布诺洛尔的合成工艺改进*
2013-03-26陈登辉饶志威左文果钟大猷李宗桃
陈登辉,饶志威,左文果,钟大猷,李宗桃
(1.武汉大学药学院组合生物合成与新药发现教育部重点实验室,湖北武汉 430071;2.南华大学药物药理研究所,湖南 衡阳 422101)
左旋盐酸左布诺洛尔{(-)-5-[3-(叔丁胺基)-2-羟基丙基]-α-萘满酮[(-)-1·HCl]}商品名为贝他根,作为非选择性β-肾上腺受体阻滞剂,对β1和β2受体均有阻断作用,且无明显局麻作用及内在拟交感作用。其降眼压机制主要是减少房水生成,尤其对开角型青光眼具有良好的疗效,已被美国 FDA列为治疗青光眼的首选药物[1~2]。
(-)-1·HCl作为一种手性药物,其合成研究文献[3~5]报道较多,但由于在手性拆分时有68%的右旋盐酸左布诺洛尔[(+)-1·HCl]没有药用价值被丢弃,且(+)-1·HCl难以直接转化成有药用价值的(-)-1·HCl,导致产品收率不高,使原料5-羟基-α-萘满酮(2)利用率极低。例如,文献[5]方法中(-)-1·HCl拆分率为 32.7%,总产率仅25.6%,无药理活性的(+)-1难以直接转化为(-)-1,使产品的总收率很低,导致价格昂贵的原料2利用率不高。因此,对(±)-1·HCl拆分工艺中丢弃的大部分废料变成有药用价值的(-)-1·HCl的研究具有重要的实用意义。
本文在本课题组研究[5]的基础上,对其合成工艺进行改进:以回收的拆分废料[主要成分为(+)-1]为原料,经 NaOH碱化和48%HBr酸解得2。以2为起始原料,在室温下与环氧氯丙烷反应成醚得中间体 5-(2,3-环氧丙氧基)-α-萘满酮(3);3与叔丁胺氨化得消旋体左布诺洛尔[(±)-1];再盐酸化使(±)-1形成(±)-1·HCl;(±)-1·HCl用右旋酒石酸拆分得到(-)-1;最后经碱化、成盐制得(-)-1·HCl(Scheme 1),其结构经1H NMR和IR确证。
本文还对2的回收工艺用L9(33)正交表进行优化,在最佳反应条件下[反应温度90℃,反应时间为2.5 h,HBr酸强度为48%],2的回收率90%(以萘满酮计),总收率从文献[5]方法的25.6%提高至 80.6%。
改进方法未见文献报道。
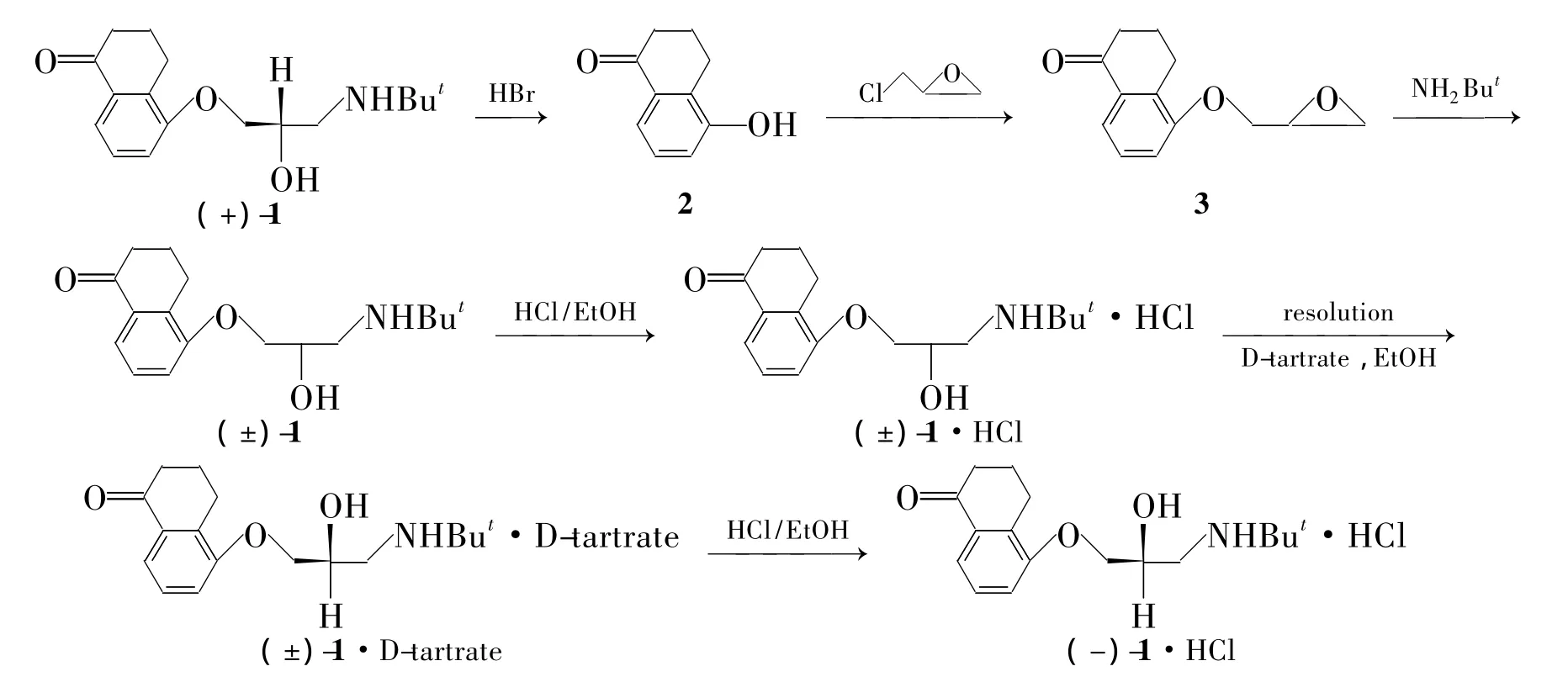
Scheme 1
1 实验部分
1.1 仪器与试剂
XT-4型显微熔点仪(温度未校正);Brucker 400型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Thermo Nicolet NeXUS 470 FT-IR型傅立叶变换红外光谱仪(KBr压片)。
盐酸左布诺洛尔拆分废料[主要成分为(+)-1],武汉波谷医药有限公司;其余所用试剂和溶剂均为分析纯。
1.2 合成
(1)2的合成
在反应瓶中加入盐酸左布诺洛尔拆分废料25 g和10%NaOH溶液30 mL,搅拌混匀。用三氯甲烷(3×50 mL)萃取,合并萃取液,浓缩至干得橘黄色油状物。加入48%HBr 30 mL,于90℃酸解2.5 h。冷却至室温,用10%NaOH溶液调至pH 12;加水15 mL,用乙酸乙酯(3×20 mL)萃取,水相用10%HCl中和至中性后用乙酸乙酯(3×20 mL)萃取,合并有机相,依次用水(2×100 mL)、饱和食盐水洗涤,无水硫酸镁干燥,减压浓缩至干得黄白色粗品12.53 g。
在反应瓶中加入粗品和95%乙醇60 mL,于30℃搅拌使其溶解;加入活性炭2.0 g,于80℃(回流)反应30 min。趁热过滤,滤液浓缩至干得类白色晶体,用95%乙醇重结晶两次得白色针状晶体2 11.3 g,m.p.210 ℃ ~212 ℃(210.0 ℃ ~211.5 ℃[6])。
(2)5-(2,3-环氧丙氧基)-α-萘满酮(3)的合成
在圆底烧瓶中加入 2 10 g(61.7 mmol),NaOH 3 g(75 mmol)和水13 mL,搅拌下加入95%乙醇100 mL,于20℃搅拌使其溶解;于25℃以下缓慢滴加环氧氯丙烷34.37 g(375.2 mmol),滴毕,反应24 h(TLC检测)。过滤,滤液脱色,减压浓缩,残余物加适量乙酸乙酯溶解,水洗后用无水硫酸镁干燥,减压蒸除溶剂得橘黄色油状物3(粗品,无须分离直接用于下一步反应){3经硅胶柱色谱[洗脱剂:V(石油醚)∶V(乙酸乙酯)=7∶3]纯化得分析样品。1H NMR(CDCl3)δ:7.66(d,J=7.1 Hz,1H,ArH),7.25(t,J=12.4 Hz,1H,ArH),7.01(d,J=8.0 Hz,1H,ArH),3.96 ~ 4.32(m,2H,ArOCH2),3.39(s,1H,CH),2.94(d,J=4.4 Hz,2H,CH2),2.93 ~2.79(m,2H,CH2),2.63(t,J=11.5 Hz,2H,CH2),2.12(d,J=4.4 Hz,2H,CH2)}。
(3)(±)-1·HCl的合成
在粗品3中加入无水乙醇70 mL,搅拌均匀;加入叔丁胺21 g(280 mmol),回流反应30 min。减压蒸除溶剂得橘黄色黏稠液体(±)-1 18.2 g,用无水乙醇75 mL溶解。冷却至10℃以下,通入干燥的氯化氢气体(由浓硫酸滴入NaCl中产生,经浓硫酸干燥)直至有大量白色固体生成。过滤,滤饼干燥得白色固体(±)-1·HCl 16.2 g,收率83.68%[用95%乙醇重结晶得分析样品(±)-1·HCl,m.p.222 ℃ ~224 ℃ (223 ℃ ~225℃[7]);IR ν:3 370(O - H),2 988(N - H),2 801(C -H),1 672(C=O),1 589,1 472,1 381(Ar-H),1 268(C -N)cm-1。
(4)(-)-1·HCl的合成
在圆底烧瓶中依次加入粗品(±)-1·HCl 16.20 g(51.6 mmol),氯仿 50 mL 和 1.25 mol·L-1NaOH溶液50 mL,搅拌下于25℃反应2 h。分液,水层用氯仿萃取,合并有机层,用无水硫酸镁干燥,减压蒸除溶剂得橘黄色黏稠液体。加入95%乙醇 32 mL和右旋酒石酸 6.40 g(42.8 mmol),回流反应30 min。冷却结晶,过滤,滤饼干燥得白色晶体(-)-1粗品13.26 g,用1%右旋酒石酸/乙醇溶液重结晶3次得白色晶体(-)-1 9.33 g,m.p.122 ℃ ~124 ℃,[α]20D-1.92°[125℃ ~135 ℃, - (1.93 ± 0.1)°[7]];IR ν:3 465(O-H),3 357(N-H),2 851(C-H),1 737(C=O),1 681(C=O),1 598~1 468(Ar-H),1 272(C -N)cm-1。
在圆底烧瓶中加入(-)-1 9.33 g(22.57 mmol),1.25 mol·L-1NaOH 溶液 45 mL 和氯仿45 mL,搅拌下于25℃反应2 h。分液,水层用氯仿(2×30 mL)萃取,合并有机层,用无水硫酸镁干燥,减压蒸除溶剂得橘黄色黏稠液体。加入95%乙醇40 mL,在浓硫酸干燥条件下通入氯化氢气体,在10℃下成盐得(-)-1·HCl粗品,用95%乙醇重结晶两次得白色晶体(-)-1·HCl 2.65 g,拆分率 32.7%(以消旋体计),总收率25.6%,m.p.208 ℃ ~210 ℃,[α]20D- 19.8°[209 ℃ ~210 ℃,-(19.6 ±0.7)°[7]];1H NMR δ:9.20(s,1H,HCl),8.68(s,1H,NH),7.49(d,J=7.7 Hz,1H,ArH),7.33(t,J=15.8 Hz,1H,ArH),7.24(d,J=8.0 Hz,1H,ArH),5.96(s,1H,OH),4.31(s,1H,CH),4.08 ~4.06(m,2H,ArOCH2),3.17 ~ 2.97(m,2H,CH2),2.89(m,2H,CH2),2.59(m,2H,CH2),2.06(m,2H,CH2),1.33(s,9H,CH3)。
2 结果与讨论
2.1 工艺优化
盐酸左布诺洛尔的酸解工艺是提高产品收率的最重要反应步骤,为此,本文以反应温度(A),反应时间(B)和HBr酸强度(C)为因素,采用L9(33)正交表进行试验,考察各因素对合成2的影响,结果见表1。由表1可知,各因素对酸解收率影响顺序为:C>A>B,其中HBr酸的强度影响最为显著。优化工艺条件为A2B2C3,即:反应温度90℃,反应时间为2.5 h,HBr酸强度为48%。在最佳反应条件下酸解,收率达90.0%。
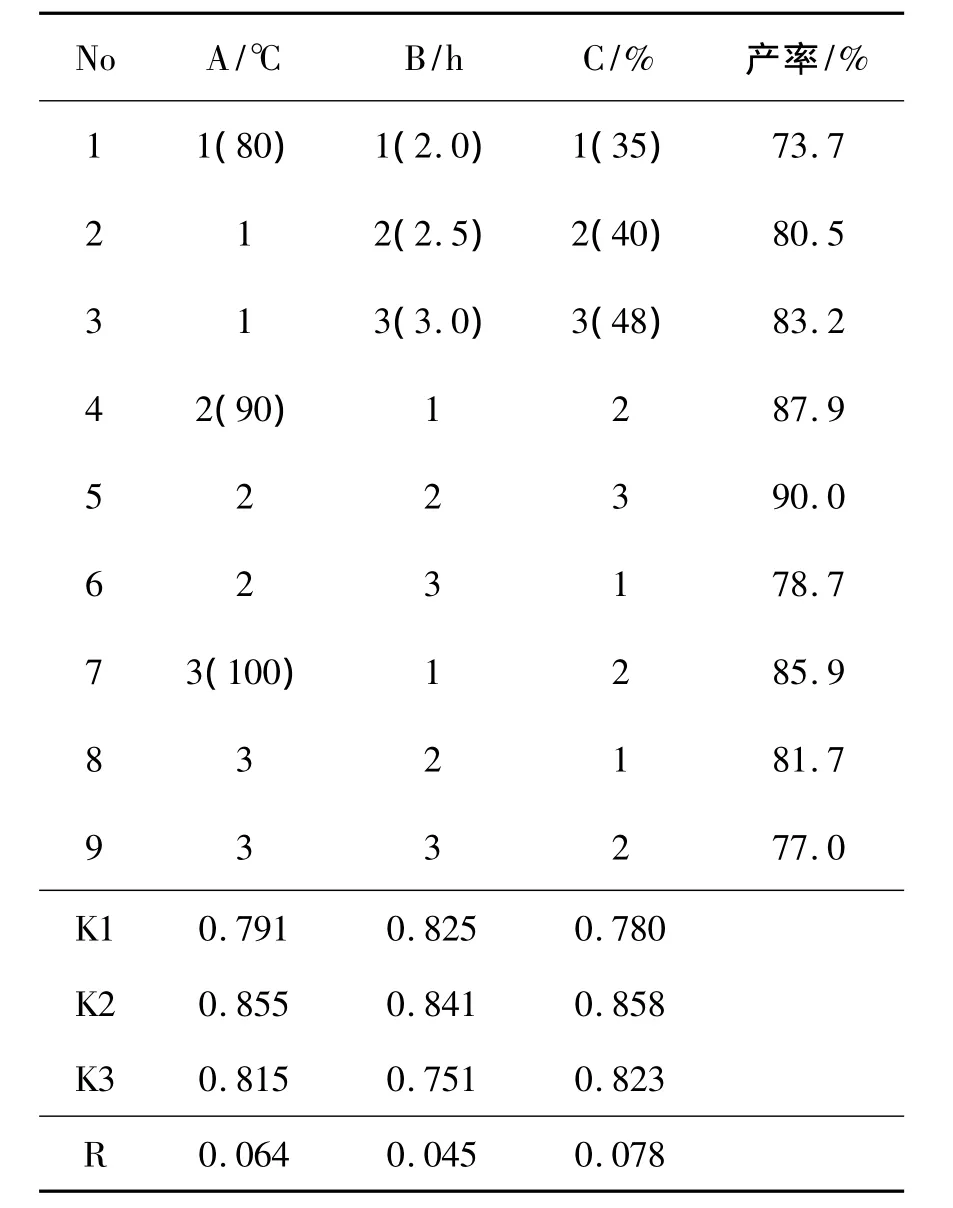
表1 合成2的正交试验设计与结果*Table 1 Design and result of orthogonal experiment for synthesizing 2
3 结论
在目标产物的手性拆分时,由于手性的拆分效率很低,无药理活性的(+)-1难以直接转化为(-)-1,致使产品的总收率较低,导致2的利用率不高,同时增加废液回收成本。
本文用回收拆分废料转变成价格昂贵原料2,回收率达 90%,使(-)-1·HCl的收率从25.6%[5]提高至 80.6%,大大地降低了反应成本,且反应条件温和、后处理操作简单、易于放大,具有良好的工业前景。
[1]Dong Y,Ishikawah,Wu Y Z,et al.Vasodilatory mechanism of levobunololon vascular smooth muscle cells[J].Exp Eye Res,2007,84(6):1039 -1046.
[2]Herm Ann R.The use of substances for the treatment of loss of eyesight in humans with glaucoma and other degenerative eye diseases[P].EP 2 044 951,2007.
[3]Charles F Schwender,Sheldon Faber,Carol Blaum,et al.Derivatives of 3,4-dihydro-1(2H)-naphthalenone as β-adrenergic blocking agent.Bunolo related analogs[J].J Med Chem,1970,13(4):684 -688.
[4]Alberto Stampa Diez Del Corral,Pelayo Camps Garcia,Carmen Arnlot Aguilar.Enantioselective process for the preparation of levobunolol[P].US 5 426 227,1995.
[5]吕露,赵滟萍,丁聪,等.盐酸左布诺洛尔的合成研究[J].中国药物化学杂志,2010,20(1):32 -35.
[6]Munemro M.Synthesis of phenanthrene derivatives.Ⅳ.Reduction of 3-(1-piperidyl-methyl)-4-keto-7-hydroxy-1,2,3,4-tetrahydrophenanthrene by aromylalcohol and sodium[J].J Pharm Soc Jpn,1941,61:498 -502.
[7]Shavek J,M Endham J,Schw Ender C F,et al.DL-5-[3-(tert-butylamino)-2-hydroxypropoxy]-3,4-dihydro-1(2H)naphthalenone[P].US 3 649 691,1972.
