一种新型氧氮杂大环化合物的光合成*
2013-03-26王卫东史正春下茂徹朗
王卫东,史正春,下茂 徹朗
(1.吉林化工学院化学与材料工程学院,吉林吉林 132022;2.沈阳化工研究院测试评估中心,辽宁沈阳 110071;3.鹿儿岛大学工学部日本鹿儿岛 890-0065)
大环化合物一般均具有各种生物活性,特别是抗肿瘤活性[1,2]。近年来,大环化学得到了迅速地发展,合成了各种大环化合物并对其应用进行了研究[3~7]。光化学接近于绿色化学,在合成化学中,特别是在天然产物、医药、香料等精细有机合成中具有重要的意义[8]。已有少数文献报道利用光化学反应合成特定复杂结构的大环化合物[9~11]。
本文以乙腈为溶剂,二苯甲酮为光敏化剂,6,6'-二甲基-4,4'-(三亚甲二氧基)-二-2-吡喃酮(1)与N,N'-亚甲基双丙烯酰胺(2)经光二重[2+2]环加成反应,位置选择性地合成了一种新型氧氮杂大环化合物3(收率37%),同时得到2的分子内[2+2]加成产物 4[12](Scheme 1),其结构经1H NMR,13C NMR,FT-IR和HR-MS表征。
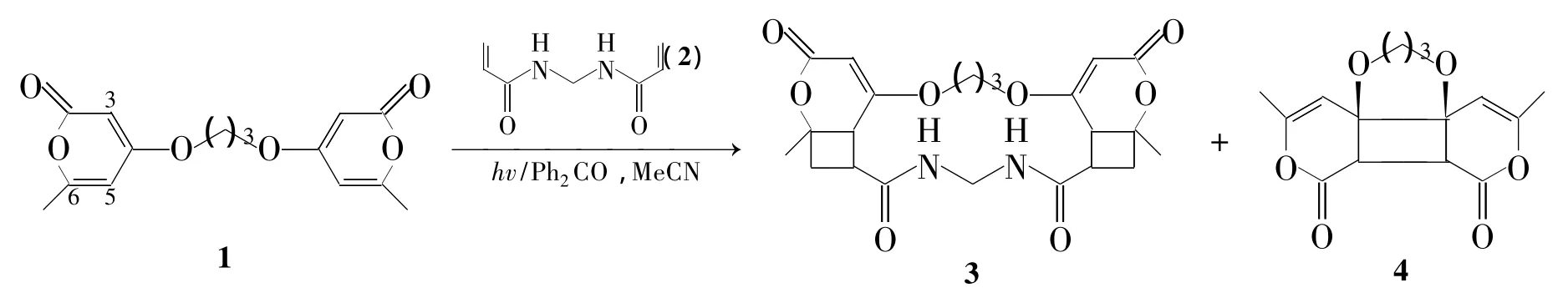
Scheme 1
1 实验部分
1.1 仪器与试剂
日本英光社光化学反应转动装置;FT-3 UV滤光管(>320 nm);Yamagimoto型显微熔点仪(温度未校正);JNM-GSX400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);IR-Report-100型红外分光光度计(KBr压片);JEOLJMS-HX110A型质谱仪。
[12]方法制备;其余所用试剂和溶剂均为化学纯,其中乙腈使用前经无水处理。
1.2 合成
在50 mL Pyrex试管中依次加入1 930 mg(3.20 mmol),2 690 mg(4.48 mmol)和二苯甲酮290 mg(1.60 mmol)的乙腈(160 mL)溶液,N2气保护下于室温用300 W高压水银灯透过320 nm UV滤光管照射18 h。反应液经硅胶柱层析[洗脱剂:V(乙酸乙酯)∶V(正己烷)=1∶1]分离得白色晶体3 280 mg,收率20%,m.p.>300℃;1H NMR δ:6.78(t,J=6.4 Hz,2H),5.19(s,2H),4.60(t,J=6.4 Hz,2H),3.97(m,4H),3.24(s,2H),3.00(q,J=8.4 Hz,2H),2.56(dd,J=8.4 Hz,12.4 Hz,2H),2.47(dd,J=8.4 Hz,12.4 Hz,2H),2.14(t,J=6.0 Hz,2H),1.53(s,6H);13C NMR δ:172.8,171.5,166.2,90.8,80.0,66.0,44.5,42.6,42.5,37.6,28.5,26.1;FT-IR ν:1 705,1 681 cm-1;HR-MSm/z:Calcd for C22H27N2O8{[M+H]+}477.176 7,found 477.176 5。
2 结果与讨论
2.1 表征
HR-MS分析结果表明,3为1/1加成体。3的FT-IR分析表明,1 705 cm-1处有2-吡喃酮环上较强的C=O吸收峰,1 681 cm-1处出现酰亚胺上较强的C=O吸收峰。1H NMR分析结果显示,[2+2]加成物(4)的烯基氢的化学位移为5.19,这进一步证实了3的结构。
2.2 反应条件优化
(1)光照时间
3的收率不高(20%),这可能主要由于受到1 的3,4-和3,4'-位上分子内[2+2]环加成副反应4(收率25%)影响。本文探讨了光照射时间对3收率的影响,结果见图1。如图1可见,随着光照时间的延长,3的1H NMR计算收率(以吡嗪为内标)逐渐增大,光照时间大于6 h,3的收率趋于稳定(约35%);光照18 h后,收率达最大(37%),此时1的转化率接近100%。从图1中亦可看出,该反应过程中,1分子内[2+2]环加成优于1和2的分子间二重[2+2]环加成反应进行,这直接阻碍了3的生成。最佳的光反应时间为6 h~10 h。
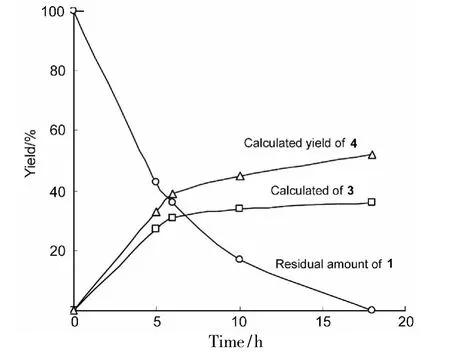
图1 光照时间对反应的影响*Figure 1 Effect of photoperiod on reaction*反应条件同1.2
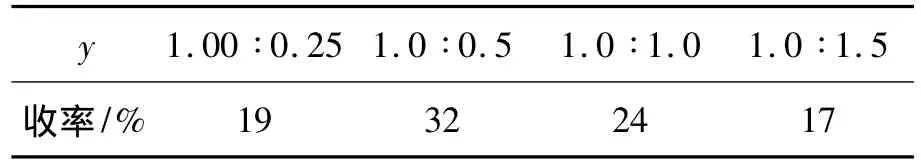
表1 二苯甲酮用量对反应的影响*Table 1 Effect of benzophenone amount on reaction
(2)二苯甲酮用量
光照时间6 h,其余反应条件同1.2,考察二苯甲酮用量y[n(1)∶n(二苯酮)]对反应的影响,结果见表1。从表1 可见,最佳的y=1.0 ∶0.5。
综上所述,6,6'-二甲基-4,4'-(三亚甲二氧基)-二-2-吡喃酮(1)与N,N'-亚甲基双丙烯酰胺光二重[2+2]环加成反应的最佳反应条件为:1 3.2 mmol,n(1)∶n(二苯甲酮)=1.0 ∶1.5,于300 W光照18 h,3收率37%。
参考文献
[1]Adriana B da R,Rafael M L,Gillberto S.Natural prouducts in anticancer therapy[J].Cancer,2011,1:364-369.
[2]Tadeuse F M,Doralyn S D,Sarah L L,et al.Drug development from marine natural products[J].Drug Discovery,2009,8:69 -85.
[3]Rodrigo A Rodriguez,PAN Poshen,PAN Chungmao,et al.Synthesis of second-generation sansalvamide a derivatives.Novel templates as potential antitumor agents[J].J Org Chem,2007,72(6):1980 -2002.
[4]YING Yongcheng,LIU Yanxia,Byeon Seong Rim,et al.Synthesis and activity of largazole analogues with linker and macrocycle modification[J].Org Lett,2008,10(18):4021 -4024.
[5]梁书锋,花成文,杨小宝,等.氮杂类聚合大环化合物的合成[J].有机化学,2008,28(11):1986 -1988.
[6]陈凯,李鸿波,刘铠,等.微波辅助二苯并-18-冠-6的合成[J].应用化学,2011,28(12):1453 -1455.
[7]谢政,张炜,黄鹏程.芳炔类共轭大环化合物[J].有机化学,2002,22(8):543 -554.
[8]张宝文,程学新,刘勇勇,等.有机合成光化学及其研究现状[J].感光科学与光化学,2001,19(2):139-155.
[9]Shimo T,Kawamura M,Fukushima E,et al.One-pot synthesis of macrocyclic dioxatetralactones from the sequential inter-and intramolecular[2+2]photocycloaddition reactions[J].Heterocycles,2003,60:23 -27.
[10]Ibrahim Y A,John E.Efficient synthesis of 18-40 membered macrocyclic polyoxadiamides and polyoxatetraamides via ring closing metathesis[J].Tetrahedron,2006,62:1001 -1014.
[11]Cibin F R,Doddi G,Mencarelli P.Synthesis of a ditopic cyclophane based on the tyclobutane ring by chalcone photocycloaddition[J].Tetrahedron,2003,62:3455-3459.
[12]Shimo T,Ueda S,Suishu T,et al.Intramolecular photocycloadditions of 6,6'-dimethyl-4,4'-polymethylenedioxy-di-2-pyrones[J].JHeterocycChem,1995,32:727-730.
