不同剂量氟中毒大鼠拔除左侧上颌磨牙后剩余牙槽骨中OPG/OPGL的表达
2013-03-26刘艳春李晓红中铁二十局中心医院口腔科咸阳7000西安交通大学口腔医院修复科西安交通大学口腔医院种植中心共同第一作者mailcc700rencom
刘艳春,陈 诚,逯 宜,李晓红(中铁二十局中心医院口腔科,咸阳 7000;西安交通大学口腔医院修复科;西安交通大学口腔医院种植中心;共同第一作者,E-mail:cc700_ren@6.com)
破骨细胞的骨吸收和成骨细胞的骨形成作用的动态平衡是维持骨骼完整性必须具备的条件。许多激素以及生长因子、细胞因子参与这个平衡的调控,其单独或者共同作用于成骨细胞和破骨细胞,均衡两类细胞的活性,保持骨量的平衡。氟中毒在骨骼中的沉积破坏了这种平衡,影响了骨组织的矿化过程[1]。骨保护素蛋白(osteoprotegerin,OPG)为肿瘤坏死因子受体家族成员,是骨保护素配体(osteoprotegerin ligand,OPGL)的诱骗受体,是影响骨转换的重要的细胞因子,具有抑制破骨细胞分化和活性的生理功能[2-4]。本实验通过检测氟中毒大鼠剩余牙槽骨的OPG及OPGL含量,观察氟中毒对大鼠剩余牙槽骨骨改建的影响。
1 材料与方法
1.1 主要试剂和仪器
实验用兔抗大鼠一抗OPG/OPGL为西安交通大学骨病研究所提供,购自博士德生物工程有限公司。
1.2 动物模型建立
45日龄SPF级雄性大鼠60只(西安交通大学医学院实验动物中心提供),体重在150 g左右,随机分为四组:对照组、低剂量氟中毒组、中剂量氟中毒组和高剂量氟中毒组,每组15只,分别给予蒸馏水、50 mg/L F-溶液、100 mg/L F-溶液和 200 mg/L F-溶液[3]饮用。食物采用常规鼠粮(氟含量小于3 mg/kg),所有动物于同等条件下分笼饲养,自由进食,记录每组饮用氟水及蒸馏水的量[5]。6周后,每组随机抽取5只大鼠,全麻,腹主动脉采血,取左侧股骨,固定保存,采用全自动生化分析仪测定血清ALP及标准加入法测定骨氟含量,各组大鼠氟中毒模型建立成功后,全麻下拔除全部左侧上颌磨牙,术后给予蔗糖水,1 d后恢复正常饮食。
1.3 标本制备
上颌左侧磨牙拔除1月后,各组随机抽取5只,全麻,取左侧上颌剩余牙槽骨,将所得的上颌剩余牙槽骨固定于多聚甲醛溶液,-4℃保存;上颌磨牙拔除2月后,各组随机抽取5只,以同前的方法取材、固定、保存。将所得所有标本共同标记后,EDTA脱钙,常规石蜡包埋,切片。
1.4 OPG/OPGL免疫组化染色
切片常规脱蜡,30%H2O2室温下反应5-10 min灭活内源性酶,热抗原修复10 min,室温孵育40 min;滴加OPG一抗,湿盒4℃孵育过夜。染色中设阴性对照片,PBS代替一抗;室温放置30 min,37℃复温1 h;滴加生物素化山羊抗兔IgG(二抗),湿盒37℃孵育40 min;滴加即用型SABC,室温孵育40 min,DAB显色3 min,Harris氏苏木素轻度复染,脱水、透明、封片。OPGL步骤与OPG类似,均严格按照产品说明书执行。
1.5 免疫组化染色结果的判定
每张切片在LEICA光学显微镜下观察染色情况,染色阳性部位由于反应沉积物而呈棕黄色。每个标本的骨界面平均取5个视野,转至Motic Med 6.0数码医学图像分析系统,进行数码拍照,并选定背景色与阳性染色为不同标记;单击测量目标按钮,测量得出平均灰度值,每张切片所测得的5个视野的均值为该切片的值,以平均灰度值代表蛋白的表达水平。
1.6 统计学分析
应用SPSS16.0软件对数据进行分析。两组间计量资料的比较采用LSD-t检验,以中毒剂量和拔牙后时间作为双因素,采用双因素方差分析,检验水准为0.05。
2 结果
2.1 建模成功指标
建模6周时低、中、高剂量氟中毒组骨氟含量较对照组显著升高(P<0.05),其差异具有统计学意义。各中毒剂量氟中毒大鼠血清碱性磷酸酶活性增高,但与对照组相比,其差异不具有统计学意义(P >0.05,见表1)。

图1 骨保护素染色的结果Figure 1 OPG expression in residual alveolar bone in four groups by immunochemistry
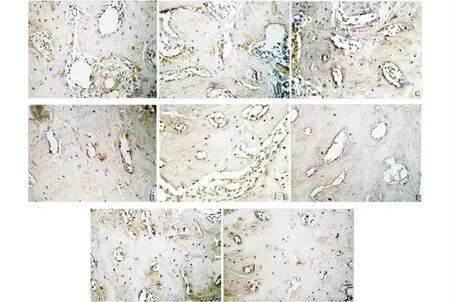
图2 骨保护素配体染色的结果Figure 2 OPGL expression in residual alveolar bone in four groups by immunochemistry
表1 各组血清碱性磷酸酶浓度、骨氟含量(±s)Table 1 The concentrations of serum ALP and bone fluorine content in four groups(±s)
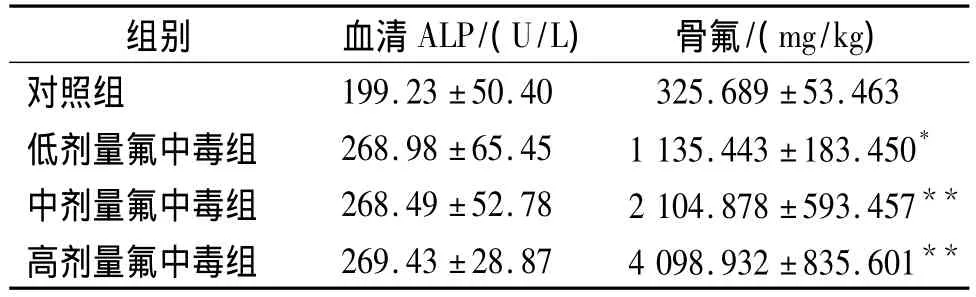
表1 各组血清碱性磷酸酶浓度、骨氟含量(±s)Table 1 The concentrations of serum ALP and bone fluorine content in four groups(±s)
与对照组比较,*P <0.05,**P<0.01
组别 血清ALP/(U/L) 骨氟/(mg/kg)对照组199.23±50.40 325.689±53.463低剂量氟中毒组 268.98±65.45 1 135.443±183.450*中剂量氟中毒组 268.49±52.78 2 104.878±593.457**高剂量氟中毒组 269.43±28.87 4 098.932±835.601**
2.2 OPG在氟中毒大鼠中的表达情况
OPG的阳性表达主要位于骨小梁周围成骨细胞的胞质和胞膜,其胞质和胞核都呈弥漫成片的棕黄色阳性染色。OPG/OPGL的阳性表达随着氟中毒浓度的增高而加强(图1,见第752页)。
与拔牙1月后相比,拔牙2月后时各剂量组OPG表达均降低,存在统计学差异。低剂量氟中毒组和中剂量氟中毒组与对照组比较,OPG表达少许增加,但无统计学意义。高剂量氟中毒组与对照组相比OPG表达减少,存在统计学差异(P<0.05,见表2)。

表2 各组大鼠不同时间剩余牙槽骨中OPG的表达Table 2 The expression of OPG in residual alveolar bone in four groups at different time
2.3 OPGL在氟中毒中的表达情况
与OPG相比,各组OPGL灰度值均较高,且随着中毒剂量的增加,表达显著。OPGL表达部位和OPG相似,主要位于骨小梁周围成骨细胞的胞质,呈棕黄色弥漫成片,骨细胞胞质和胞膜中亦可见表达,但染色较淡。各组氟中毒大鼠拔牙1月和2月后剩余牙槽骨中的OPGL表达相似,随着时间的推移,表达降低(图2,见第753页)。
与拔牙1月后相比,拔牙2月后时各组OPGL表达均降低,其中高剂量氟中毒组减低显著,存在统计学差异。拔牙2月后,与对照组相比,各中毒组的OPGL表达均增加,与对照组相比存在统计学差异(P <0.05,见表3)。

表3 不同时间各组大鼠剩余牙槽骨中OPGL免疫组化灰度值比较Table 3 The expression of OPGL in residual alveolar bone in four groups at different time
3 讨论
牙槽骨不仅是天然牙行使正常功能的生理基础,也是义齿修复的生理基础,尤其对于全口义齿和种植义齿,牙槽骨的质和量在修复中起到举足轻重的作用。牙齿缺失后,剩余牙槽骨会发生一种慢性的、进行性的、不可逆的、累积性的减少,我们称其为剩余牙槽骨吸收(residual ridge resorption,RRR)。剩余牙槽骨在拔牙后6个月到2年内牙槽骨吸收迅速,以后逐渐减少,但维持终身。剩余牙槽骨吸收是很普遍的临床问题,它给口腔修复带来了一系列的问题,包括义齿固位不良,种植骨量不足,软组织溃疡以及义齿更换频繁等。
研究表明,多种因素参与调节剩余牙槽骨的改建,其与全身代谢密切相关[6]。人体摄入的自然界中的氟元素能与骨组织的羟基磷灰石作用形成较为稳定的氟磷灰石结晶,低剂量时具有抑制骨吸收、促进骨形成的作用,而过量氟摄入则会引起机体骨组织破坏。研究显示高氟区人群牙周组织破坏、牙齿丧失均高于低氟区[7],作者推测处于高氟区的个体,其剩余牙槽骨的骨质可能不同于正常地区,其骨质到底发生了什么样的变化呢?本实验采用动物实验的方法来观察其改变。
骨保护素蛋白(OPG)为肿瘤坏死因子受体家族成员,是影响骨转换的重要的细胞因子,具有抑制破骨细胞分化和活性的生理功能,它广泛表达于多种组织和细胞系,在肺、心脏、脊髓和骨骼中表达较多。骨保护素(OPG)可以抑制骨吸收的观点已被广泛接受,很多学者研究了细胞因子和微量元素等对骨保护素对骨吸收的抑制的调节,氟可能引起大鼠血清OPG上升,抑制破骨细胞生成,破坏骨代谢平衡。以往的研究发现氟可能是通过诱导成骨细胞表达OPG增加,抑制破骨细胞的生成和分化,使骨吸收活动减弱,最终使骨组织病理形态向硬化型方向发展[8]。在本实验中,各组氟中毒大鼠拔牙后上颌剩余牙槽骨中,OPG主要表达于成骨细胞和小量骨细胞中,胞质内棕黄色,其中低剂量氟中毒组和中剂量氟中毒组与对照组比较,OPG表达增加,这与张莹等的研究一致。高剂量氟中毒组与对照组相比表达OPG减少,存在统计学差异,这可能是由于高剂量氟中毒直接刺激颌骨造成骨吸收,成骨细胞数量减少所致。
可见,虽然氟可以刺激成骨细胞增加,但是高浓度氟有可能导致骨细胞直接死亡。Fernandes等[8]研究表明,低氟可以刺激成骨细胞增多,而在过量氟的环境下,易发生凋亡现象,提示成骨细胞减少可能源于高氟导致的成骨细胞凋亡,使得镜下骨细胞和成骨细胞相对减少,表达降低。与拔牙1月后相比,低、中、高剂量氟中毒组拔牙2月后OPGL灰度值均降低,并且存在统计学差异,提示随着时间的推移,OPGL表达降低,对破骨细胞的抑制减弱,可能加速了剩余牙槽骨的吸收。
OPGL是肿瘤坏死因子配体家族成员,OPG是其的诱骗受体,位于成骨细胞谱系细胞表面的OPGL可以增强破骨细胞受体间的信号传导。表达于成骨细胞胞膜上的OPGL结合于破骨细胞前体上的受体RANK,将信号传导到NF-κB,或活化c-JUN末端激酶,调节基因表达,诱导破骨细胞的形成,增加骨吸收。OPGL mRNA由成骨细胞和骨髓基质细胞分泌,在骨组织中主要表达于成骨细胞系细胞,骨髓基质细胞,但OPG可竞争性地抑制OPGL与破骨细胞受体间的信号传导,可调节OPGL来改变骨转换。研究发现氟可能通过上调OPGL和M-CSF的表达来提高破骨细胞骨吸收的活性。范伟等[9]在燃煤型氟中毒大鼠中观察到,低氟组、低氟偏食组大鼠干骺端OPGL表达增高,与对照组比较差异有统计学意义(P<0.05)。Sun等[2]研究表明,在氟的作用下,成骨细胞OPGL mRNA的表达呈上升趋势,但没有统计学差异。本实验中,与对照组相比,低、中、高剂量氟中毒组的OPGL表达均增加,存在统计学差异(P<0.05),提示随着氟中毒剂量的升高,剩余牙槽骨吸收加快。
人类剩余牙槽骨随着时间在进行不间断的吸收,研究表明在拔除牙体3-6个月后,剩余牙槽骨吸收趋于平稳。大鼠与人类剩余牙槽骨的病理改变极为相似,有学者[9-11]已经证实氟可通过刺激OPG来抑制骨吸收;可通过刺激OPGL来增强骨吸收。本实验将OPG及OPGL在氟中毒大鼠剩余牙槽骨吸收的表达强度作为衡量剩余牙槽骨吸收的表征,对不同浓度氟中毒大鼠剩余牙槽骨吸收的程度做出评价,与拔牙1月后相比,低、中、高剂量氟中毒组拔牙2月后OPGL灰度值均降低,其中高剂量氟中毒组与1月相比存在统计学差异。提示随着时间的推移,OPGL表达降低,尤其是高剂量氟中毒组,这可能与成骨细胞系细胞数目减少有关。但是相比较对照组而言,OPGL的表达都是增加的,提示氟化物通过刺激OPGL表达增加来加速牙槽骨的吸收,即氟浓度越高,骨质吸收越快。
综上所述,长期氟中毒可导致大鼠剩余牙槽骨骨吸收加重,提示对于处于高氟地区的人群,可能会因为摄入氟化物过多而导致剩余牙槽骨吸收加速,并且存在骨实质受损,可能对后续的种植修复形成潜在的影响。
[1] De carvalho JG,Cestari TM,De oliveira RC,et al.Fluoride effects on ectopic bone formation in young and old rats[J].Methods Find Exp Clin Pharmacol,2008,30:287-294.
[2] 孙秀娟,于燕妮,肖宇明.丹蓝仙硼疗氟胶囊对氟中毒大鼠骨保护蛋白配体和巨噬细胞集落刺激因子基因及其蛋白表达水平的影响[J].中华病理学杂志,2010,39(10):695-700.
[3] Tanaka H,Mine T,Ogasa H,et al.Expression of RANKL/OPG during bone remodeling in vivo[J].Biochem Biophys Res Commun,2011,411:690-694.
[4] 陈柏龄,谢登辉,王宗伟,等.淫羊藿总黄酮对去卵巢大鼠骨组织 OPG、OPGL mRNA 表达的影响[J].中国骨伤,2009,22(4):271-273.
[5] Dote T,AdachiK,Yamadori E,et al.Abnormalities in cadmium fluoride kinetics in serum,bile,and urine after single intravenous administration of toxic doses to rats[J].J Occup Health,2008,50:339-347.
[6] Zmyslowska E,Ledzion S,Jedrzjewski K.Factors affecting mandibular residual ridge resorption in edentulous patients:a preliminary report[J].Folia Morphol(Warsz),2007,66:346-352.
[7] Chien CH,Otsuki S,Chowdhury SA,et al.Enhancement of cytotoxic activity of sodium fluoride against human periodontal ligament fibroblasts by water pressure[J].In vivo,2006,20:849-856.
[8] Fernandes MD,Yanai MM,Martnis GM,et al.Effects of fluoride in bone repair:an evaluation of RANKL,OPG and TRAP expression[J].Odontology,2012:Epub ahead of print.
[9] 范伟,张华,喻茂娟,等.骨保护素配体在燃煤型氟中毒大鼠骨组织中的表达[J].中国地方病学杂志,2006,25(5):503-506.
[10] 华坤,计国义,李广生,等.氟化物对成骨细胞OPGL mRNA和M-CSF mRNA表达的影响[J].中国地方病学杂志,2003,22(2):115-118.
[11] 谢春,张华,喻茂娟,等.燃煤型氟中毒大鼠血清骨保护素的变化[J].中国地方病学杂志,2005,24(4):378-381.
