靶向IGF1R基因的shRNA对人肺腺癌细胞裸鼠移植瘤生长的抑制作用
2013-03-26杜永亮贾晓民李海泉杨珊珊徐永红徐州医学院第二附属医院呼吸科徐州221006
陈 丽,杜永亮,贾晓民,李海泉,赵 杰,杨珊珊,徐永红(徐州医学院第二附属医院呼吸科,徐州 221006)
人胰岛素生长因子受体1(insulin-like growth factor receptor-1,IGF1R)在多种肿瘤组织中过度表达,与肿瘤增殖、转移及凋亡关系密切[1];血管内皮生长因子(vascular endothelial growth factor,VEGF)是刺激肿瘤血管生成重要的促生长因子,受缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)水平的调节[2]。目前研究表明,抑制IGF1R表达能显著降低VEGF水平,减少肿瘤血管生成,抑制肿瘤增殖[3]。本研究从体内实验的角度,以慢病毒为载体的RNA干扰技术沉默人肺腺癌A549细胞IGF1R表达,观察其对裸鼠移植瘤生长抑制及 HIF-1α、VEGF表达的影响。
1 材料与方法
1.1 材料
1.1.1 慢病毒、细胞株及靶序列 慢病毒载体系统(pGC-LV、pHelper 1.0 、pHelper 2.0)购自上海吉凯基因技术有限公司;IGF1R shRNA靶序列5’-CAACGGCCTATTGTCAGGT-3’,阴性对照序列:5’-TTCTCCGAACGTGTCACGT-3’,由本课题前期验证[4];人肺腺癌A549细胞株购自中科院上海细胞研究所,保存于徐州医学院肿瘤学重点实验室。
1.1.2 实验动物 3-5周龄的BALB/c雄性裸鼠18只,体重16-18 g,购自上海斯莱克实验动物有限责任公司(动物合格证号 SCXK(沪)2012-0002);饲养于徐州医学院实验动物中心SPF级环境,饲料及水均自由摄入且均经过严格的灭菌处理。
1.1.3 主要试剂 DMEM及胎牛血清均购自美国Gibco公司;HIF-1α、VEGF PCR引物由上海生工设计并合成;荧光实时定量PCR试剂盒购自北京天根公司;兔抗人IGF1R单克隆抗体购自Santa公司;鼠抗人CD34单克隆抗体及免疫组化试剂盒(S-P法)购自北京中杉金桥生物公司。
1.2 方法
1.2.1 慢病毒感染A549细胞 取对数生长期A549细胞,调整细胞密度2.5×104个/ml,取2 ml分别接种于6孔板,培养条件:含10%胎牛血清的DMEM培养基,含5%CO2、37℃及饱和湿度的培养箱。用台盼蓝染色法计算细胞成活密度约30%-40%时(细胞成活率/%=4大格活细胞数/4大格总细胞数×100%),加入以感染复数MOI为20病毒量进行感染效果最佳[4]。24 h后更换原培养液继续培养,72 h后荧光显微镜下观察绿色荧光蛋白(GFP)表达情况及细胞状况,GFP基因由慢病毒骨架质粒所携带,病毒只有感染目的细胞后,才可能利用细胞内成分合成GFP蛋白,即细胞如表达绿色荧光蛋白提示已经被重组慢病毒感染。计算感染效率,取感染效率大于90%细胞用于裸鼠成瘤实验。
1.2.2 移植瘤裸鼠模型的建立 将18只裸鼠随机分为三组:空白对照组、阴性对照组及实验组。分别取A549细胞及相应的病毒感染后的A549细胞,胰酶消化后,离心去上清液,PBS洗涤、重悬细胞,调整细胞密度为2.0×107/ml;分别取上述制备的细胞悬液0.1 ml接种于裸鼠右腋皮下,观察肿瘤形成情况,瘤体直径至0.3 cm时为移植成瘤;每3 d用卡尺测量瘤体长径(a)及短径(b),依据公式VT=1/2ab2计算肿瘤体积,并绘制肿瘤生长曲线,依据公式P=(1-实验组瘤体体积/空白对照组瘤体体积)×100%计算体积抑瘤率;28 d后颈椎脱臼法处死荷瘤裸鼠,分离瘤组织,称重,依据公式P=(1-实验组瘤重/空白对照组瘤重)×100%计算质量抑瘤率;肿瘤组织部分保存于液氮,部分用10%中性甲醛溶液固定后行HE染色及免疫组化检测。
1.2.3 Western blot法检测移植瘤组织IGF1R蛋白表达 取移植瘤组织80 mg,加裂解缓冲液后研磨匀浆,4℃ 12 000×g离心,取上清液,BCA法测定总蛋白浓度,取80 μg样品蛋白行10%SDS-聚丙烯酰胺凝胶电泳,半干转法将蛋白转至NC(硝酸纤维素)膜上,5%脱脂奶粉液封闭2 h,兔抗人IGF1R一抗(1∶300稀释)孵育4℃过夜,二抗室温孵育2 h,BCIP/NBT(四唑氮蓝/5-溴4-氯-3吲哚,磷酸盐)碱性磷酸酯酶显色试剂盒显色并拍照。应用Image-J软件分析图像并计算蛋白沉默效率。蛋白沉默率(%)=(1-实验组IGF1R蛋白相对表达量/对照组IGF1R蛋白相对表达量)×100%。
1.2.4 荧光实时定量PCR法检测移植瘤组织HIF-1α mRNA和VEGF mRNA表达 取移植瘤组织80 mg,Trizol法抽提总RNA,按照试剂盒说明完成第一条链cDNA的合成。
荧光实时定量 PCR引物序列:HIF-1α上游5’-AGAAGACGTGCAGGGACCCC-3’,下游 5’-AGAAGATTTGCAGGGACCCC-3’;VEGF上游5’-AAGATCCGCAGACGTGAAATGTT-3’,下游 5’-CGGCTTGTCACATCTGCAAC-3’;β-actin上游5’-GCAGAAGGAGATCACAGCCCT-3’,下游 5’-GCTGATCCACATCTGCTGGAA-3’;反应条件:95℃90 s,94℃15 s,60 ℃100 s(包含荧光读取30 s),68℃90 s,共40个循环;依据荧光曲线,计算出Ct值。基因mRNA相对表达量采用2-ΔΔCt法进行计算分析。
1.2.5 移植瘤组织HE染色 移植瘤组织石蜡包埋后,4 μm连续切片;经二甲苯脱蜡、梯度乙醇脱水处理后,苏木素-伊红染色,封片显微镜下观察组织形态。
1.2.6 免疫组化法测定微血管密度 以CD34为检测标的物,采用免疫组织化学SP法。移植瘤石蜡包埋,5 μm连续切片;二甲苯脱蜡,乙醇梯度水化;3%过氧化氢消除内源性过氧化物酶;EDTA修复;羊血清室温封闭1 h;兔抗人IGF1R一抗(1∶300稀释)4℃孵育过夜;PBS清洗,加入二抗,室温孵育0.5 h,冲洗后DAB显色,苏木素复染,中性树胶封片;用已知肺腺癌免疫组化切片作阳性对照,用PBS代替一抗作阴性对照。参照Weidner[5]报道方法,先用40倍光镜在肿瘤组织中寻找高血管密度区,应用计算机辅助的图像系统以5个随机200倍视野内被CD34染成棕色的血管的均数表示该组织的微血管密度(MVD)。
1.3 统计学分析
2 结果
2.1 移植瘤模型建立及生长情况
以MOI为20病毒量感染A549细胞72 h后感染效率达90%-95%水平(图1,见第751页);空白对照组、阴性对照组及实验组裸鼠均成瘤,成瘤率100%;三组成瘤时间分别为 9.3,9.7,12.8 d,实验组裸鼠成瘤时间明显推迟(P<0.05),空白对照组(627.6±124.6)mm3、阴性对照组(585.1±142.1)mm3、实验组(316.4±19.7)mm3,实验组肿瘤生长受到显著抑制,体积抑瘤率达(50.14±2.58)%,质量抑瘤率达(55.53±3.11)%。空白对照组及阴性对照组间无显著差异,绘制肿瘤生长曲线(见图2)。
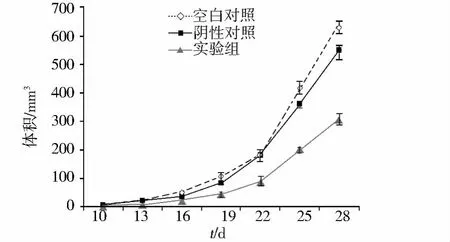
图2 不同条件下裸鼠移植瘤生长曲线Figure 2 Growth curve of nude mice xenograft in three groups
2.2 移植瘤组织IGF1R蛋白表达
空白对照组、阴性对照组及实验组移植瘤组织IGF1R蛋白相对表达量分别为0.82±0.05、0.80±0.05、0.25±0.01,实验组IGF1R表达量较两组对照组显著降低(P<0.05),沉默效率为70.66%,两对照组间无显著差异(P>0.05,见图3)。

图3 Western blot检测不同条件下移植瘤组织IGF1R蛋白的表达Figure 3 IGF1R protein expression in xenograft in three groups by Western blot

图1 慢病毒感染A549细胞 (×100)Figure 1 The A549 cells infected by lentivirus for 72 h (×100)

图4 不同条件下移植瘤HE染色镜下表现 (×200)Figure 4 Morphology of xenografts under a microscope by HE staining (×200)
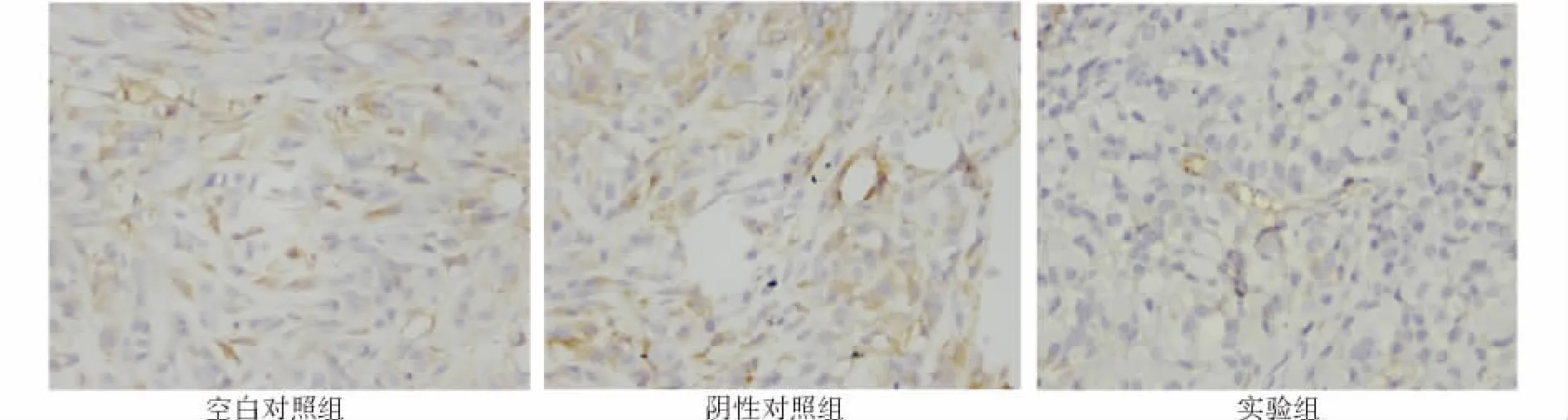
图5 不同条件下移植瘤组织MVD免疫组织化学染色镜下表现 (×100)Figure 5 MVD of xenografts under a microscope by immunohistochermical staining (×100)
2.3 移植瘤组织中HIF-1α mRNA和VEGF mRNA表达
空白对照组、阴性对照组及实验组移植瘤组织HIF-1α mRNA和VEGF mRNA相对表达量分别为0.72±0.03、0.68±0.04、0.34±0.02和 1.08±0.06、1.00 ±0.07、0.46 ±0.04,实验组 HIF-1α 和VEGF基因水平表达量与对照组比较,呈显著下降(P<0.05),两对照组间无显著差异(P>0.05)。
2.4 移植瘤组织HE 染色及微血管密度测定
在移植瘤组织HE染色切片上,对照组肿瘤组织细胞体积大、胞质丰富、核/浆比例大、染色深、分裂相多见、癌巢大、细胞丰富、排列紧密、间质稀少,包膜多不完整。而实验组瘤组织细胞较少、细胞分界清、癌巢小、间质丰富、包膜相对完整,并可见片状的部分细胞核与浆呈固缩坏死样改变(图4,见第751页)。
微血管密度(MVD)检测移植瘤组织内不同区域的微血管计数不同,形态不规则,部分血管无明显管腔(图5,见第751页),三组MVD分别为28.2±0.03、32.8±0.05、10.2 ±0.04,实验组 MVD 显著降低,差异有统计学意义(P<0.05)。
3 讨论
RNA干扰是利用同源性双链RNA诱发序列特异的转录后基因沉默现象。小干扰RNA及pSUPER载体质粒技术可有效、特异性地沉默细胞内目的基因的表达,为RNAi技术在基因治疗研究中奠定了基础。但由于其转染率较低、基因抑制表达作用较弱、持续时间较短、不适合体内实验等缺点,限制了其研究应用[6];腺病毒载体虽然能够提高转染效率,但其免疫原性大、外源基因表达的可控性差等因素限制,体内研究效果并不理想[7];近年来出现的慢病毒载体具有携带基因容量大、外源基因表达稳定且时间长、感染效率高(可以感染体内、体外分裂细胞与非分裂细胞)、免疫原性低、安全性高等优点,成为RNAi技术体内研究最理想的载体[8]。本课题组构建的IGF1R-shRNA重组慢病毒可有效沉默肺腺癌A549细胞IGF1R表达,在前期体外实验研究中已得到证实[4]。本研究再次证实,该重组慢病毒对A549细胞移植瘤组织IGF1R同样具有较高的抑制效率,且无红肿、硬结或溃烂等局部免疫排斥现象。
IGF1R是酪氨酸受体家族重要的成员之一,与配体IGFs结合后,可在其他生长因子缺乏的情况下促使细胞周期的完成,具有较强的促进细胞增殖作用。许多研究已证实,IGF1R在肺癌、乳腺癌、神经胶质瘤等多种肿瘤组织中过表达;并参与肿瘤细胞恶性表型转化,促进肿瘤增殖。Wang等研究表明下调IGF1R表达对肺腺癌细胞的增殖具有显著的抑制作用[9]。但其具体作用机制尚未完全明确。
乏氧是肿瘤组织生长重要的特征之一。HIF-1α是乏氧条件下广泛存在于哺乳动物和人体内的一种核转录因子,HIF-1α蛋白通过逃逸泛素化蛋白酶水解而组成性激活;血管依赖是肿瘤组织生长的另一重要特征。VEGF是重要的促血管生成因子,它能特异性地结合血管内皮细胞,促进内皮细胞生长,促使血管的生成。而HIF-1α/VEGF轴在肿瘤血管生成中的作用已逐渐得到证实。HIF-1α不仅可以促进VEGF的转录,而且可以增加VEGF mRNA的稳定性,促进VEGF蛋白的表达[10]。
近年来研究发现,IGF1R参与了肿瘤组织血管的生成过程。Piecewicz等证实,IGF1R通过MAPK/ERK1/2和PI3K/AKT细胞信号通路促进核因子HIF-1α表达,进而提高胚胎干细胞VEGF表达水平[11];Gariboldi等研究表明,IGF1R 抑制剂 NVPAEW541能通过IGF-STAT3-HIF1信号通路抑制胶质瘤细胞VEGF表达[12]。本研究中,当IGF1R沉默后,肺腺癌移植瘤组织中HIF-1α mRNA和VEGF mRNA表达均显著降低,微血管密度显著减少,肿瘤细胞稀疏,细胞间质丰富;移植瘤的体积减小、重量减轻,移植瘤生长受到显著抑制,再次证实了IGF1R信号通路在核因子HIF-1α表达及血管生成中的重要作用。
综上所述,以慢病毒为载体的IGF1R基因干扰能显著降低肺腺癌组织血管生成,抑制肿瘤生长,且高效、安全。
[1] Hartog H,Wesseling,Boezen HM,et al.The insulin-like growth factor 1 receptor in cancer:old focus,new future[J].Eur J Cancer,2007,43(13):1895-1904.
[2] Jiang B,Dong H,Zhang Z,et al.Hypoxic response elements control expression of human vascular endothelial growth factor 165 genes transferred to ischemia myocardium in vivo and vitro[J].J Gene Med,2007,9(9):788-796.
[3] Girnita A,Girnita L,del Prete F,et al.Cyclolignans as inhibitors of the insulin-like growth factor-1 receptor and malignant cell growth[J].Cancer Res,2004,64(1):236-242.
[4] 杜永亮,贾晓民,李海泉,等.IGF1R-shRNA重组慢病毒构建及对肺癌A549细胞增殖的影响[J].山西医科大学学报,2013,44(2):106-110.
[5] Weidner N.Intratumor microvessel density as a prognostic factor in cancer[J].Am J Pathol,1995,147(1):9-19.
[6] 白爱民,贾艳敏,张晓菁.siRNA为基础的RNAi在肿瘤基因治疗中的应用进展[J].中华肿瘤防治杂志,2007,14(12):953-955.
[7] 崔建玲,郭志远.腺病毒载体的优化[J].河北医科大学学报,2006,27(4):301-305.
[8] Bauer G,Dao MA,Case SS,et al.In vivo biosafety model to assess the risk of adverse events from retroviral and lentiviral vectors[J].Mol Ther,2008,16(7):1308-1315.
[9] Wang C,Ding C,Kong M,et al.Tumor-targeting magnetic lipoplex delivery of short hairpin RNA suppresses IGF-1R overexpression of lung adenocarcinoma A549 cells in vitro and in vivo[J].Biochem Biophys Res Commun,2011,410(3):537-542.
[10] 李国元,赵久达,王成,等.HIF-1α和VEGF在胃癌中的表达及临床意义[J].中国癌症杂志,2010,20(8):602-606.
[11] 吴德华,朱晓霞,张洪波,等.HIF-1α基因表达沉默对鼻咽癌组织VEGF和CXCR4表达影响的研究[J].中华肿瘤防治杂志,2008,15(3):170-173.
[12] Piecewicz SM,Pandey A,Roy B,et al.Insulin-like growth factors promote vasculogenesis in embryonic stem cells[J].PLoS One,2012,7(2):e32191-32192.
[13] Gariboldi MB,Ravizza R,Monti E.The IGFR1 inhibitor NVPAEW541 disrupts a pro-survival and pro-angiogenic IGF-STAT3-HIF1 pathway in human glioblastoma cells[J].Biochem Pharmacol,2010,80(4):455-462.
