芪参益气滴丸对糖尿病大鼠视网膜血管内皮生长因子和色素上皮衍生因子表达的影响
2013-03-11刘海丹
苑 维,金 明★,邓 辉,潘 琳,刘海丹
(1.中日友好医院 眼科,北京100029;2.北京太阳宫社区卫生服务站,北京 100028)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病(diabetes millutus,DM)最为常见和严重的微血管并发症之一,视网膜新生血管形成是致盲的主要病理基础,形成机制还未完全清楚。血管内皮生长因子(vascular endothelial growth factor,VEGF)和色素上皮衍生因子(pigment epithelium derived factor,PEDF)是目前最重要的血管生成因子和血管抑制因子,在DR中的作用逐渐被人们认识。本研究以链脲佐菌素诱导的糖尿病大鼠为模型,观察应用芪参益气滴丸对视网膜VEGF和PEDF及其mRNA表达的影响。
1 材料和方法
1.1 动物
SPF级雄性6周龄SD大鼠82只,体重180~220g。购自维通利华实验动物研究所。许可证号SCXK(京)2006-0009。
1.2 药物和试剂
链脲佐菌素(streptozotozin,STZ:美国Sigma公司出品S0130),购自北京拜尔迪生物技术有限公司。芪参益气滴丸浸膏(国药准字Z20030139),由天津天士力制药股份有限公司提供。阳性对照药物:羟苯磺酸钙胶囊(国药准字X20000713)。反转录试剂盒PrimeScriptTMRT reagent Kit Perfect Real Time (DRR037A),PCR 扩 增 试 剂 盒(DR001A),购自TaKaRa宝生物工程(大连)有限公司。GeneRulerTMLow Rangge DNA Ladder;AGEs随机引物;一步法抗兔/鼠通用型抗体Ⅱ(VEGF,PEDF)购自上海生工生物工程技术服务有限公司。
1.3 动物模型的建立
大鼠适应性饲养1周后,随机分为正常组12只,造模组70只。造模前大鼠禁食12h,左下腹腔内注射链脲佐菌素,临用前用pH=4.4柠檬酸缓冲液(4℃保存)冰浴配制成浓度为1%(W/V)的溶液)按65mg/kg大鼠体重,正常对照组注射同等体积的生理盐水。72h后取尾静脉血,用快速血糖仪(罗康全活力型血糖仪)测量血糖。凡非空腹血糖≥16.7mmol/L者即为糖尿病大鼠模型。
1.4分组及给药
成模1周后血糖仍不低于16.7mmol/L的70只糖尿病大鼠随机分成对照组20只,模型组20只与芪参益气滴丸组(简称试验组)30只,并开始给药。实验期间自由摄食饮水,实验期10个月。正常组和模型组喂食普通饲料。对照组:大鼠每日上午9~10时灌胃给羟苯磺酸钙胶囊1次,给药剂量为0.2g/kg/d。试验组大鼠每日上午9~10时灌胃给药1次,给药剂量为0.2g/kg/d(db=da×Kb/Ka,K人=0.11,K大鼠=0.71,da为已知人的公斤体重剂量,db为欲换算的动物的公斤体重剂量,Kb、Ka为折算系数。拟正常50kg体重成人口服芪参益气滴丸1.5g/d,db=1.5/50×0.71/0.11≈0.2)。
1.5 检测指标及方法
1.5.1 制备视网膜消化铺片血管标本
动物处死后及时收集大鼠的部分眼球固定在4%多基甲醛溶液中,制作视网膜消化铺片血管标本。视网膜铺片PAS染色。在不同倍数下分别观察PAS染色视网膜血管及其血管壁细胞走行、分布及形态、特点。
1.5.2 制备视网膜切片
眼球置于4%多聚甲醛(4℃,24h)固定,沿角膜缘剪开眼球壁,去除角膜、晶体、玻璃体,余下的眼杯放入固定液中再固定48h,梯度酒精脱水,二甲苯透明,石蜡包埋,连续切片,切片厚度为3μm。
1.5.3 视网膜切片免疫组织化学染色
石蜡切片脱蜡,梯度酒精水化;流水漂洗5min,PBS洗2次,每次5min;封闭内源性过氧化物酶(0.3%H2O2甲醇液)15min;流水冲洗5min;PBS液洗3次,每次5min;每张切片滴加阻断剂50~100μl作用30min;不洗,滴加一抗(VEGF,PEDF:1:50多抗),湿盒4℃冰箱过夜;PBS液洗3次,每次5min;滴加LSAB二抗,湿盒室温中90min;PBS液洗3次,每次5min;滴加LSAB三抗,湿盒室温中90min;PBS液洗3次,每次5min;0.05%DAB-H2O2显色液3~5min,显色后PBS液终止,水洗5min;梯级乙醇脱水,风干;DPX封片。
1.5.4 RT-PCR
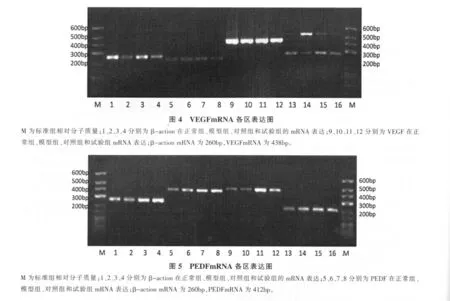
(1)RNA提取步骤:每2只眼视网膜组织加入1mlTrizol,在玻璃匀浆器中匀浆(冰浴);转移至1.5ml离心管;冰上放置匀浆混合物5min,每1ml-Trizol加入0.2ml三氯甲烷;剧烈混合30s后,室温放置3min;4℃12,000rpm离心10min,可见分层;将上层无色水相转移至一新的离心管中;在吸取的水相中加入0.5ml异丙醇,轻柔混合均匀,室温静置10min;4℃12,000rpm离心10min,可见少量RNA沉淀;弃上清,用1ml 75%的乙醇洗涤沉淀2次;4℃7,500g离心沉淀5min,弃上清;空气中干燥RNA沉淀5~10min;20μl DEPC水溶解RNA沉淀;取2μl溶解后的RNA,用紫外分光光度法测 定RNA纯度及浓度;计算总RNA浓度。(2)RNA反转录步骤:将溶解后的RNA用DEPC水稀释至浓度为1μg/μl;取5μl稀释后的RNA溶液于新的0.5ml离心管中;每5μlRNA稀释液中,分 别 加 入 5×PrimeScriptTMBuffer 4μl,Prime-ScriptTMRT Enzyme MixⅠ1μl,Oligo dT Primer 1μl,ramdom 6mers 1μl,RNase Free dH2O 8μl,PCR总反应体积为20μl;将反应管置于PCR仪,反转录37℃反应15min,85℃反转录酶失活反应5s,4℃终止反应10min;将反转录完毕所得到的模板DNA,用0.5ml离心管分装,分装成4管,每管5μl;-20℃保存,备用;以上操作均在冰上进行。(3)RT-PCR反应扩增步骤:将模板DNA用双蒸水1:5倍稀释;取稀释后的模板DNA稀释液2μl至一新0.5ml离心管中,每2μl模板DNA稀释液分别加入TaKaRa Taq 0.1μl,10×PCR Buffer(Mg2+Plus)2μl,dNTP Mixture 1.6μl,上、下游引物各0.4μl,ddH2O 13.5μl,PCR反应液总体积为20μl(冰浴);将反应管置于PCR仪,扩增反应94℃预变性2min后,进入94℃变性30s,退火30s,72℃延伸1min,共32个循环(β-action 28个循环),最后72℃充分延伸5min,4℃终止反应10min。引物序列为VEGF:F:5’-CAGAAACACGACAAACCCATCC-3’,R:5’ - TAAGCCACTCACACACACAGCC-3’,扩增产物438bp。PEDF:F:5’-GAAAATTGCCCGGTCTACAA-3’,R:5’-GTTGGTAACGTCGCCTTCAT-3’,扩增产物412bp。βactin:F:5’-CCTGTATGCCTCTGGTCGTA-3’,R:5’-CCATCTCTTGCTCGAAGTCT-3’,扩增产物260bp。
1.6 统计学方法
组间均值的比较采用SPSS13.0软件进行成组设计资料的t检验分析。图像分析仪由北京中医药大学组胚教研室提供。

表1 实验300d时各组大鼠血糖水平(mmol/L)

表2 视网膜VEGF、PEDF的表达比较(灰度值:x¯±s)

表3 视网膜VEGFmRNA、PEDFmRNA的表达(OD值)
2 结果
2.1 处死大鼠前血糖
表1示,各组中样本数不同,因实验过程中糖尿病大鼠有死亡。
2.2 视网膜消化铺片形态学观察
图1(见封底)示,正常大鼠视网膜毛细血管分布规则,走向较直,管径粗细均匀一致;内皮细胞一般位于毛细血管中央部位,核较大,染色较浅,成椭圆形或不规则形,其长轴多与毛细血管平行;周细胞位于毛细血管管腔外侧,核较小,染色深,多成球形或三角形。糖尿病大鼠视网膜毛细血管网排列紊乱,走向极不规则,管腔粗细不均、周细胞核明显固缩、数目显著减少,内皮细胞明显增生、部分尚可见无细胞毛细血管、影周细胞等其他早期DR特征性病变。对照组和试验组的改变较模型组减轻。
2.3 视网膜VEGF的表达
视网膜VEGF表达模型组明显高于正常组(P<0.01),试验组和对照组VEGF表达明显低于模型组(P<0.01),试验组和对照组组间差异不显著。结果见表2,图2(见封底)。
2.4 视网膜PEDF的表达
视网膜PEDF表达模型组明显低于正常组(P<0.01),试验组和对照组PEDF表达明显高于模型组(P<0.01),结果见表2,图3(见封底)。
2.5 视网膜VEGFmRNA的表达
视网膜VEGF mRNA表达模型组显著高于对照组(P<0.01),试验组和对照组表达显著低于模型组(P<0.01),试验组和对照组组间差异不显著。结果见表3。VEGFmRNA各区表达见图4。
2.6 视网膜PEDFmRNA的表达
视网膜PEDF mRNA表达模型组明显低于正常组(P<0.01),试验组和对照组表达明显高于模型组(P<0.01),结果见表3。PEDFmRNA各区表达见图5。
3 讨论
中医学认为DR是气阴两虚、脉络瘀阻所致。研究[1]发现在病变进程中,阳虚证呈上升趋势,阴虚证呈下降趋势,提示气虚始终存在。痰、湿、瘀作为致病因素及病理产物,具有普遍存在性,在DR的发生发展中起重要作用。血瘀贯穿DR发生发展的始终[2]。因此本实验选用益气活血的芪参益气滴丸作为干预用药。
本实验观察到模型组糖尿病大鼠视网膜出现了毛细血管网排列紊乱、管腔粗细不均、周细胞核明显固缩、数目显著减少、内皮细胞明显增生等DR特征性改变。本实验发现芪参益气滴丸和羟苯磺酸钙均能减轻糖尿病大鼠的视网膜微血管损害。羟苯磺酸钙可降低视网膜毛细血管的高渗透性和毛细血管脆性[3],延缓DR的进展,为眼科临床常用的防治DR的药物。芪参益气滴丸由黄芪、丹参、三七、降香组成,功用益气活血。研究发现黄芪多糖[4]能降低四氧嘧啶导致的糖尿病大鼠血糖水平,增高胰岛素水平,减轻内皮细胞损伤和功能障碍;临床上应用黄芪治疗糖尿病及其并发症。丹参对血管内皮具有明显的保护作用[5]。三七不但能止血,还能入血分化血瘀。丹参和三七的复方制剂已广泛应用于临床治疗DR[6,7]。
VEGF是目前所知最强的促血管内皮细胞生长的因子,在DR发生中起重要作用。糖尿病时视网膜组织缺血缺氧VEGF高表达诱导新生血管形成[8]。VEGF主要作用于内皮细胞,增加血管通透性,促进血管生成,增加粘附分子和细胞外基质的产生[9]。有研究[10]显示,在新生血管形成之前VEGF就已导致血-视网膜屏障损伤。PEDF在人眼组织中广泛分布,角膜、晶状体、睫状体、视网膜和脉络膜中均检测到PEDF的表达[11]。PEDF能够通过引起有活性的内皮细胞发生凋亡来抑制血管形成作用。PEDF可以抑制广泛的不同的刺激物所引起的血管形成[12]。在正常眼组织中,VEGF和PEDF之间的平衡如被打破,可能导致新生血管形成。本实验观察到,模型组糖尿病大鼠视网膜VEGF表达高于正常组,PEDF表达低于正常组。药物干预后,芪参益气滴丸组和羟苯磺酸钙组糖尿病大鼠视网膜VEGF和VEGF mRNA表达较模型组降低,PEDF和PEDFmRNA表达较模型组增加,二者组间差异不显著。因此芪参益气滴丸对视网膜微血管保护作用可能与改善VEGF和PEDF之间的平衡有关,但它们在病变过程中的动态变化及相关性还有待进一步研究。
[1] 匡丽晖,方穗雄,黄雄飞,等.糖尿病视网膜病变中医证候分类的修改意见[J].中国中医眼科杂志,2007,17(2):63-64.
[2] 熊静,彭清华,吴权龙,等.益气养阴活血利水法治疗单纯性糖尿病视网膜病变临床研究[J].中国中医眼科杂志,2009,19(6):311-315.
[3] 李峻,田浩明.羟苯磺酸钙治疗非增殖性糖尿病视网膜病变的系统评价[J].循证医学,2008,13(1):34-41.
[4] 吴勇,欧阳静萍,涂淑珍,等.黄芪多糖对糖尿病大鼠内皮细胞的影响[J].辽宁中医杂志,2002,29(1):22-23.
[5] 吴开云,杨亚安,王晨,等.丹参醇提取物对内皮细胞VCAM-1和ICAM-1表达的影响[J].解剖学杂志,2005,28(1):98.
[6] 王军.复方血栓通治疗糖尿病视网膜病变的疗效分析[J].江西医药,2009,44(7):709-710.
[7] 邓辉,金明,苑维,等.复方丹参滴丸治疗早期糖尿病视网膜病变的临床观察[J].中国中医眼科杂志,2005,15(2):72-74.
[8] Sydorova M,Lee MS.Vascular endothelial growth factor levels in vitreous and serum of patients with either proliferative diabetic retinopathy or prolife rative vetreoretinopathy[J].Ophthal Imc Res,2005,37(4):188-190.
[9] Hassan K,Simmi W,Rubenchiki,et al.Effect of erythropairtin therapy on polyneuropathy in predialytic patients[J].J Nephrol,2003,16(1):121-125.
[10] Alikacem N,Yoshizawa T,Nelson KD,et al.Quantitative MR imaging study of intravitreal sustained release of VEGF in rabbits[J].Invest Ophthalmol Vis Sci,2000,41(6):1561-1569.
[11] Tonbran TJ,Shivaram SM,Chader GJ,et al.Expression,secretion,and age-related down regulation of pigmentepithe lium-derived factor,a serpin with neurotrophic acivity[J].J Neurosci,1995,15(7):4992-5003.
[12] Dawson DW,Volpert OV,Gillis P,et al.Pigmentepitheliumderived factor a potent inhibitor of angiogenesis[J].Science,1999,285:245-248.
