自体表皮细胞-纤维蛋白膜创面移植治疗大鼠烧伤
2013-03-09陈子英王晓晔崔华雷
陈子英,王晓晔,崔华雷
实验研究
自体表皮细胞-纤维蛋白膜创面移植治疗大鼠烧伤
陈子英,王晓晔,崔华雷
目的:观察自体表皮细胞-纤维蛋白膜移植到大鼠烧伤创面治疗皮肤缺损的效果。方法:健康Wistar大鼠20只,随机分成烧伤皮肤缺损造模组和自体表皮细胞-纤维蛋白膜移植治疗组,治疗后计算表皮细胞在纤维蛋白膜上最佳接种密度,观察移植后的各组创面愈合情况、创面伤口的收缩比例等。结果:在纤维蛋白膜上接种表皮细胞的最佳密度为5×104/cm2,烧伤皮肤缺损造模组创面完全愈合时间平均22.3 d,自体表皮细胞-纤维蛋白膜移植治疗组为18.1 d,造模组创面收缩率为(70±5)%,移植组为(20±5)%(均P<0.05)。结论:自体表皮细胞-纤维蛋白膜可用于覆盖大面积烧伤造成的皮肤缺损,预防创面伤口瘢痕化的形成,减轻创面收缩率,加速皮肤缺损创面的愈合速度。
烧伤;大鼠;自体表皮细胞-纤维蛋白膜;移植
严重烧伤或创伤后大面积皮肤缺损,为覆盖创面,表皮细胞悬液移植曾用来进行创面移植。因细胞悬液流动性大,细胞流失明显,使表皮细胞发挥不了最大的作用,影响创面愈合的速度和质量。2012年1月—2012年7月,我们进行了自体表皮细胞-纤维蛋白膜创面移植对大鼠烧伤的治疗研究,评价自体表皮细胞-纤维蛋白膜移植治疗烧伤的效果。
1 材料与方法
1.1 表皮细胞的制备及鉴定 采用大鼠表皮胰蛋白酶消化法来完成表皮细胞的分离,应用细胞计数板进行细胞计数,使用台盼蓝染色检测表皮细胞活力。将表皮细胞接种到培养瓶内,置于37℃、5% CO2培养箱中培养。同时进行表皮细胞的免疫组织化学染色来鉴定表皮细胞。在光镜下观察原代培养表皮细胞的形态变化和生长情况。
1.2 纤维蛋白膜的制备 参照吴博等[1]的方法。取健康Wistar大鼠全血,置入预先装有肝素抗凝剂的生化管中,在普通离心机中以3000 r/min,离心10 min。滴管吸取上层血浆,保存于4℃。凝血酶冻干粉剂予以无菌注射用水溶解稀释。用0.22 μm无菌滤膜过滤法对血浆进行过滤除菌,将等体积血浆和已经溶解稀释的凝血酶各2 mL,分别均匀的铺于无菌6孔板的孔中。底层先铺1 mL凝血酶溶液,中间铺2 mL大鼠血浆,上面再铺凝血酶溶液1 mL。完成后静置。30 min后吸出上清液,即制备得一个6孔板的纤维蛋白膜。将制作好盛有纤维蛋白膜的6孔板用无菌胶带封口,保存于37℃。
用无菌注射水溶解稀释凝血酶,使之溶液的浓度分别为1 mL:10 IU、1 mL:50 IU和1 mL:100 IU,按照上述方法分别制作不同凝血酶浓度的3种膜,每种膜制备一个6孔板,即6个膜。在静置时,随时观察6孔板中凝固反应的情况,并观察纤维蛋白膜的一般性状,测量其厚度,以及检测纤维蛋白膜的抗张强度及伸长率,得出制备纤维蛋白膜所用血浆与凝血酶的最佳比例。
1.3 表皮细胞的接种密度及纤维蛋白膜为基质培养表皮细胞的动态观察 将原代培养的表皮细胞以将1×105/cm2,5×104/cm2,1×104/cm2的细胞密度接种到制备有纤维蛋白膜和空白的24孔板中。将预接种的表皮细胞分为A、B两组。A组:纤维蛋白膜组,B组:空白对照组,分别将原代培养的表皮细胞以将1×105/cm2,5×104/cm2,1×104/cm2的细胞密度接种到24孔板中。即为:每组表皮细胞密度接种3个复孔,即为:
A1组:接种1×105/cm2密度的表皮细胞到有纤维蛋白膜的24板中,3个复孔。
A2组:接种5×104/cm2密度的表皮细胞到有纤维蛋白膜的24板中,3个复孔。
A3组:接种1×104/cm2密度的表皮细胞到有纤维蛋白膜的24板中,3个复孔。
B1组:接种1×105/cm2密度的表皮细胞到空白的24板中,3个复孔。
B2组:接种5×104/cm2密度的表皮细胞到空白的24板中,3个复孔。
B3组:接种1×104/cm2密度的表皮细胞到空白的24板中,3个复孔。
置于37℃、5%CO2培养箱中培养。24 h后计数上清液中的细胞数,根据以下公式:
计数表皮细胞的贴壁率。根据细胞贴壁率和预先接种的细胞数,可以计算不同接种密度下的贴壁细胞数,得出表皮细胞在纤维蛋白膜上的最佳接种密度,并观察表皮细胞在以纤维蛋白膜基质上的生长情况。
1.4 动物与分组 取健康Wistar大鼠20只,雌雄各半,体质量(220±10)g,随机分为2组。
烧伤皮肤缺损造模组,参照吴国群等[2]的方法进行制作。在大鼠背部制作出2 cm×2 cm的全层皮肤缺损,碘伏消毒,覆盖凡士林油纱布,敷料包扎。
自体表皮细胞-纤维蛋白膜移植治疗组:第一次在大鼠背部切取1 cm×1 cm大小的全层皮肤,分离培养大鼠的表皮细胞。用同种的大鼠血浆与由合适浓度凝血酶溶液相混合制备纤维蛋白膜。在纤维蛋白膜上以合适的细胞密度接种培养自体表皮细胞。
表皮细胞在纤维蛋白膜上培养24 h,在第一次取皮的皮肤缺损处扩大背部皮肤缺损达至2 cm× 2 cm,制作出大鼠背部皮肤缺损模型。将爬满表皮细胞的纤维蛋白膜移植到皮肤缺损的创面,使爬有自体表皮细胞的一侧对向创面。自体表皮细胞-纤维蛋白膜移植治疗组每只大鼠的手术创面进行包扎,氨苄青霉素4万IU肌注肌肉注射。
1.5 指标观察 表皮细胞在纤维蛋白膜表面的生长状况,移植后的创面是否发生感染,发生感染的例数,各组创面愈合情况、创面伤口的收缩比例等。
1.6 统计学方法 应用SPSS13.0统计软件,瘢痕愈合时间数据和创面收缩率数据比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 表皮细胞制备及鉴定 通过表皮胰蛋白酶消化法可以得到数量足够多且细胞活力良好的表皮细胞,经细胞免疫组织化学鉴定,角蛋白抗体染色阳性(图1),波形蛋白抗体染色阴性(图2),可以确定分离出的细胞为表皮细胞。
2.2 纤维蛋白膜的制备 制作完成的纤维蛋白膜外观呈半透明胶冻状。3种不同凝血酶浓度的纤维蛋白膜的厚度均在100μm左右。将凝血酶用无菌注射水稀释成1 mL∶10 IU后所制成的纤维蛋白膜塑型性差,成膜不均匀,易破裂,伸长率低。用稀释比例1 mL∶50 IU和1 mL∶100 IU的凝血酶溶液所得到的纤维蛋白膜塑形性良好,不易破裂,有较好的伸长率。
2.3 表皮细胞的接种密度及纤维蛋白膜为基质培养表皮细胞的动态观察 表皮细胞在24孔板中培养24 h,吸出24孔板中各个培养孔的上清液,利用细胞计数的方法,分别计数上清液中的细胞数,最终得出的在24孔板中各组表皮细胞的贴壁率分别为,A1:(20±5)%,A2:(40±6)%,A3:(42±5)%;B1:(15±4)%,B2:(33±5)%,B3:(36±5)%。显示在纤维蛋白膜上培养的表皮细胞的贴壁效果,明显比直接在24孔板中的表皮细胞要好。当接种的表皮细胞密度分别为1×105/cm2,5×104/cm2时,在24 h后均能铺面纤维蛋白膜的表面和对照组24孔板的孔底,接种密度为1×104/cm2的表皮细胞在24 h仅仅能铺满培养孔板的65%,纤维蛋白膜上为75%。可见,当接种的表皮细胞密度在5×104/cm2及以上时,24 h后的表皮细胞均能贴满培养孔板的底部。1×1105/cm2的细胞接种密度浪费了很多的表皮细胞,当接种密度为1×104/cm2时,接种的表皮细胞数量又不够。在纤维蛋白膜上合适的表皮细胞接种密度为5×104/cm2。

图1 表皮细胞角蛋白抗体染色阳性(100×)

图2 表皮细胞波形蛋白抗体染色阴性(100×)
刚刚接种到24孔板的表皮细胞细胞呈圆形,单个或几个细胞成团呈悬浮状态,24 h后大部分的表皮细胞已经贴附于纤维蛋白膜上,48 h后贴壁的表皮细胞变大,向四周铺展。接种到纤维蛋白膜上的表皮细胞可以正常生长,纤维蛋白膜可以促进表皮细胞的贴壁率,两者可以联合得到表皮细胞-纤维蛋白膜。
2.4 术后感染情况 两组共20只大鼠,无创面感染出现,无死亡。
2.5 创面愈合时间 自体表皮细胞-纤维蛋白膜移植治疗组,移植后的第4 d,创面可见表皮细胞的皮岛出现。术后第7 d,皮损的创面被覆新鲜细嫩的表皮组织,表面红润有光泽,表皮细胞增殖成复层。术后第10~14 d,移植治疗后的创面表皮组织进一步成熟和分化,表皮层增厚,创面愈合良好,无结痂的出现。18 d,大鼠的皮肤缺损创面已经完全愈合,伤口无瘢痕组织的形成(图3~图6)。烧伤造模组大鼠术后的第2 d,皮肤缺损创面就开始结痂,痂皮质硬。术后第10 d,新生的肉芽组织和胶原替代了最初的结痂,同时创面四周的皮肤进一步收缩。术后14 d,创面基本愈合,但伤口收缩更为明显。术后第22 d,皮肤缺损创面才完全愈合,瘢痕化的创面的呈现进一步的收缩态势(图7~图10)。造模组创面完全愈合的时间平均为22.3 d,自体表皮细胞-纤维蛋白膜移植治疗组为18.1 d(P<0.05)。

图3 自体表皮细胞-纤维蛋白膜移植到大鼠皮损创面
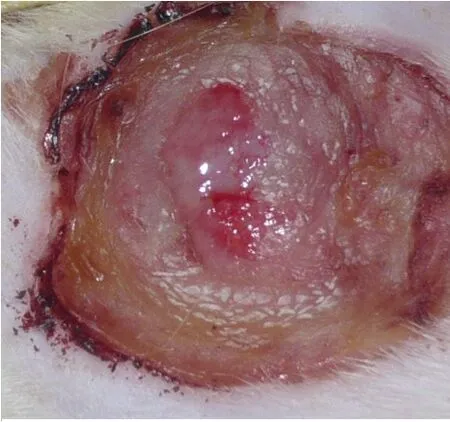
图4 自体表皮细胞-纤维蛋白膜移植治疗组大鼠移植术后第4 d的创面情况

图5 自体表皮细胞-纤维蛋白膜移植治疗组大鼠移植术后第7 d的创面情况
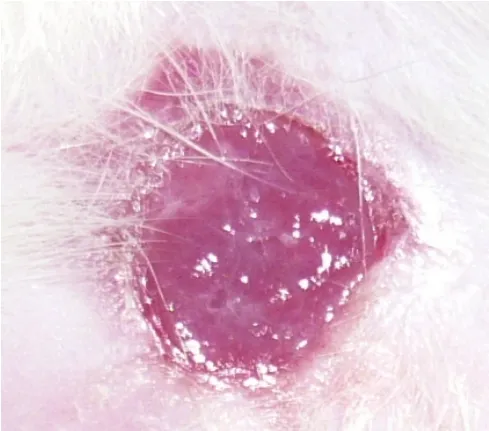
图6 自体表皮细胞-纤维蛋白膜移植治疗组大鼠移植术后第14 d的创面情况

图7 烧伤皮肤缺损造模组大鼠的皮肤缺损

图8 烧伤皮肤缺损造模组大鼠术后2 d的创面情况

图9 烧伤皮肤缺损造模组大鼠术后10 d的创面情况

图10 烧伤皮肤缺损造模组大鼠术后14 d的创面情况
2.6 伤口愈合后收缩率比较 烧伤皮肤缺损造模组大鼠的创面收缩率为(70±5)%,自体表皮细胞-纤维蛋白膜移植治疗组大鼠的创面收缩率为(20± 5)%(P<0.05)。
3 讨论
烧伤治疗的首要问题是深度烧伤创面的存在,如何尽早、有效地封闭深度烧伤创面,是烧伤治疗的根本任务。体表各部位创伤、烧伤愈合最后多以瘢痕形成而告终,瘢痕导致的机体形态改变与功能障碍,使患者生活不能自理,严重影响患者的生活质量[3-4]。愈合时间超过3周的烧伤创面,形成增生性瘢痕的几率很高。因为这种创面缺乏表皮,而表皮细胞可以控制成纤维细胞的分泌功能降低胶原的含量,且表皮细胞还可促进自身的分裂。在大面积烧伤皮肤创面缺损愈合的过程中,表皮细胞起着至关重要作用。
表皮细胞体外培养成功与否的关键,是表皮细胞分离过程。目前国内外学者一般采用胰蛋白酶。一般而言,细胞分离时,胰蛋白酶的浓度越大、作用时间越长,对表皮细胞分离的能力就越大,但是超过一定的限度也会损伤细胞。其安全、有效的作用浓度为0.01%~0.5%,常用浓度为0.25%。在我们的实验中,采用的是0.25%的胰蛋白酶在37℃时消化1~3 h。经显微镜下细胞计数和进行细胞活力检测,分离得到的表皮细胞数量和活力均达到了实验要求。近些年来,还有很多学者使用分离酶[5]和热溶素[6]进行分离表皮细胞。胰蛋白酶主要作用于基底层和基底上层的细胞,破坏基底上层桥粒结构,常在真皮部分残留大量的基底细胞,而使分离后的表皮细胞结构欠完整。分离酶和热溶素选择性地消化真皮与表皮间的半桥粒结构,因而可能获得较多具有增殖能力的表皮细胞,减少人成纤维细胞的污染。虽然应用分离酶Ⅱ或热溶素和胰蛋白酶两步消化法在分离表皮细胞的过程中,效果更好。我们在实验中考虑到分离酶Ⅱ和热溶素价格昂贵,不易获得,在能够满足实验要求的前提下,仅仅使用了胰蛋白酶一步消化法分离表皮细胞,分离得到的表皮细胞数量和活力能够满足实验的要求。
原代、传代培养或者处于亚融合、融合状态的表皮细胞,皆可用于悬液移植以及时封闭皮肤缺损的创面,而且处于亚融合状态的表皮细胞内含有大量能形成细胞克隆的干细胞,具有较高的增殖活。在实际应用的过程中我们发现,单纯表皮细胞悬液移植也存在一些不足,移植后的表皮细胞悬液具有很大的流动性,细胞流失明显,移植之后不一定能够保证表皮细胞的在移植的创面良好地生长增殖,并且表皮细胞因创面覆盖物的摩擦也会出现脱落等情况。这使得表皮细胞在烧伤皮肤缺损创面修复中的作用大大的打了折扣[7],未能为临床提供可行的办法。针对这种情况,我们提出了应用纤维蛋白膜作为培养表皮细胞的基质,然后将自体表皮细胞接种到纤维蛋白膜上构造出自体表皮细胞-纤维蛋白膜,最终移植到大面积烧伤皮肤缺损创面治疗皮肤缺损的问题。
纤维蛋白膜是由凝血酶和血浆中的主要成分纤维蛋白原反应形成,是一种可合成、可降解的、无毒的、具有良好生物相容性的生物材料膜[1]。凝血酶来源于人或动物血液中提取的凝血酶原,经激活而获得凝血酶的无菌冻干制剂,是一种止血药,有促进纤维蛋白原转化为纤维蛋白的作用,适用于结扎止血困难的小血管、毛细血管以及实质性脏器出血的止血[8-9],用于外伤、手术、口腔、耳、鼻、喉、泌尿、烧伤、骨科、神经外科、眼科、妇产科以及消化道等部位出血的止血。纤维蛋白原是血浆中含量最高的一种凝血蛋白,为凝血因子I。在纤维蛋白膜的制备过程中,当纤维蛋白原与凝血酶混合后(有溶解稀释液的情况下),纤维蛋白原在凝血酶的作用下裂解,凝血酶断裂纤维蛋白原的链而释放出酸性多肽A、B,使纤维蛋白原转化成纤维蛋白单体,随之聚合成纤维蛋白多聚体,通过两者之间的反应形成了纤维蛋白膜。
我们应用自体表皮细胞-纤维蛋白膜移植治疗大鼠大面积皮肤缺损的创面,发现移植到创面后的表皮细胞能够很好地生长增殖。在移植后的第4 d,创面可见表皮细胞的皮岛出现。到了术后第7 d,皮损的创面被覆新鲜细嫩的表皮组织,表面红润有光泽,表皮细胞增殖成复层。在术后的第10 d到第14 d时,移植治疗后的创面表皮组织进一步成熟和分化,表皮层增厚,创面愈合良好,无结痂的出现。到了18 d时,大鼠的皮肤缺损创面已经完全愈合,伤口无瘢痕组织的形成。而模型组大鼠的创面愈合过程是,术后第2 d,大鼠的皮肤缺损创面就开始结痂,痂皮质硬。到术后第10 d,新生的肉芽组织和胶原替代了最初的结痂,同时创面四周的皮肤进一步收缩。术后14 d,大鼠的创面基本愈合,但伤口收缩更为明显。直到术后的第22 d,大鼠的皮肤缺损创面才完全愈合,瘢痕化的创面的呈现进一步的收缩态势。同时通过两组大鼠创面愈合后的伤口收缩率的比较,自体表皮细胞-纤维蛋白膜移植治疗组的皮肤缺损创面的收缩程度明显的比模型组的要轻。
自体表皮细胞和纤维蛋白膜两者结合构成的自体表皮细胞-纤维蛋白膜,其中表皮细胞可以依托纤维蛋白膜更好地局限于烧伤皮肤缺损创面表面生长增殖,使其能更有效的在烧伤后的创面修复过程中发挥重大作用。同时,在当自体表皮细胞移植到皮肤缺损的创面之后,创面充当了“体内表皮细胞培养系统”的角色。我们移植到创面的表皮细胞均来自大鼠自己本身,没有组织排异反应的发生,随着移植到皮肤缺损创面上的表皮细胞进一步地生长增殖与分化,最终形成新的上皮,使得创面皮肤完美地愈合。
[1]吴博,崔华雷,王晓晔,等.自体纤维蛋白膜的制备及其生物物理性能测定[J].临床小儿外科杂志,2009,8(4):33-36.
[2]吴国群,桑琳霞,阎蕴力,等.Wistar乳鼠表皮细胞培养及移植实验研究[J].河北医科大学学报,2006,27(5):339-341.
[3]Occleston NL,Laverty HG,O'Kane S,et al.Prevention and reduc⁃ tion of scarring in the skin by Transforming Growth Factor beta 3 (TGFbeta3):from laboratory discovery to clinical pharmaceutical [J].J Biomater Sci Polym Ed,2008,19(8):1047-1063.
[4]Chapman TT.Burn scar and contracture management[J].J Trau⁃ma,2007,62(6 Suppl):S8.
[5]陈俊颖,魏泓,周建华.人表皮细胞分离培养的研究[J].中国实验动物学报,2006,14(2):114-117.
[6]Gragnani A,Sobral CS,Ferreira LM.Thermolysin in human cul⁃tured keratinocyte isolation[J].Braz J Biol,2007,67(1):105-109.
[7]Atiyeh BS,Costagliola M.Cultured epithelial autograft(CEA)in burn treatment:three decades later[J].Burns,2007,33(4): 405-413.
[8]Cheng CM,Meyer-Massetti C,Kayser SR.A review of three stand-alone topical thrombins for surgical hemostasis[J].Clin Ther,2009,1(1):32-41.
[9]Anderson CD,Bowman LJ,Chapman WC.Topical use of recombi⁃nant human thrombin for operative hemostasis[J].Expert Opin Bi⁃ol Ther,2009,(1):133-137.
(收稿:2013-06-26 修回:2013-09-22)
(责任编辑 李兰青 屈振亮)
Treatment of Burn by Transplanting Fibrinous Membrane with Autologous Epidermal Cells on Raw Surface
CHEN Zi-ying,WANG Xiao-ye,CUI Hua-lei Department of Pedatric Surgery,Tianjin Children’s Hos⁃pital,Tianjin(300074),China
Objective To observe the treatment effect of skin defect by transplanting fibrinous membrane with autologous epidermal cells to burn wounds in rats,and to look for new ways to treat the burn caused by large area skin defect.MethodsTwenty healthy Wistar rats were randomly divided into burn skin defect mod⁃ule group and fibrinous membrane with autologous epidermal cells transplanting group.The optimum epidermal cells inoculation density on fibrinous membrane was calculated.The wound healing and the wound contraction ratio after fibrinous membrane with autologous epidermal cells transplantation were observed.ResultsThe best density on fibrinous membranes with epidermal cells was 2.5x104/cm2,burn skin defect module group rats wound healed completely spening an average of about 22.3 days,and the fibrinous membrane with autologous epidermal cells transplantation treatment group rats wound healed completely time was about 18.1 days on aver⁃age;the wound shrinkage rate of burn skin defect module group rats was(70±5)%,and transplantation group rats was(20±5)%.ConclusionThe fibrinous membrane with autologous epidermal cells can be used to cover large area skin defect caused by burn,and can prevent scar formation,reduce wound shrinkage rate,to acceler⁃ate wound healing,thus playing an important role in curing large burn skin defect.
Wistar rats;burn;fibrinous membrane with autologous epidermal cells;transplant
Q95-33;R644
A
1007-6948(2013)06-0660-05
10.3969/j.issn.1007-6948.2013.06.016
天津市儿童医院外科(天津 300074)
崔华雷,E-mail:chzy001@126.com
