异甘草酸镁注射液与5种输液配伍的稳定性考察
2013-03-06
(浙江省丽水市人民医院,浙江 丽水 323000)
异甘草酸镁注射液是用于治疗慢性肝炎的国家一类新药,为传统中药甘草中的单一立体异构体,属于肾上腺皮质激素类药。经动物试验及临床前药效、药理和毒理研究表明,异甘草酸镁对四氯化碳、D-氨基半乳糖及硫代乙酰胺引起血清丙氨酸氨基转移酶(ALT)、天门冬酸氨基转移酶(AST)的升高具有明显降低作用,可显著减轻 D-氨基半乳糖对肝脏的形态损伤,改善免疫因子对肝脏形态的慢性损伤,具有较强的抗炎、保护肝细胞及改善肝功能作用,是一种疗效优于其天然异构体、毒性小、安全性大的高纯度药物[1]。为促进临床安全用药,探讨异甘草酸镁注射液与不同输液配伍的变化,对其进行了稳定性考察。现报道如下。
1 仪器与试药
梅特勒-托利多SevenMulti型pH测试仪(瑞士Mettler公司);GWJ-4型智能微粒检测仪(天津市天大天发科技有限公司);UV-2550型紫外-可见分光光度计(日本岛津);YJ-1450SDB医用净化工作台(苏州净化设备总厂);SW-CJ-IB净化工作台(苏州净化设备总厂);一次性无菌注射器(批号为120411-7,浙江灵洋医疗器械有限公司)。
异甘草酸镁注射液(江苏正大天晴药业股份有限公司,批号为120302104,规格为10 mL∶50 mg);0.9%氯化钠注射液(NS,批号为 20120419,规格为 250 mL∶2.25 g),5%葡萄糖注射液(5%GS,批号为 20120420,规格为 250 mL ∶12.5 g),10% 葡萄糖注射液(10%GS,批号为 20120423,规格为 250 mL ∶25 g),5% 葡萄糖氯化钠注射液(5%GNS,批号为20120416,规格为250 mL:葡萄糖12.5 g与氯化钠2.25 g),均为浙江国镜药业有限公司产品;果糖注射液(批号为12032496,规格为250 mL∶25 g,安徽丰原药业股份有限公司)。
2 方法与结果
2.1 供试品溶液配制
在本院静脉用药配置中心的净化环境下,按临床常用浓度,将异甘草酸镁注射液20 mL分别加入0.9%NaCl,5%GS,10%GS,5%GNS及果糖注射液中,作为测定用液。
2.2 稳定性考察
取供试品溶液置室内温度(27℃)条件下,分别于0,1,2,3,5 h时进行外观、pH、微粒及紫外吸收光谱检查,考察溶液稳定性。
外观:随静置时间增加,配伍后各混合溶液颜色无明显变化,且溶液澄清,无可见异物。说明混合溶液在各时间点外观上无明显不稳定现象。
pH:将pH测试仪以磷酸盐标准缓冲液和苯二甲酸盐标准缓冲液校准,斜率为97.6%,在各时间点依次测定。结果见表1。
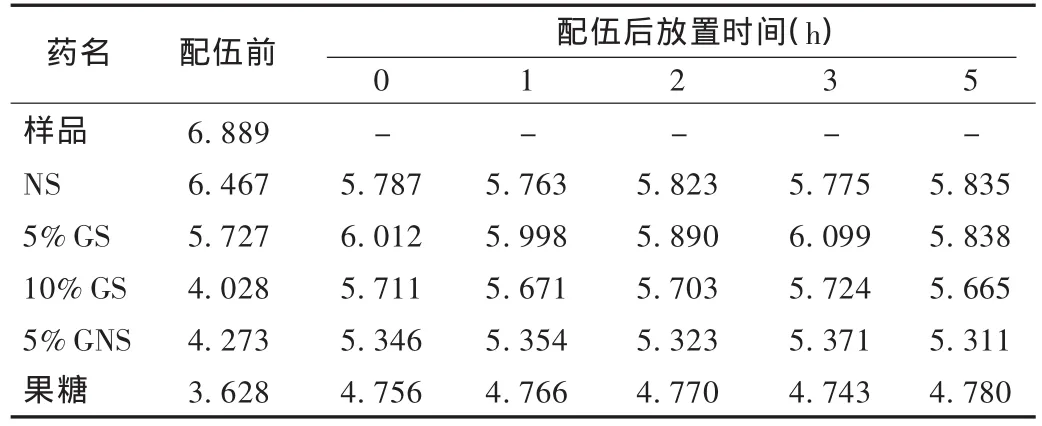
表1 样品与5种输液配伍前后的pH比较
微粒数:在净化工作台上,用纯净水反复冲洗测定杯,分别取样品,NS,5%GS,10%GS,5%GNS 及果糖注射液 40 mL,用微粒检测仪按照不溶性微粒检查法[2010年版《中国药典(二部)》附录ⅨC)[2]检查,测定4次,取后3次的结果计算平均值,测出每1 mL中直径不小于10 μm或不小于25μm的微粒数,作为空白对照。同法,取供试品溶液,依次在各时间点,测定配伍后的微粒数。结果见表2。
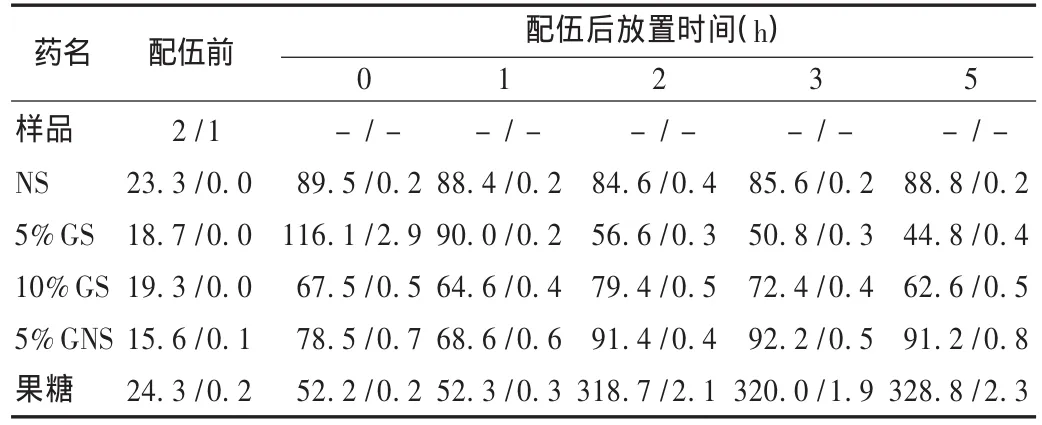
表2 样品与5种输液配伍前后的微粒数(个/mL,≥10 μm/≥25 μm)
紫外吸收光谱:取供试品溶液,以蒸馏水作空白对照,在200~300 nm波长范围内扫描,并在各时间点依次测定。结果显示,溶剂为果糖注射液的输液紫外吸收光谱与其余4种溶剂的输液略有差别,而其余4种溶剂都有2个相似的紫外吸收波长。可见,异甘草酸镁注射液与5种输液配伍后的紫外吸收光谱无显著变化,详见表3。
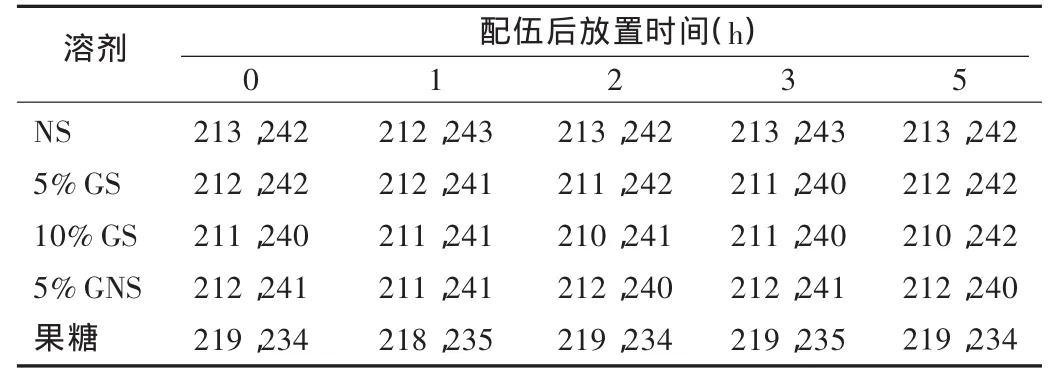
表3 样品与5种输液配伍后的吸光度
3 讨论
配伍前,异甘草酸镁注射液与5种输液的pH及微粒测定结果均符合《中国药典》的相关规定。配伍后置室内温度(27℃)下0,1,2,3,5 h,各配伍液外观未见明显变化;pH 有所变化,但无明显差异;紫外吸收光谱无显著变化;配伍后不同直径的不溶性微粒明显增加,特别是刚配制好时。刚配制好的输液,微粒数特别多,可能与气泡有关,因为微粒检测仪不能分辨气泡和微粒。因此,输液配制完毕后,应静置后输注较好。随着配置时间的延长,以果糖注射液为溶剂的输液微粒数增加非常明显,其紫外吸收波长也与其他4种溶剂有差异,因此建议临床避免选择果糖注射液作为异甘草酸镁的溶剂。
注射液不溶性微粒是指除气泡外,随机存在于液体制剂包括灭菌粉针剂所制成的液体中可流动的、不溶性外来物质,粒径在50 μm以下,肉眼看不见,在机体内不能代谢,但可引起肉芽肿、静脉炎、过敏反应、热原样反应、血栓、组织坏死、肿瘤样反应等[3]。采用光阻法测定不溶性微粒,操作简便、快速,是《中国药典》的首选方法[2]。但药典中仅控制静脉用注射剂中不溶性微粒的大小及数量,对药物配制后的输液未作要求,也无具体的限量规定。然而,药物复配过程的各个环节都可能影响到不溶性微粒。从本试验可看出,复配后的微粒远远超过药物本身的累加作用,可能来源于注射器、配药环境以及药物的性质和药物间的相互作用。
虽然人体对不溶性微粒有一定的耐受力,但不同体质、不同年龄、不同种族的人群是不一样的。不溶性微粒引起的临床输液反应不容忽视,在临床应用中应予以重视,尽量减少配液过程中的不溶性微粒,以提高临床静脉给药的质量,确保临床用药安全。
[1]李肖玲,孙 黎,沈金芳.异甘草酸镁注射液正常人体耐受性试验[J].中国药房,2006,17(4):279.
[2]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:附录71.
[3]孙冲环,杨文清,陈玲玲.静脉注射液中药物配伍后不溶性微粒的考察[J].中国药业,2011,20(5):41-42.
