过表达HMGA2对人垂体生长激素腺瘤细胞增殖及周期的影响*
2013-03-04范月超颜丙超陈洪福纪建永梅鹏金
范月超,颜丙超,陈洪福,纪建永,张 慧,梅鹏金
(徐州医学院附属医院颅底肿瘤外科,江苏徐州221006)
垂体瘤是一种颅内常见的良性肿瘤,约占中枢神经系统肿瘤的15%~20%[1]。高迁移率族蛋白A2(high-mobility-group A2,HMGA2)是非组蛋白染色体蛋白,属于高迁移率族 A(high-mobility-group A,HMGA)家族,在垂体瘤组织及体外培养细胞中高表达[2-3]。HMGA2过表达是许多良性和恶性肿瘤的标志,是一个预后不良的指标。原代培养的人垂体生长激素腺瘤细胞,在性质和特点上更接近于肿瘤在人体的原始状态,因此,其在生物治疗或实验中的效果和作用更接近于体内肿瘤细胞对生物试剂的反应。本实验采用HMGA2过表达质粒转染人垂体生长激素腺瘤细胞,观察HMGA2蛋白过表达对人垂体生长激素腺瘤细胞增殖及周期的影响。
1 材料与方法
1.1 材料 HMGA2质粒(pIRES2-dsRed-HMGA2cDNA)、空载体(pcDNA3.1)(上海艾博斯公司合成),DMEM高糖培养基(Thermo公司),胎牛血清(杭州四季青公司),0.25%胰酶(碧云天公司),羟乙基哌嗪乙硫磺酸(HEPES)(Gibco公司),Lipofectamine 2000转染试剂(美国Invitrogen公司),HMGA2一抗(Santa Cruz公司),山羊抗兔IgG(北京中杉金桥)。CCK-8细胞增殖检测试剂盒(日本同仁公司),细胞周期检测试剂盒(南京凯基公司)。
1.2 方法
1.2.1 实验分组 实验细胞分为:转染组(转染pIRES2-dsRed-HMGA2cDNA质粒)和空载体组(转染pcDNA3.1空载质粒)。
1.2.2 细胞培养 原代垂体生长激素腺瘤细胞的培养采用机械分离法[1]分离垂体瘤细胞:手术切除的垂体腺瘤组织在无菌操作下放入无血清DMEM培养基中立即送往实验室超净台内无菌PBS冲洗2次去除结缔组织、坏死组织及血块,将标本用眼科剪剪碎成1mm3大小组织块加5倍量的0.25%胰酶(预热至37℃),在37℃条件下消化30min,每隔5min用吸管吹打分散1次,待细胞分散良好以后加入5倍量的细胞培养基(dulbecco′s modified eagle medium,DMEM)(内含105U/L青霉素,0.1g/L链霉素,2.2g/L NaHCO3,2.0g/L HEPES,10% 胎牛血清)终止消化5min,经100目细胞滤器过滤后,1 000r/min离心10min弃上清液加入DMEM培养基使细胞重悬并分散,成功获得稳定生长垂体瘤细胞株后,DMEM培养基(含10%胎牛血清)、37℃、5%CO2饱和湿度培养箱中常规培养,以第3代原代培养细胞作为实验对象。
1.2.3 质粒转染 pIRES2-dsRed-HMGA2cDNA质粒由上海艾博斯生物科技有限公司合成并测序,将处于对数生长期的细胞接种于60mm小皿中,待细胞处于70%~90%融合时,pIRES2-dsRed-HMGA2cDNA质粒及空载体质粒分别转染,并严格按照Lipofectamine 2000转染试剂说明书进行。
1.2.4 免疫印迹法(Western blot)检测 HMGA2蛋白表达水平 转染24h后收集两组细胞,加入细胞组织快速裂解液RIPA置于冰上裂解,4℃、15 000g/min离心15min,收取上清液即总蛋白;加入5×十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液,100℃煮沸变性5min;通过10%SDS-PAGE分离,转至硝酸纤维素(nitrocellulose filter membrane,NC)膜上加入一抗兔抗人HMGA2及兔抗人β-actin抗体(1∶500),4℃孵育过夜;复温30min,洗涤缓冲液(washing buffer)洗涤 5min,3次,加入稀释的二 抗 (1∶1 000),室温下孵育2h;然后四唑硝基蓝(BCIP)和碱性磷酸酶显色试剂(NBT)显色。用Image J软件检测各条带灰度值,计算HMGA2蛋白的相对表达水平。
1.2.5 细胞增殖实验(cell counting kit-8,CCK-8)法[4-6]检测转染组及空载体组垂体生长激素腺瘤细胞增殖情况 0.25%胰酶消化转染组及空载体组垂体生长激素腺瘤细胞,96孔板每孔铺3 000个细胞、每组设4个复孔,每孔加DMEM完全培养基(含10%胎牛血清)100μL,四周加磷酸盐缓冲液(phosphate-buffered saline,PBS)液体防止水分蒸发;置37℃、5%CO2培养箱中培养24、48、72、96h;每孔加入无血清培养基100μL,CCK-8溶液10μL,空白对照孔只加等量无血清培养基和CCK-8溶液,混匀两种液体,避光操作;放入培养箱中继续孵育0.5、1、2、4h;酶标仪检测在450nm波长下的光密度(optical density,OD)值。
1.2.6 流式细胞仪检测转染组及空载体组垂体生长激素腺瘤细胞周期变化 0.25%胰酶消化转染组及空载体组垂体生长激素腺瘤细胞后离心收集细胞,用预冷PBS洗涤细胞1次(2 000r/min离心5min)收集并调整细胞浓度为1×106/mL;然后用70%乙醇4℃固定过夜;次日,离心收集细胞,用预冷的PBS洗涤细胞2遍,小心吸出上清液,可以残留约50μL左右的PBS,避免吸走细胞,轻轻弹击离心管底适当分散细胞,避免细胞成团;加100μL核糖核酸酶 A(ribonuclease A,RNaseA)(20μg/mL)37℃水浴30min;再加入400μL碘化丙啶 (propidium iodide,PI)(50μg/mL)染 色 混 匀,4 ℃ 避 光30min,然后用流式细胞仪检测[7-8]。
1.3 统计学处理 采用SPSS16.0软件进行数据处理,所有数据均用±s表示,两组间比较采用两样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 Western blot检测HMGA2蛋白的表达情况 使用Image J软件测定两组蛋白条带的灰度值。结果显示,转染组HMGA2蛋白表达较空载体组高,差异有统计学意义(P<0.05),表明HMGA2质粒转染成功,见图1。
2.2 CCK-8实验结果 实验中在24、48、72、96h4个时间点转染组细胞OD值均较空载体组细胞OD值大,差异均有统计学意义(P<0.05)。实验结果显示垂体生长激素腺瘤细胞转染HMGA2质粒后细胞增殖能力较空载体组明显增加,差异有统计学意义(P<0.05),细胞生长曲线见图2。
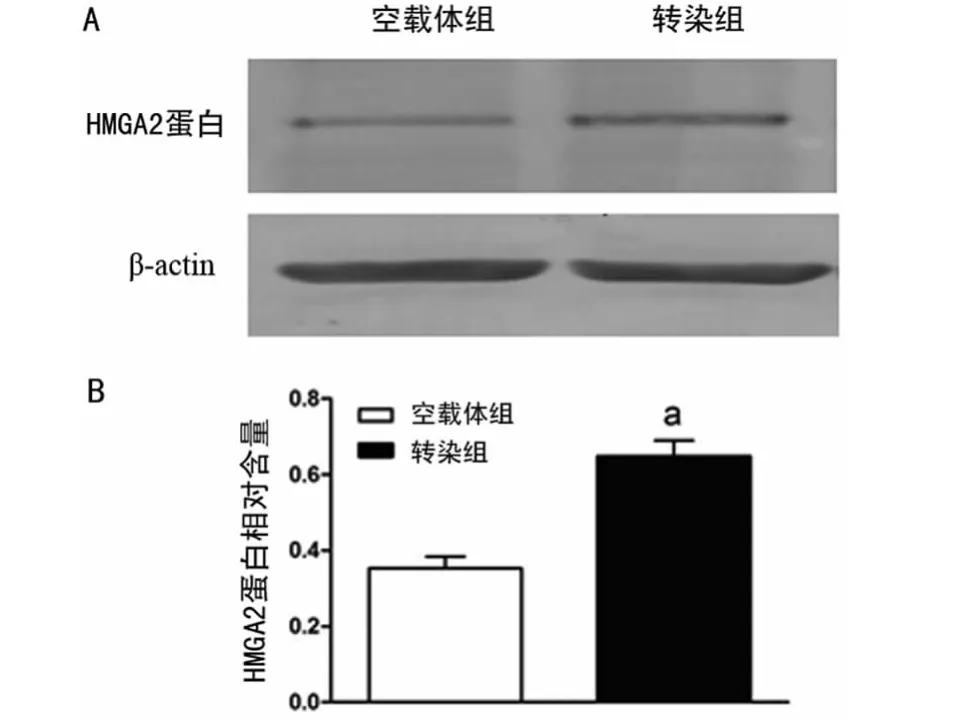
图1 Western blot分析两组HMGA2蛋白的表达情况
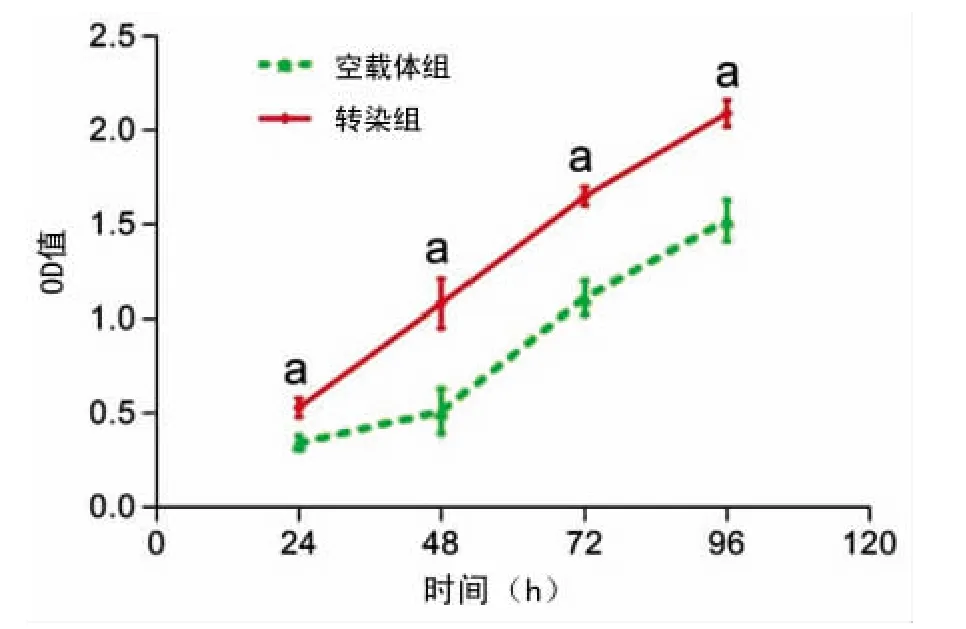
图2 垂体生长激素腺瘤细胞生长曲线
2.3 流式细胞仪检测垂体生长激素腺瘤细胞周期变化结果与空载体组相比,转染组垂体生长激素腺瘤细胞周期发生明显变化,G0/G1期细胞所占比例减少,S期细胞所占比例增加,差异有统计学意义(P<0.05);两组细胞G2期细胞所占比例差异无统计学意义(P>0.05),见表1。
表1 不同质粒转染后对垂体生长激素腺瘤细胞周期的影响(±s,%,n=3)
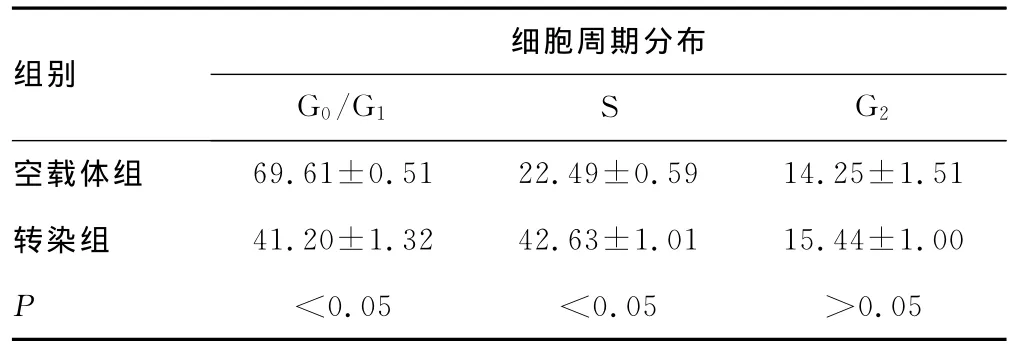
表1 不同质粒转染后对垂体生长激素腺瘤细胞周期的影响(±s,%,n=3)
组别细胞周期分布G0/G1 S G2 69.61±0.51 22.49±0.59 14.25±1.51转染组 41.20±1.32 42.63±1.01 15.44±1.00 P<0.05 <0.05 >0.05空载体组
3 讨 论
HMGA2属于高迁移率族家族HMGAs。该家族的成员还包括HMGA1a、HMGA1b和HMGA1c,它们均含有3个N端“AT-钩”基序,通过这一结构可以优先地结合B型DNA中富含AT的序列,进而诱导构象变化促进增强子中转录因子复原。HMGA2蛋白参与许多生物不同生理过程,如调节转录、胚胎发生、分化、致瘤性转化以及病毒基因组的整合和表达[9]。
由于HMGA2编码基因位于许多肿瘤细胞染色体断裂点的簇集区,所以它的异常表达与肿瘤发生有关。HMGA1和HMGA2的高水平表达与肿瘤高度恶性表现型、转移和低生存率有关,因此是一个不良预后指标[10]。最近研究证实 HMGA2与多种上皮源性恶性肿瘤的转化、生长和分化密切相关[11],如甲状腺癌、乳腺癌、口腔鳞癌及非小细胞肺癌。Piscuoglio等[12]发现在正常胰腺组织、胰腺上皮内瘤变和侵袭性胰腺癌中HMGA1和HMGA2的平均表达量逐渐增加,与肿瘤的恶性级别及进展呈正相关,并与新生物的分化和淋巴结转移高度相关。
本实验结果显示转染HMGA2过表达质粒的垂体生长激素腺瘤细胞增殖能力较空载体组增强(P<0.05),过表达HMGA2促进了垂体生长激素腺瘤细胞增殖。流式细胞仪检测细胞周期结果显示转染组G1期细胞所占比例较空载体组明显减少,而S期细胞所占比例明显增加,可能与HMGA2调节下游相关蛋白有关,研究表明HMGA2通过增强E2F转录因子1活性诱导垂体肿瘤发生[13]。HMGA2与视网膜母细胞瘤蛋白(pRB)相互作用,取代了磷酸化视网膜母细胞瘤蛋白/E2F转录因子1(pRB/E2F1)复合物中的组蛋白脱乙酰基酶1(HDAC1),增加了E2F1乙酰化和转录活性。除此之外HMGA2还可以直接作用于E2F1敏感元件,增强E2F1与DNA结合能力。与上述结果一致,HMGA2转基因和E2F1基因敲除杂交鼠中E2F1活性功能性的丢失明显的减少了垂体腺瘤的发生率[13]。垂体特异性转录因子-1(pit-1)是一个与垂体细胞发育和分化有关的转录因子,其高表达是人类生长激素(GH)和催乳素(PRL)腺瘤的一个恒定特点,有研究表明HMGA2蛋白可以结合pit-1及其敏感DNA元件,以此正向调节pit-1启动子,同时HMGA2还可以与pit-1协同作用,促进pit-1表达上调[14]。研究证明,在HMGA转基因鼠垂体腺瘤中,HMGA蛋白正向调控pit-1转录,诱导垂体肿瘤中pit-1过度表达[15]。此外,HMGA2还可以上调CCNB2基因诱导垂体瘤发生。CCNB2可以编码周期蛋白B2,它是B型周期蛋白家族的一员,是细胞周期调节装置的主要成分,HMGA2蛋白主要通过结合细胞周期蛋白B2基因启动子,上调其活性,诱导垂体瘤发生[16]。本实验中HMGA2过表达促进垂体生长激素腺瘤细胞增殖并且促进G1期进展,表明过表达HMGA2在垂体肿瘤发生中具有重要作用,具体机制有待进一步实验证实。
本实验基于成功培养原代垂体生长激素腺瘤细胞后进行,其性质和特点上更接近于肿瘤在人体原始状态,这为垂体腺瘤的生物治疗提供了新的治疗靶点,同时也为垂体腺瘤机制的进一步探索提供了基础。
[1]徐伟光,王海军,黄锦桃,等.人垂体腺瘤细胞原代培养的纯化及其激素的表达与分泌[J].中山大学学报:医学科学版,2006,27(1):7-10.
[2]D′Angelo D,Palmieri D,Mussnich P,et al.Altered microRNA expression profile in human pituitary GH adenomas:down-regulation of miRNA targeting HMGA1,HM-GA2,and E2F1[J].Clin Endocrinol Metab,2012,97(7):E1128-1138.
[3]Palmieri D,D′Angelo D,Valentino T,et al.Downregulation of HMGA-targeting microRNAs has a critical role in human pituitary tumorigenesis[J].Oncogene,2012,31(34):3857-3865.
[4]项颖,李启英,王莉,等.DC-CIK细胞对人肝癌HepG2细胞增殖、迁移的影响[J].重庆医学,2013,42(14):1571-1574.
[5]Du Y,Yan L,Wang J,et al.β1-Adrenoceptor autoantibodies from DCM patients enhance the proliferation of T lymphocytes through theβ1-AR/cAMP/PKA and p38 MAPK pathways[J].PLoS One,2012,7(12):e52911.
[6]田昕,罗颖,闫永波,等.蟾蜍灵对人食管癌鳞癌EC9706细胞增殖及凋亡的影响[J].中国医学科学院学报,2012,34(6):556-562.
[7]Abe R,Beckett J,Abe R,et al.Olive Oil Polyphenols Differentially Inhibit Smooth Muscle Cell Proliferation through a G1/S Cell Cycle Block Regulated by ERK1/2[J].Int J Angiol,2012,21(2):69-76.
[8]Li Y,Li D,Yuan S,et al.Embelin-induced MCF-7breast cancer cell apoptosis and blockade of MCF-7cells in the G2/M phase via the mitochondrial pathway[J].Oncol Lett,2013,5(3):1005-1009.
[9]Qian ZR,Asa SL,Siomi H,et al.Overexpression of HMGA2relates to reduction of the let-7and its relationship to clinicopathological features in pituitary adenomas[J].Modern Pathol,2009,22(3):431-441.
[10]Fusco A,Fedele M.Roles of HMGA proteins in cancer[J].Nat Rev Cancer,2007,7(12):899-910.
[11]Lee YS,Dutta A.The tumor suppressor microRNA let-7 represses the HMGA2oncogene[J].Genes Dev,2007,21(9):1025-1030.
[12]Piscuoglio S,Zlobec I,Pallante P,et al.HMGA1and HMGA2protein expression correlates with advanced tumour grade and lymph node metastasis in pancreatic adenocarcinoma[J].HistoPathology,2012,60(3):397-404.
[13]FedeleM,Visone R,De Martino I,et al.HMGA2induces pituitary tumorigenesis by enhancingE2F1activity[J].Cancer Cell,2006,9(6):459-471.
[14]Fedele M,Palmieri D,Fusco A.HMGA2:A pituitary tumour subtype-specific oncogene?[J]Mol Cell Endocrinol,2010,326(1-2):19-24.
[15]Palmieri D,Valentino T,De Martino I,et al.PIT1upregulation by HMGA proteins has a role in pituitary tumorigenesis[J].Endocr Relat Cancer,2012,19(2):123-135.
[16]De Martino I,Visone R,Wierinckx A,et al.HMGA proteins up-regulate CCNB2gene in mouse and human pituitary adenomas[J].Cancer Res,2009,69(5):1844-1850.
