农杆菌介导大豆未成熟子叶节的遗传转化
2013-03-02王林红乔亚科崔姗姗纪展波李桂兰
钟 磊,王林红,乔亚科,崔姗姗,纪展波,李桂兰
(河北科技师范学院生命科技学院,河北秦皇岛,066600)
大豆是公认的较难进行遗传转化的植物之一。农杆菌介导的大豆遗传转化是最早被开发出来并且是目前应用最广泛的一种转基因技术[1],该法具有操作简单,费用低廉,可插入基因片段大,不容易发生重排等优点。农杆菌转化所用的外植体主要有子叶节[2~6]、无菌苗的茎尖[7]、未成熟胚子叶[8]、上胚轴和初生叶[9]、子叶[10]、成熟胚的胚尖[11]、未成熟胚体细胞胚[12]等,而对利用未成熟大豆种子子叶节的转化研究报道则较少。笔者以不同大豆品种的未成熟种子子叶节为转化受体,研究其遗传转化影响因素,为提高大豆遗传转化效率提供依据。
1 材料和方法
1.1 材料
供试大豆品种:冀豆7号,豫豆22,九农26,郑97196,品系10,品系12。
植物表达载体:pX6PTF1(河北农业大学张彩英研究员提供)[13]。
1.2 方法
1.2.1 外植体的制备 选取开花后不同发育时期的大豆豆荚,清水冲洗表面,体积分数为0.75的酒精消毒1 min,无菌水冲洗1次,质量浓度为1.0 g/L的氯化汞溶液消毒10 min,无菌水冲洗3次。无菌条件下取出未成熟种子,灭菌的液体共培养基(或无菌蒸馏水)浸泡15 min,去掉种皮,将2片子叶从胚轴纵切,去除幼芽和胚尖。
1.2.2 菌液制备 挑取工程菌的单菌落,接种到链霉素、壮观霉素质量浓度为50 mg/L的LB液体培养基中,180 r/min,28 ℃振荡培养 2~3 d至OD600=0.6~0.8。随后吸取OD600=0.6~0.8 菌液,接种到新鲜的LB液体培养基中,28℃培养至OD600=0.3~0.5。将菌液5 000 r/min,4℃离心10 min,弃上清,沉淀重悬于与共培养基成分相同的液体培养基中,调整菌液浓度至OD600=0.3~0.5,备用。
1.2.3 共培养 将制备好的农杆菌菌液侵染外植体30 min,接种到共培养基,24℃恒温培养4 d。
1.2.4 抗性植株再生 共培养后经抗性芽诱导、伸长、生根、移栽和驯化后获得抗性植株。
1.3 试验设计
1.3.1 子叶节预处理试验 以冀豆7为材料,对所取材料分别进行如下预处理:处理1,对去除荚皮的种子在4℃下处理24 h,切制子叶节;处理2,将豆荚在4℃低温处理24 h,然后消毒后除去豆荚皮切制子叶节;处理3,取新鲜豆荚直接去荚皮后切制子叶节。
1.3.2 共培养温度试验 以开花60 d的冀豆7未成熟种子为材料,共培养温度设置3个处理:22,24,26℃。
1.3.3 共培养光照试验 以开花60 d的冀豆7未成熟子叶节为外植体,共培养时设置3个光照长度处理:0,16,24 h/d。
1.3.4 不同品种试验 以豫豆22,冀豆7号,郑97196,九农26,品系10和品系12为受体品种,取开花60 d的未成熟种子制备子叶节外植体。
每个单因素试验中每个处理切制外植体50个,3次重复。
1.4 数据统计分析
数据应用DPSv 7.05版统计软件进行统计分析。
2 结果与分析
2.1 种子成熟度对大豆未成熟子叶节转化抗性芽诱导的影响
以冀豆7号为材料,分析开花后50,60,67 d未成熟种子子叶节外植体的芽诱导率发现,以开花后60 d,种子达到最饱满程度所制备的外植体抗性芽诱导率和平均抗性芽数最高,与开花后50 d的和开花后67 d的差异均达到极显著(表1);而开花后50 d的未成熟子叶节经诱导后易产生愈伤组织,抗性芽数量较少;开花后67 d的种子由于已经开始缩水变小,故抗性芽率和平均抗性芽数出现下降现象。

表1 大豆未成熟种子发育程度对遗传转化的影响
2.2 外植体低温预处理对大豆未成熟子叶节转化抗性芽诱导的影响
分析3种外植体预处理方法对抗性芽诱导率的影响发现,以不经过预处理的新鲜材料抗性芽诱导率最高,达到55.9%,与其他2个处理差异显著(p<0.01);而经过4℃低温预处理24 h的抗性芽诱导率较低,二者差异不显著(p>0.05)。说明24 h的4℃低温处理对未成熟种子的子叶节遗传转化不利(图1)。
2.3 共培养温度对大豆未成熟子叶节转化抗性芽诱导的影响
分析不同共培养温度条件下的抗性芽诱导率发现,在一定温度范围内,随共培养温度的上升,未成熟子叶节的平均出芽数呈现上升趋势,在3个处理温度中,以26℃条件下的未成熟胚的平均抗性芽个数最高(图2)。但是3个温度处理之间差异不显著。
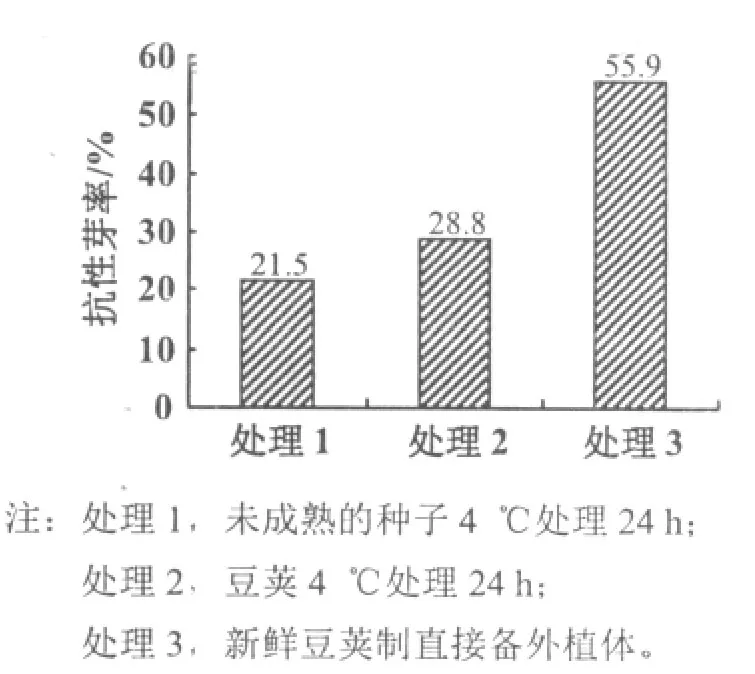
图1 不同预处理对大豆未成熟种子遗传转化的影响
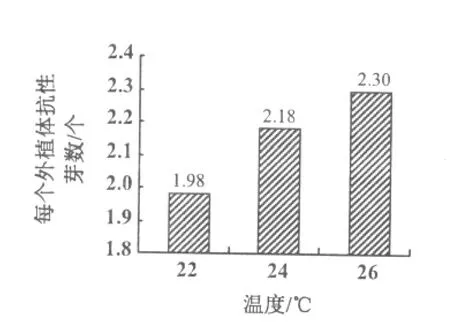
图2 共培养温度对大豆未成熟子叶节出芽的影响
2.4 共培养阶段光照对大豆未成熟子叶节转化抗性芽诱导的影响
分析不同光照时间对大豆子叶节转化抗性芽诱导的影响表明,在共培养阶段提供一定时间的光照对大豆未成熟子叶节转化有促进作用(表2)。光照处理的大豆子叶节共培养后颜色变成深绿色,其抗性芽出芽率和平均出芽数都有所提高。提供光照24 h/d的处理,子叶节抗性芽诱导率最高,为56.64%,平均出芽数也达到2.27个,并与其他2个处理差异显著。

表2 共培养阶段光照时间对大豆未成熟子叶节遗传转化的影响
2.5 大豆基因型对未成熟子叶转化抗性芽诱导的影响
分析不同品种抗性芽诱导率发现,以冀豆7号,豫豆22和品系12的每个外植体的平均抗性芽数较高,达到2.11~2.18,3个品种之间差异不显著;冀豆7号,豫豆22和品系12均与九农26,郑97196,品系10之间差异达到显著水平(p<0.05)(图3)。九农26不仅出芽率低,而且易出现畸形芽,成苗率最低。
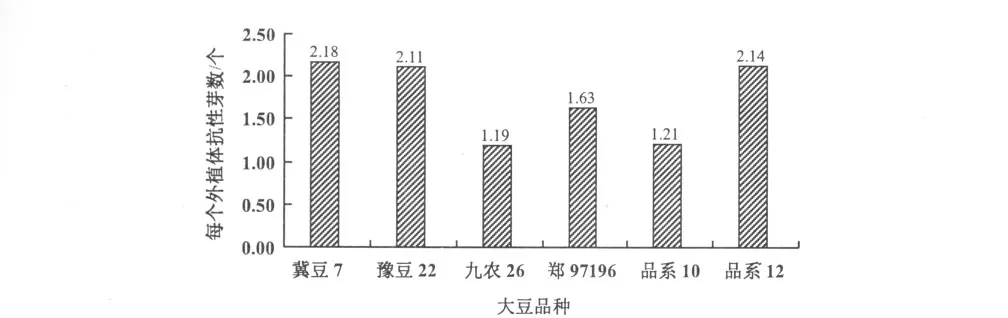
图3 不同大豆品种未成熟种子子叶节遗传转化比较
3 结论与讨论
在遗传转化过程中抗性芽形成是获得转基因苗的前提。王卢平等[14]研究表明,当豆荚及种子发育到最大、鼓粒饱满、种皮变黄时,未成熟种子子叶节不定芽诱导率最高。本研究在农杆菌介导的转化体系中也得到一致的结果,以豆荚和种子体积发育到最大(开花后60~66 d),豆荚开始由绿色变黄时,未成熟子叶节的抗性芽率和平均抗性芽值都达到最高。
转化过程中共培养阶段的外部环境条件直接影响着农杆菌的侵染及T-DNA的转移,同时也影响着受体细胞的感受状态。本研究表明,从大豆植株上取的新鲜豆荚直接制备外植体,不经过预处理,产生的抗性芽数最多;转化过程中,在26℃,24 h/d光照共培养条件下获得较高的抗性芽产生率。已有研究表明,在大豆成熟种子的子叶节转化系统中,不同大豆基因型对农杆菌的敏感性存在着差异[15]。在本研究中,未成熟大豆子叶节转化也存在着基因型差异,冀豆7,豫豆22和品系12的未成熟子叶抗性芽率较高。
大豆未成熟种子子叶节作为遗传转化外植体,具有取材方便、简化遗传转化外植体制备过程的优点,本研究仅就部分影响因素进行了初步探讨,建立一个完善的大豆未成熟子叶节转化体系尚需进行深入研究。
[1] HINCHEE M A W,CONNOR-WARD D V,NEWELL C A,et al.Production of transgenic soybean plants usingAgrobacterium-mediated DNA transfer[J].Bio/Technology,1988,6:915-922.
[2] 刘博林,徐民新.两个栽培大豆品种的体细胞胚胎发生和植株再生研究[J].中国油料作物学报,1999,21(2):11-13.
[3] CHENG T Y,SAKA H V.Plant regeneration from soybean cotyledon node segments in cultures[J].Plant Science Letters,1980,19:91-99.
[4] ZHANG Z Y,XIANG A Q,STASWICK Q.The use of glufosinate-arm-monium as a selective agent inAgrobacterium-mediated transformation of soybean[J].Plant Cell,Tissue and Organ Culture,1999,56:37-46.
[5] YAMADA T,WATANABE S,ARAI M,et al.Cotyleonary node prewounding with a micro-brush increased frequency ofAgrobacterium-mediated transformation in soybean[J].Plant Biotechnology,2010,27:217-220.
[6] PAZ M M,MARTINEZ J C,KALVIG A B,et al.Improved cotyledonary node method using an alterntive explants derived from mature seed for efficient Agrobacterium mediated soybean transformation[J].Plant Cell Reports,2006,25:206-213.
[7] KARTHA K K,K Pahl,N L Leung,et al.Plant regeneration from meristems of grain legumes:soybean,cowpean,peanut,chickpea and bean[J].Can J Bot,1981,59:1 671-1 679.
[8] BARWALE U B,KEMS H R,WIDHOLM J M.Plant regenerating from callus cultures of several soybean genotypes via embryogensis and organogenesis[J].Planta,1986,167:473-481.
[9] WRIGHT M S,WARD D V,HINCHEE M A,et al.Regeneration of soybean(Glycine maxL.Merr)from cultured primary leaf tissue[J].Plant cell Reports,1987,6:83-89.
[10] SETH M,RALPH S,JOHN C.A simple rapid protocol for adventitious shoot development from mature cotyledons of(Glycine max)cv Bragg[J].In Vitro Cellular and Devepmental Biology,1989,25(4):385-388.
[11] LIU Hai-kun,YANG Chao,WEI Zhi-ming.EfficientAgrobacterium tumefaciens-mediated transformation of soybeans using an embryonic tip regeneration system[J].Planta,2004,219:1 042-1 049.
[12] KO T S,LEE S,FARRAND S K,et al.A partially disarmed vir helper plasmid,pKYRT1,in conjunction with 2,4-dichlorophenoxyacetic acid promotes emergence of regenerable transgenic somatic embryos from immature cotyledons of soybean[J].Planta,2004,218:536-541.
[13] 郑醒,张彩英,常文锁,等.转录因子GmPTF1表达载体构建及转化大豆研究[J].华北农学报,2011,26(6):27-31.
[14] 王卢平,乔亚科,李桂兰,等.大豆未成熟种子子叶节不定芽再生的初步研究[J].大豆科学,2011,30(3):369-373.
[15] 姬月梅,张银霞,宋晓华.农杆菌介导大豆遗传转化的研究进展[J].农业科学研究,2009,30(1):47-50.
(责任编辑:朱宝昌)
