非动脉炎性前部缺血性视神经病变患者脑白质病变风险因素分析
2013-03-02田国红贾楠江汉秋卢宁张晓君
田国红 贾楠 江汉秋 卢宁 张晓君
·神经眼科专题·
非动脉炎性前部缺血性视神经病变患者脑白质病变风险因素分析
田国红 贾楠*江汉秋*卢宁**张晓君*
目的通过对非动脉炎性前部缺血性视神经病变(NAION)患者脑白质高信号(WMH)进行分级评估,发现其与血管风险因素的相关性。方法临床病历回顾性分析。入组2006年1月~2009年12月确诊NAION且完成了颅脑磁共振成像(MRI)检查的患者,使用年龄相关脑白质评分(ARWMC)半定量分析脑白质病变程度,将脑部显示有WMH患者与无WMH患者进行血管风险因素比较。结果入组127例NAION患者中,平均年龄(51.97±8.97)岁,男性占72%。86例患者存在WMH(67.7%),其中72.1%的损害位于脑白质,仅16.3%位于深部灰质。绝大多数WMH(91.7%)为1级损害。Logistic回归分析显示,年龄、高胆固醇血症、心电图非特异性ST-T改变与脑白质病变相关。结论NAION患者颅脑MRI常见脑白质病变,这些病变程度较轻,多分布于脑室周围白质。除了年龄,WMH与高胆固醇血症密切相关。他汀类降血脂药物有望作为NAION患者减少脑白质病变的预防性治疗。(中国眼耳鼻喉科杂志,2013,13:226-228,232)
非动脉炎性前部缺血性视神经病变; 白质高信号; 磁共振成像; 脑白质疏松
脑白质高信号(whitematter hyperintensities,WMH)是颅脑磁共振成像(magnetic resonance imaging,MRI)中常见的一种白质脱髓鞘改变,表现为T2加权和(或)水抑制反转成像加权序列(fluid attenuated inverse recovery,FLAIR)的信号强化,并且可以用半定量法或精确的体积测量法定量分析[1-2]。WMH在脑内的累积与认知功能障碍、痴呆、抑郁、精神行为异常、步态失衡关系密切,并且增加脑卒中的风险[3-5]。斑片状损害的病理改变是缺血后神经元脱髓鞘及胶质细胞增生。可以伴无临床症状的脑卒中。尸检结果也证实MRI上的WMH与脑穿支小动脉硬化密切相关[6]。非动脉炎性前部缺血性视神经病变(nonarteritic anterior ischemic optic neuropathy,NAION)是中老年中常见的视神经病变[7-8]。以往Arnold等[9]的研究显示,NAION患者中枢神经系统白质损害较正常对照多,但仅纳入了13例患者。我们对127例住院NAION患者进行了临床资料的回顾性分析,将脑内存在WMH的患者与无WMH的患者间血管病风险因素进行了对比,现报告如下。
1 资料与方法
1.1 资料 回顾性分析2006年1月~2009年12月北京同仁医院神经内科和眼科中心诊断NAION并收入院的患者。所有患者入院时均签署知情同意书,同意资料可匿名用于临床研究。共纳入研究127例患者,且在发病后均完成了颅脑MRI检查。NAION纳入标准包括:①突发单眼无痛性视力下降,常为晨起安静状态发病;②病史记录中急性期存在单眼视盘水肿、色淡、盘周轻微火焰状出血等相关记录;③相应的视野损害;④血沉、C-反应蛋白、HIV、HBV、ANA、VDRL排除感染及自身免疫视神经炎;⑤颅脑MRI排除压迫性视神经病变[10]。
1.2 方法 收集所有患者的人口学资料及血管病风险因素,如高血压、糖尿病、高脂血症、冠心病、房颤。实验室检查包括血糖及糖化血红蛋白、血脂全套。常规心电图结果亦纳入统计。
影像学分析:127例患者中96例在北京同仁医院影像中心使用1.5-T GE公司MRI完成了检查。使用Twinspeed扫描系统,包括T1,T2,FLAIR轴位、冠状位及T1增强扫描。31例患者颅脑MRI在外院完成,但均包括轴位T2和FLAIR序列的高质量光盘或胶片。
年龄相关性白质病变的分级(age-relate white matter change,ARWMC)用于白质脑病的半定量分析[1]。WMH定义为界限不清的≥5mm的T2或FlAIR加权高信号损害。与腔梗(定义为界限清晰的≥2 mm的高信号)鉴别。基底节区病变分级同脑白质区。
1.3 统计学处理 计量资料经正态性检验,使用均数±标准差。两组百分比资料进行卡方检验。P<0.05为差异有统计学意义。Logistic多因素回归用于分析两组血管病风险因素之间的差异。使用统计学软件SPSS 13.0。
2 结果
2.1 基本资料 127例患者平均(51.97±8.97)岁,男性占71.7%。86例患者(67.7%)脑内至少存在1个白质病变,41例(32.3%)患者未发现WMH。WMH组患者较无WMH组年龄大(P=0.001);两组性别、吸烟、高血压、糖尿病比例差异无统计学意义;WMH组患者高胆固醇血症的比例高于无WMH组;心电图ST-T改变的患者在WMH组增高(表1)。
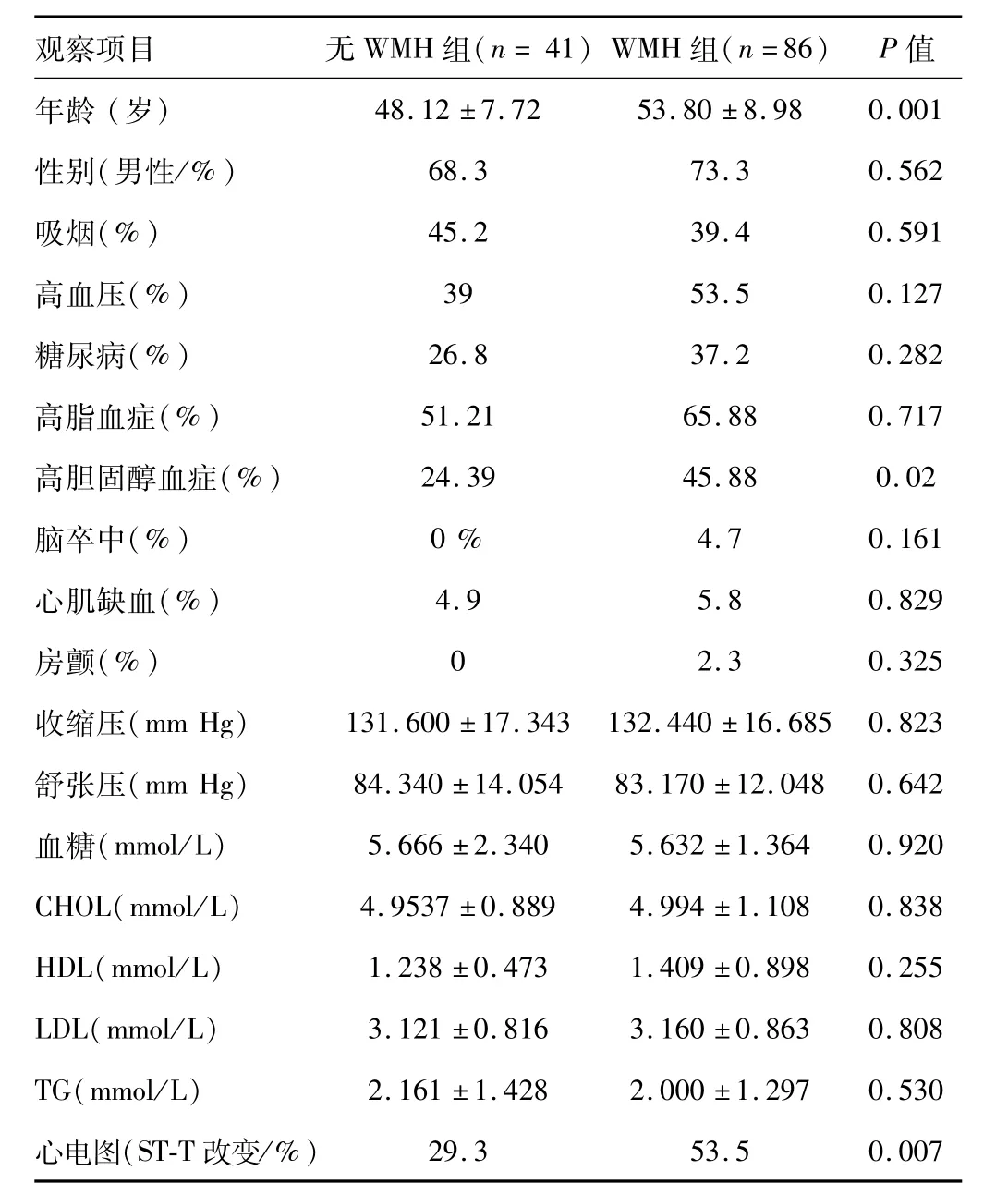
表1 WMH组患者与无WMH患者人口学及临床特征比较
2.2 脑白质病变的分布及分级 存在脑白质病变的86例患者中,62例位于脑室旁周围白质(brain white matter,WM),14例位于深部基底节区(basal ganglia,BG),另外10例患者周围白质与深部脑区均存在WMH(图1),病变程度分级显示1级病变的比例在脑室周围和基底节区分别为66/72和9/24。脑室周围无3级病灶,基底节区仅1例3级病灶,该患者为重症脑梗死。2级病灶的比例(14/24)在基底节区较高。
2.3 Logistic多因素分析 单因素分析显示年龄(P= 0.001),高胆固醇血症(P=0.02)和心电图ST-T改变(P=0.007)与WMH相关。除外年龄因素,高胆固醇血症与WMH相关。
3 讨论
NAION是年龄>50岁患者中最常见的缺血性视神经病变,发病率为2.3/100 000~10.2/100 000[8-9]。国内基于人群的流行病学调查[11]显示NAION的年发生率为1/3 200,与国外接近。NAION发病机制不明,推测为睫状后短动脉的缺血导致视神经前部梗死。这类患者常伴有系统性高血压、糖尿病及血脂异常[12-13]。
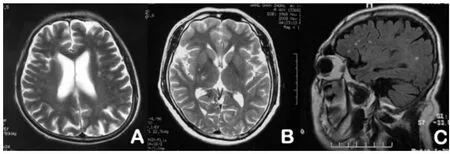
图1. 脑室旁及深部基底节区WMHA:双侧额叶散在白质脱髓鞘改变,为1级;B:基底节区1级白质病变;C:矢状位Flair加权可见散在病灶
WMH作为影像学上小动脉缺血梗死的标志,可以发生在70%年龄>65岁的无症状人群[14-16]。尸检发现小动脉硬化性胶质瘢痕增生与颅脑MRI上白质高信号相吻合。欧洲著名多中心横向联合的LADIS研究,针对脑白质病变的发生、发展,纳入年龄>65岁的老年人群,历经10年,显示WMH不仅与腔隙性脑梗死的发生密切相关,且与认知功能的减退、运动失衡、心脑血管疾病的发生呈正相关[17-18]。
Arnold等[9]首次发现NAION患者脑内白质病变较正常年龄对照增加。我们的研究也显示NAION患者的发病平均年龄仅51.97岁,较LADIS研究明显年轻,但67.7%却存在WMH,不过我们的研究缺乏相应的正常对照组。WMH的分布及严重程度分析表明,大部分病灶位于脑室周围白质,少数位于基底节区等深部脑区,且所有病变程度均较轻。
NAION患者脑内WMH表明小动脉硬化的高风险。尽管Hayreh等[19]提出NAION的发病是与脑梗死截然不同的机制。我们的结果并不排斥其低灌注的理论,相反小动脉硬化基础上夜间鼾症更易发生睫状动脉缺血,也表明NAION是有别于大、中动脉硬化的疾病,后者通常导致视网膜栓塞性疾病而不是NAION[20]。
本研究没有显示高血压、糖尿病与白质病变有密切关系,可能与该部分患者已经给予了相关治疗有关。有趣的是心电图ST-T改变与WMH关系密切,但不能排除是高血压、糖尿病等系统性疾病造成,不过也提示该群患者中存在心脏小动脉硬化情况。
我们的研究显示高胆固醇血症是唯一可控的与脑白质病变相关的风险因素。他汀类调整血脂类药物目前是卒中二级预防中除阿司匹林外最重要的减低复发风险的药物,NAION有望从他汀类药物的使用中获益。进一步的前瞻性及年龄对照研究将对明确NAION患者脑内白质病变的确切机制及他汀药物治疗提供证据。
[1]Wahlund LO,Barkhof F,Fazekas F,et al.A new rating scale for age-related white matter changes applicable to MRI and CT[J].Stroke,2001,32(6):1318-1322.
[2]Brickman AM,Sneed JR,Provenzano FA,et al.Quantitative approaches for assessment of white matter hyperintensities in elderly populations[J].Psychiatry Res,2011,193(2):101-106.
[3]Ovbiagele B,Saver JL.Cerebralwhitematter hyperintensities on MRI:Current concepts and therapeutic implications[J].Cerebrovasc Dis,2006,22(2-3):83-90.
[4]BretelerMM,van Swieten JC,BotsML,etal.Cerebralwhitematter lesions,vascular risk factors,and cognitive function in a populationbased study:the Rotterdam Study[J].Neurology,1994,44(7):1246-1252.
[5]de Leeuw FE,de Groot JC,Achten E,et al.Prevalence of cerebral whitematter lesions in elderly people:a population based magnetic resonance imaging study.The Rotterdam Scan Study[J].JNeurol Neurosurg Psychiatry,2001,70(1):9-14.
[6]Fernando MS,Ince PG.Vascular pathologies and cognition in a population-based cohort of elderly people[J].JNeurol Sci,2004,226(1-2):13-17.
[7]Hattenhauer MG,Leavitt JA,Hodge DO,et al.Incidence of nonarteritic anterior ischemic optic neuropathy[J].Am J Ophthalmol,1997,123(1):103-107.
[8]Johnson LN,Arnold AC.Incidence of nonarteritic and arteritic anterior ischemic optic neuropathy.Population-based study in the state of Missouri and Los Angeles County,California[J].J Neuroophthalmol,1994,14(1):38-44.
[9]Arnold AC,Hepler RS,Hamilton DR,et al.Magnetic resonance imaging of the brain in nonarteritic ischemic optic neuropathy[J].J Neuroophthalmol,1995,15(3):158-160.
[10]Hayreh SS,Zimmerman MB.Nonarteritic anterior ischemic optic neuropathy:natural history of visual outcome[J].Ophthalmology,2008,115(2):298-305.
[11]Xu L,Wang Y,Jonas JB.Incidence of nonarteritic anterior ischemic optic neuropathy in adult Chinese:the Beijing Eye Study[J].Eur J Ophthalmol,2007,17(3):459-460.
[12]Lee MS,Grossman D,Arnold AC,et al.Incidence of nonarteritic anterior ischemic optic neuropathy:increased risk among diabetic patients[J].Ophthalmology,2011,118(5):959-963.
[13]Miller NR.Current concepts in the diagnosis,pathogenesis,and management of nonarteritic anterior ischemic optic neuropathy[J].J Neuroophthalmol,2011,31(2):e1-3.
[14]Silbert LC,Howieson DB,Dodge H,et al.Cognitive impairment risk:whitematter hyperintensity progressionmatters[J].Neurology,2009,73(2):120-125
[15]Schmidt R,Ropele S,Ferro J,etal.LADISstudy group.Diffusionweighted imaging and cognition in the leukoariosis and disability in the elderly study[J].Stroke,2010,41(5):e402-408.
[16]Rost NS,Rahman RM,Biffi A,et al.Whitematter hyperintensity volume is increased in small vessel stroke subtypes[J].Neurology,2010,75(19):1670-1677.
[17]Gouw AA,van der FlierWM,Fazekas F,etal.Progression ofwhite matter hyperintensities and incidence of new lacunes over a 3-year period:the Leukoaraiosisand Disability study[J].Stroke,2008,39(5):1414-1420.
[18]The LADISStudy Group,Poggesi A,Pantoni L,et al.2001-2011:A decade of the LADIS(Leukoaraiosis And DISability)study:what havewe learned aboutwhitematter changes and small-vessel disease?[J]Cerebrovasc Dis,2011,32(6):577-588.
[19]Hayreh SS.Non-arteritic anterior ischemic optic neuropathy versus cerebral ischemic stroke[J].Graefes Arch Clin Exp Ophthalmol,2012,250(9):1255-1260.
[20]田国红,贾楠,王莹,等.急性缺血性视网膜病与缺血性视神经病血管危险因素比较研究[J].中华眼科杂志,2011,47(12):1076-1079.
Whitematter hyperintensities on magnetic resonance imaging in patientsw ith nonarteritic anterior ischem ic optic neuropathy
TIAN Guo-hong,JIA Nan*,JIANG Han-qiu*,LU Ning**,ZHANG Xiao-jun*.Department of Ophthalmology,Eye Ear Nose and Throat Hospital of Fudan University,Shanghai 200031,China Corresponding author:ZHANG Xiao-jun,Email:xjzhang@gmail.com
Objective To evaluate white matter lesions in brain magnetic resonance imaging(MRI)and to investigate the relationship between vascular risk factors and whitematter hyperintensities(WMH)in nonarteritic anterior ischemic optic neuropathy(NAION)patients.Methods Data of patients with NAION who had undergone brain MRI after the optic nerve ischemic attack were analyzed retrospectively.A semiquantitative visual grading scale-age-related whitematter change(ARWMC)was used to evaluate the distribution and severity of whitematter lesion in brain MRI.Logistic congress statistic methods were used to assess the relationship between multiple underlying vascular risk factors and WMH.Results One hundred and twenty seven NAION patientswere included,with themean age being(51.97± 8.97)years and the males covering 71.7%.WMH was seen in 86 subjects of NAION(67.7%).Among WMH individuals,72.1%showed lesions in brain white matter(WM)versus 16.3%in basal ganglia.Percentage of ARWMC scale 1 lesion was 91.7%in WM.Multivariable logistic regression analysis showed age,hypercholesterolemia and ST-T changes on electrocardiography(ECG)were correlated with WMH.Conclusions Brain whitematter lesions were very common in NAION patients,which weremild and prone to locate in brain whitematter areas rather than deep brain areas.Besides advancing age,there was direct relationship between WMH and hypercholesterolemia.NAION patients with WMH might be a potential target population likely to benefit from secondary stroke prevention therapies as stains.(Chin JOphthalmol and Otorhinolaryngol,2013,13:226-228,232)
Nonarteritic anterior ischemic optic neuropathy;Whitematter hyperintensities;Magnetic resonance imaging;Leukoaraiosis
2013-06-03)
(本文编辑 诸静英)
复旦大学附属眼耳鼻喉科医院眼科 上海 200031;*首都医科大学附属北京同仁医院神经内科**眼科中心 北京 100730
张晓君(Email:xjzhang@gmail.com)
