低温复合氰中毒对家兔肝肾功能的影响及4-DMAP 的解毒效果观察
2013-02-22吴丽珍杜兴华董兆君云南省中西医结合医院功能科云南昆明6504第三军医大学军事预防医学院毒理学研究所重庆400038云南省中西医结合医院检验科云南昆明6504
吴丽珍,雷 艳,杜兴华,3,蔡 颖,董兆君 (1.云南省中西医结合医院功能科,云南 昆明 6504;.第三军医大学军事预防医学院毒理学研究所,重庆400038;3.云南省中西医结合医院检验科,云南昆明6504)
氰化物用途广泛,既是化工原料,也是典型的速杀性化学战剂。氰化物进入体内,迅速细胞色素氧化酶中的Fe3+结合,使呼吸链的电子传递无法进行,最终导致组织缺氧[1-3]。4-二甲氨基吡啶(4-DMAP)是一种高铁血红蛋白形成剂,是第二代抗氰药物,可解除氰离子对细胞色素氧化酶的抑制作用[4]。肝脏及肾脏是人体的重要器官,氰中毒和低温暴露均可引起肝肾功能的严重损伤。若在低温暴露下遭受氰中毒,肝肾功能可能发生的变化及防护措施均未见相关报道。本实验采用低温暴露复合氰中毒的动物模型,观察低温和氰中毒两种因素对家兔血液中肝肾功能指标的影响及4-DMAP 对致伤作用的改善效果,初步探讨低温环境下氰中毒时肝脏及肾脏的致伤机制及防护措施。
1 材料与方法
1.1 实验动物及分组
普通级日本大耳白兔30 只,由第三军医大学实验动物中心提供,雌雄不限,体质量(2.0 ±0.2)kg,按随机数字表法将其分为 6 组,即 A 组(20 ℃ 组)、B 组(2 ℃ 组)、C 组(-20 ℃组)、D 组(2 ℃氰中毒组)、E 组(-20 ℃氰中毒组)、F 组(2 ℃氰中毒治疗组),每组各5 只。
1.2 试剂和仪器
氰化钠(NaCN)购自美国 Fluka 公司,纯度大于98%,4-DMAP由本室合成,临用前新鲜配制,其他试剂均为国产分析纯。日立7020 型全自动生化分析仪为HITACHI 公司产品,检测试剂盒购自四川迈克生物科技公司。
1.3 实验方法
动物采用戊巴比妥钠40 mg/kg 腹腔注射麻醉,仰卧位固定于手术台上。采用与我们前期实验相同的方法进行颈总动脉插管[5]。插管成功后,20 ℃组置于普通实验室内,室温控制在20 ℃;低温组置于冰柜中,温度分别控制在2 ℃、-20 ℃;中毒组于置冰柜后60 min 时一次腹腔性注射NaCN 2.0 mg/kg;治疗组于置冰柜后60 min 时腹腔注射NaCN 2.0 mg/kg,同时肌肉注射4-DMAP 3.2 mg/kg。各组自置于实验温度后开始计时,于 0、30、60、90、120 min 时间点抽取动脉血 5 mL,离心分离血浆(4 ℃,2 000 r/min,离心 10 min),-80 ℃超低温冰箱冻存。
1.4 检测指标
肝功能检测指标包括冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)、L-谷氨酰基转移酶(L-glutamyl transferase,GGT),肾功能检测指标包括BU、肌酐(creatinine,CREA)、尿酸(uric acid,UA)。
1.5 统计学处理
2 结果
2.1 肝功能指标的变化
2.1.1 AST 的变化 与同时相 A 组比较,B、C、D、E 组的AST 含量均呈升高趋势(P < 0.05)。在致伤 90 min 后,F 组的AST 水平显著低于未经干预的 D 组(P <0.05),但仍高于 A 组的正常水平(P <0.05)。随着低温暴露强度增强和(或)低温复合氰中毒时间的延长,AST 的变化趋势逐渐增强,且出现显著性变化的时间有所提前,C 组于低温作用30 min 时出现AST增高,B 组于低温作用60 min 时出现AST 增高,E 组在120 min时AST 升高尤为显著。各组的AST 检测结果见表1。
2.1.2 ALT 的变化 C、E 组与同时相点 A 组比较,ALT 含量呈升高趋势,在90、120 min 时尤为显著(P <0.05)。致伤90 min 后,F 组 ALT 含量显著低于未经干预的 D 组(P <0.05),与A 组水平接近。随着致伤时间的延长,B、C、D、E 组 ALT 含量逐渐增高(P <0.05)。各组的ALT 检测结果见表2。
2.1.3 ALP 的变化 A、B、C、D、E、F 组在 0 min 时的 ALP含量分别为(136.20 ± 7.56)、(165.20 ± 52.22)、(135.00 ±16.90)、(123.4 ± 5.94)、(178.80 ± 6.26)、(159.00 ± 40.45)U/L,在 120 min 时的 ALP 含量分别为 (112.20 ± 12.76)、(254.00 ± 44.13)、(125.80 ± 20.45)、(130.40 ± 13.79)、(177.40 ±17.64)、(154.40 ± 26.52)U/L。B、C、D、E、F 组的ALP 含量均明显高于同时相点 A 组(P <0.05)。B 组的 ALP含量在 120 min 时明显高于 0 min 时(P <0.05),其余各组 ALP含量未随时间出现明显变化。
2.1.4 GGT 的变化 A、B、C、D、E、F 组在 0 min 时的 GGT含量分别为(8.20 ± 0.84)、(6.00 ± 1.87)、(5.80 ± 1.48)、(6.40 ±1.95)、(8.40 ± 3.85)、(5.20 ± 3.35)U/L,在 120 min时的 GGT 含量分别为(6.60 ±2.07)、(5.80 ± 1.92)、(7.00 ±1.22)、(4.80 ±1.30)、(9.00 ± 4.47)、(4.60 ± 2.61)U/L。各组在相同时相点的GGT 含量无显著差异(P >0.05),且随着作用时间的延长,各组GGT 含量也未出现明显变化(P >0.05)。
2.2 肾功能指标的变化
2.2.1 BU 的变化 B、C、D、E 组的 BU 含量均明显高于同时相的A 组(P <0.05),且随着时间的延长呈逐渐升高趋势(P <0.05)。F 组的 BU 含量显著低于未经干预的 D 组(P <0.05)。各组的 BU 检测结果见表3。
2.2.2 CREA 的变化 B、C、D、E 组的 CREA 含量较 A 组相同时相点明显升高(P <0.05),且随着致伤时间的延长呈逐渐升高趋势,E 组在120 min 时升高尤为明显。F 组的 CREA 含量显著低于未经干预的D 组(P <0.05)。各组的CREA 检测结果见表4。
2.2.3 UA 的变化 B、C 组与 A 组同时相点的 UA 含量无显著性差异,D、E 组的 UA 含量在致伤 90、120 min 时显著升高,且明显高于A 组(P <0.05)。各组的UA 检测结果见表5。
表1 各组血浆AST 含量变化(±s,n=5,U/L)

表1 各组血浆AST 含量变化(±s,n=5,U/L)
a:与同组0 min 时比较,P <0.05;b:与同时相 A 组比较,P <0.05;c:与同组 60 min 时比较,P <0.05;d:与同时相 D 组比较,P <0.05
组别0 min 30 min 60 min 90 min 120 min A 组 16.00 ±3.67 15.20 ± 5.63 17.00 ±3.08 15.40 ±4.8821.80 ± 12.74 B 组 29.60 ±8.02 29.40 ± 6.07b 33.20 ±4.32ab 36.00 ±6.44ab 43.20 ± 3.56ab C 组 15.80 ±3.56 18.60 ± 3.21ab 23.20 ±4.76ab 27.60 ±10.85ab 37.20 ± 12.30ab D 组 21.00 ±5.70 21.00 ± 5.70b 25.00 ±6.20ab 28.20 ±7.98ab 33.60 ± 7.27ab E 组 24.00 ±13.29 27.20 ± 15.48ab 35.80 ±18.01ab 57.60 ±20.16abd 273.40 ± 84.90abd F 组 30.60 ±19.88 29.80 ± 19.32b 29.06 ±8.92b 31.20 ±16.89bd 25.00 ± 17.64abcd
表2 各组血浆ALT 含量变化(±s,n=5,U/L)
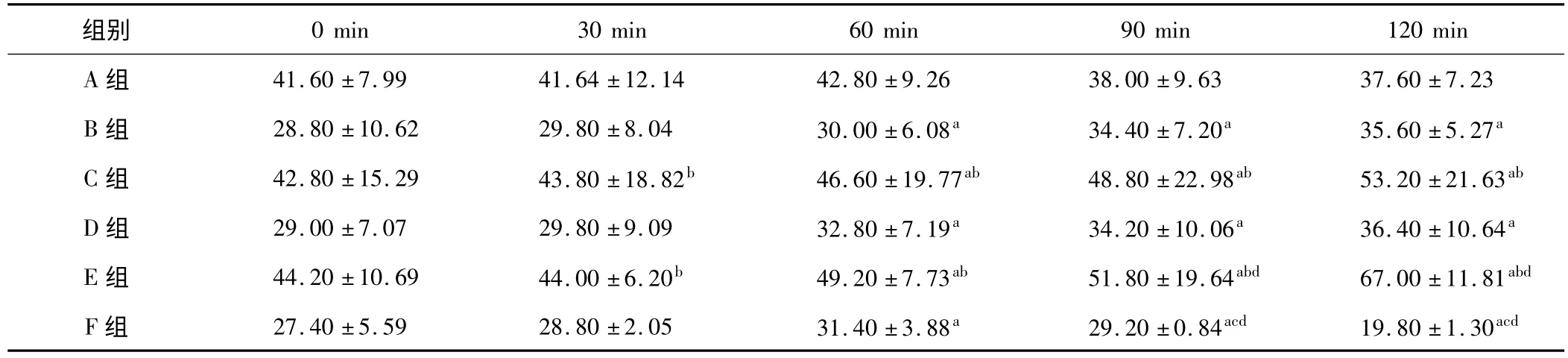
表2 各组血浆ALT 含量变化(±s,n=5,U/L)
a:与同组0 min 时比较,P <0.05;b:与同时相 A 组比较,P <0.05;c:与同组 60 min 时比较,P <0.05;d:与同时相 D 组比较,P <0.05
组别0 min 30 min 60 min 90 min 120 min A 组 41.60 ±7.99 41.64 ±12.14 42.80 ±9.26 38.00 ±9.63 37.60 ±7.23 B 组 28.80 ±10.62 29.80 ±8.04 30.00 ±6.08a 34.40 ±7.20a 35.60 ± 5.27a C 组 42.80 ±15.29 43.80 ±18.82b 46.60 ±19.77ab 48.80 ±22.98ab 53.20 ± 21.63ab D 组 29.00 ±7.07 29.80 ±9.09 32.80 ±7.19a 34.20 ±10.06a 36.40 ± 10.64a E 组 44.20 ±10.69 44.00 ±6.20b 49.20 ±7.73ab 51.80 ±19.64abd 67.00 ± 11.81abd F 组 27.40 ±5.59 28.80 ±2.05 31.40 ±3.88a 29.20 ±0.84acd 19.80 ± 1.30acd
表3 各组血浆BU 含量变化(±s,n=5,U/L)
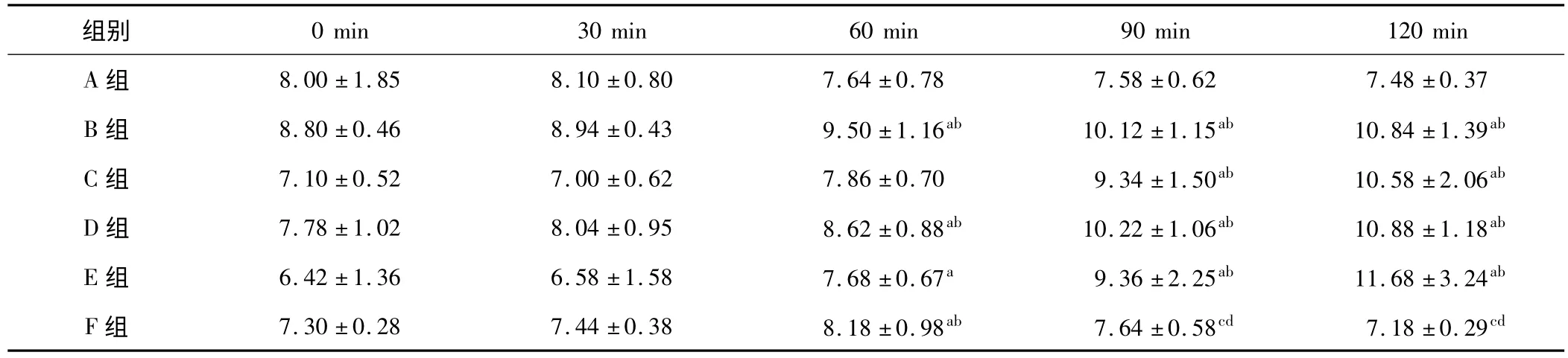
表3 各组血浆BU 含量变化(±s,n=5,U/L)
a:与同组0 min 时比较,P <0.05;b:与同时相 A 组比较,P <0.05;c:与同组 60 min 时比较,P <0.05;d:与同时相 D 组比较,P <0.05
组别0 min 30 min 60 min 90 min 120 min A 组 8.00 ± 1.85 8.10 ±0.80 7.64 ±0.78 7.58 ±0.62 7.48 ± 0.37 B 组 8.80 ± 0.46 8.94 ±0.43 9.50 ±1.16ab 10.12 ±1.15ab 10.84 ± 1.39ab C 组 7.10 ± 0.52 7.00 ±0.62 7.86 ±0.70 9.34 ±1.50ab 10.58 ± 2.06ab D 组 7.78 ± 1.02 8.04 ±0.95 8.62 ±0.88ab 10.22 ±1.06ab 10.88 ± 1.18ab E 组 6.42 ± 1.36 6.58 ±1.58 7.68 ±0.67a 9.36 ±2.25ab 11.68 ± 3.24ab F 组 7.30 ± 0.28 7.44 ±0.38 8.18 ±0.98ab 7.64 ±0.58cd 7.18 ± 0.29cd
表4 各组血浆 CREA 含量变化(±s,n=5,U/L)
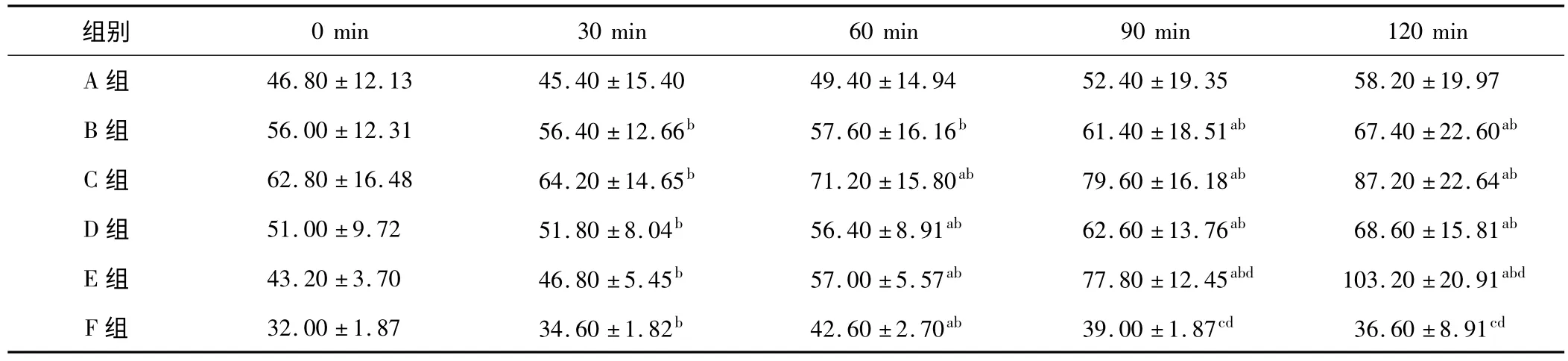
表4 各组血浆 CREA 含量变化(±s,n=5,U/L)
a:与同组0 min 时比较,P <0.05;b:与同时相 A 组比较,P <0.05;c:与同组 60 min 时比较,P <0.05;d:与同时相 D 组比较,P <0.05
组别0 min 30 min 60 min 90 min 120 min A 组 46.80 ± 12.13 45.40 ±15.40 49.40 ±14.94 52.40 ±19.35 58.20 ±19.97 B 组 56.00 ± 12.31 56.40 ±12.66b 57.60 ±16.16b 61.40 ±18.51ab 67.40 ± 22.60ab C 组 62.80 ± 16.48 64.20 ±14.65b 71.20 ±15.80ab 79.60 ±16.18ab 87.20 ± 22.64ab D 组 51.00 ± 9.72 51.80 ±8.04b 56.40 ±8.91ab 62.60 ±13.76ab 68.60 ± 15.81ab E 组 43.20 ± 3.70 46.80 ±5.45b 57.00 ±5.57ab 77.80 ±12.45abd 103.20 ± 20.91abd F 组 32.00 ± 1.87 34.60 ±1.82b 42.60 ±2.70ab 39.00 ±1.87cd 36.60 ± 8.91cd
表5 各组血浆 UA 含量变化(±s,n=5,U/L)
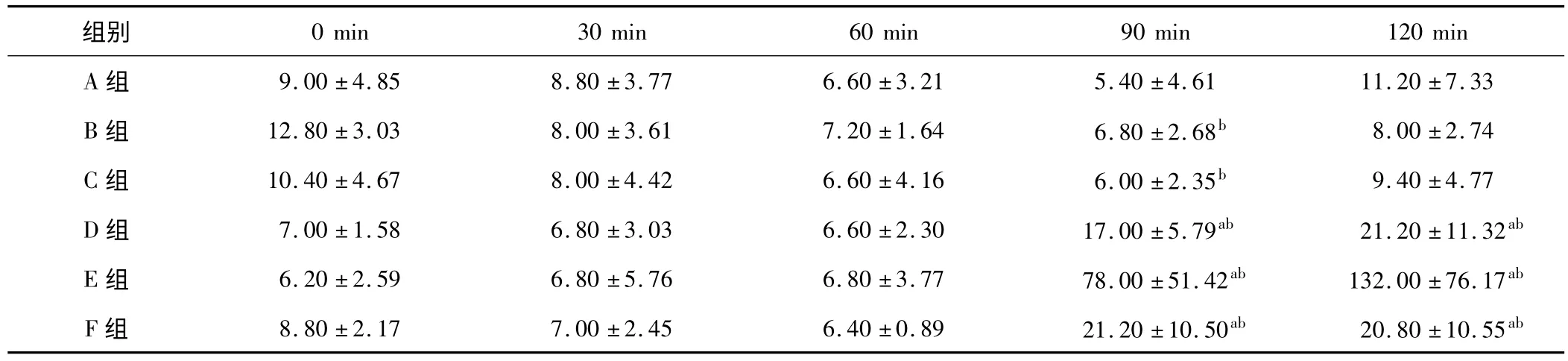
表5 各组血浆 UA 含量变化(±s,n=5,U/L)
a:与同组 0 min 时比较,P <0.05;b:与同时相 A 组比较,P <0.05
组别0 min 30 min 60 min 90 min 120 min A 组 9.00 ± 4.85 8.80 ±3.77 6.60 ±3.21 5.40 ±4.61 11.20 ± 7.33 B 组 12.80 ± 3.03 8.00 ±3.61 7.20 ±1.64 6.80 ±2.68b 8.00 ± 2.74 C 组 10.40 ± 4.67 8.00 ±4.42 6.60 ±4.16 6.00 ±2.35b 9.40 ± 4.77 D 组 7.00 ± 1.58 6.80 ±3.03 6.60 ±2.30 17.00 ±5.79ab 21.20 ± 11.32ab E 组 6.20 ± 2.59 6.80 ±5.76 6.80 ±3.77 78.00 ±51.42ab 132.00 ± 76.17ab F 组 8.80 ± 2.17 7.00 ±2.45 6.40 ±0.89 21.20 ±10.50ab 20.80 ± 10.55ab
3 讨论
寒冷是一种外界环境因素,寒冷应激对细胞代谢及生长过程有着显著的影响,最终可导致细胞损伤,表现为细胞坏死或凋亡[6]。寒冷应激可引起肝细胞、上皮细胞以及某些哺乳动物细胞的凋亡[7-8]。寒冷应激引起的肝脏内皮细胞凋亡中,线粒体形态出现明显的变化,大量线粒体表现为短小型,线粒体膜电位同时显著降低[7]。相关的文献报道,在寒冷造成的脑损伤中,脂质过氧化和胞内Ca2+超载可能是加速神经元凋亡的重要因素[9]。细胞内活性氧(reactive oxygen species,ROS)升高是寒冷应激导致细胞凋亡时出现的重要细胞学现象,同时ROS 增多也反映出线粒体功能受到损伤。目前的研究发现,低温环境造成细胞损伤的机制主要分两种:在非冻结性损伤时,低温主要诱导细胞凋亡,因此凋亡细胞普遍存在于整个寒冷应激损伤过程中[8];冻结性损伤则主要造成细胞生物膜的物理和化学损伤,包括膜结构和形态异常、膜生理功能紊乱等,从而导致细胞死亡。
NaCN 中毒时,氰根离子在体内能很快与氧化型细胞色素氧化酶的三价铁结合为氰化高铁细胞色素氧化酶,使之不能还原成还原型细胞色素氧化酶,从而影响介质的代谢,使Ca2+浓度明显增高,膜酯的过氧化作用显著增强,最终导致抗氧化防护系统破坏,氧化磷酸化受阻,组织不能利用氧,呈现中毒性缺氧功能改变。组织发生缺氧,细胞将从有氧代谢转为无氧酵解,后者产生ATP 的能力明显低于前者。由于组织供氧减少,利用氧障碍,导致细胞代谢、功能和形态结构发生异常,从而引起细胞凋亡。
众多的研究结果显示,寒冷应激可导致肝细胞线粒体H2O2产生增多,出现氧化应激[10]。寒冷暴露时诱发的氧化应激是造成机体组织、细胞损伤的主要因素,并且和细胞凋亡的发生密切相关。而氰中毒亦可对氧化应激水平产生显著影响[1]。机体发生氧化应激时,氧自由基大量产生并堆积,可造成肝肾细胞的细胞膜、线粒体和其他细胞器的损害,受损细胞的细胞内酶释放入血,从而导致某些血清酶的升高。NaCN 中毒时,组织器官缺血缺氧,无氧酵解引起大量酸性产物堆积,细胞内pH 值降低,细胞钠泵功能下降,钙离子通透性增加,细胞质内钙离子浓度增高,从而造成线粒体水肿,线粒体内酶释放入细胞质,使细胞膜的通透性增加,加速细胞内酶释放入血,故表现出多项血清酶学检测指标的显著升高。
目前,国内外关于低温或者氰中毒的研究报道较多,而关于低温暴露合并氰中毒对机体影响的文献尚不多见。本研究将低温暴露和氰化钠中毒两种致伤因素相结合,通过观察血液中相关酶含量的变化,探讨低温复合氰中毒对肝肾功能的影响。在反应肝脏功能的酶类指标中,ALT 在肝脏中含量最高,且ALT 仅存在于细胞浆内,肝内酶活性比血清高约100 倍,只要有1%的肝细胞坏死,即可使血清酶活性升高1 倍,是最敏感的肝功能指标之一,任何肝细胞损伤、包膜通透性增加和细胞坏死都将导致血清中ALT 的活性升高。AST 主要存在于肝细胞的线粒体及细胞浆内,也可见于心肌、骨骼肌、肾、脑组织中。当肝细胞受损时,血清中AST 的活性也会有所升高。临床实践证实,ALT、AST 同时升高,常提示肝损伤的存在。BU、CREA、UA是反映肾脏功能的最敏感的三项指标,也是目前临床上最常使用的衡量肾脏功能的血液生化指标。本研究发现,低温暴露和低温复合氰中毒时,血清AST、ALT、BU、CREA、UA 含量均有明显升高,尤以复合损伤时升高更为突出,且致伤时间越长,变化越明显。4-DMAP是一种高铁血红蛋白形成剂,它能使红细胞中的血红蛋白变为高铁血红蛋白(methemoglobin,MHb),后者可与CN-结合形成较稳定的MHb·CN,从而解除氰化物中毒症状。本研究中,治疗组给予4-DMAP 干预后,反映肝肾功能的血液指标较复合伤组均有明显改善,说明4-DMAP 可有效对抗氰化物的毒性作用。
本实验结果提示,低温暴露复合氰化钠中毒时,机体肝肾功能将会遭受严重损伤,表现出肝血清酶含量及肾功能指标不同程度的改变。低温暴露复合氰化物中毒的致伤机制可能为氧化应激反应及中毒性缺氧引起的细胞形态及功能的损伤,两种致伤因素的作用不是简单的相加,而是一种联合作用。本研究中,低温暴露和低温复合氰中毒对ALP、GGT 的含量的影响不大,可能是因为ALP、GGT 是主要反应胆汁淤积状况的生化指酶,而上述致伤因素未造成明显的胆汁淤积症状。
[1]袁菊芳,叶华虎,李奇慧,等.4-DMAP 对缺氧红细胞生成高铁血红蛋白的效应特点[J].第三军医大学学报,2003,25 (14):1227 -1229.
[2]董兆君.高原缺氧环境化学毒剂伤的伤情特点[J].解放军医学杂志,2008,33(2):123 -125.
[3]张晋煜,蔡 颖,唐 禾,等.缺氧和氰化钠中毒对犬心电信号及血清 AST、ALT 的影响[J].局解手术学杂志,2011,20(3):263 -265.
[4]叶华虎,袁菊芳,邓继先,等.缺氧环境下4-DMAP 形成高铁血红蛋白的药效学特征[J].解放军医学杂志,2006,31(11):1090 -1092.
[5]吴丽珍,雷 艳,蔡 颖,等.低温和氰化钠对家兔心肌酶含量的影响[J].局解手术学杂志,2012,21(6):610 -612.
[6]Kroemer G,Petit P,Zamzami N,et al.The biochemistry of programmed cell death[J].FASEB J,1995,9(13):1277 -1287.
[7]Kerkweg U,Jacob M,De Groot H,et al.Cold-induced apoptosis of rat liver endothelial cells:contribution of mitochondrial alterations[J].Transplantation,2003,76(3):501 -508.
[8]Doeppner TR,Grune T,de Groot H,et al.Cold-induced apoptosis of rat liver endothelial cells:involvement of the proteasome[J].Transplantation,2003,75(12):1946 -1953.
[9]Murakami K,Kondo T,Yang G,et al.Cold injury in mice:a model to study mechanisms of brain edema and neuronal apoptosis[J].Prog Neurobiol,1999,57(3):289 -299.
[10]Venditti P,Pamplona R,Portero Otin M,et al.Effect of experimental and cold exposure induced hyperthyroidism on H2O2production and susceptibility to oxidative stress of rat liver mitochondria[J].Arch Biochem Biophys,2006,447(1):11 -22.
