粳稻幼苗前期耐碱性的QTL检测
2013-02-20邹德堂王敬国刘化龙王志欣黄莹莹
邹德堂,马 婧,王敬国,刘化龙,孙 健,王志欣,黄莹莹,武 琦,兴 旺
(东北农业大学农学院,哈尔滨 150030)
盐碱地大多分布在热带、温带和寒带地区。水稻是一种对盐碱中度敏感的作物,土壤盐碱化是导致水稻减产的重要原因之一,不同程度的胁迫发生在水稻各个生长发育时期,在盐碱稻作区的直播田中,常发生水稻幼苗前期的盐碱危害。水稻成苗率的降低及有效光合群体未建立是因水稻在幼苗前期耐盐碱能力不强所致。因此,水稻幼苗前期的耐盐碱性,在盐碱稻作区是重要的抗性指标。近年来,在盐碱稻作区盐碱对水稻生产的危害与防治措施[1]、水稻耐盐碱品种的筛选与培育、与水稻耐盐碱性相关的DNA片段的基因克隆与功能分析[2]及水稻耐盐性QTL的检测[3]等领域有深入研究,以分子机理角度研究水稻盐碱性遗传的多数研究集中在水稻耐盐性,鲜有报道水稻耐碱性。
本研究以耐碱性相关性状表型值差异较大的两个粳稻品种东农425和长白10号杂交衍生的F2∶3群体作为研究对象,对碱胁迫下水稻幼苗前期相关性状进行QTL定位,为水稻耐碱性相关基因的QTL精细定位和耐碱品种选育提供理论基础。
1 材料与方法
1.1 材料
以产量较高的水稻品种东农425和具有较强耐碱性的品种长白10号作为亲本进行杂交,所获得F2∶3家系中的180个株系及其亲本为试验材料。
1.2 水稻耐碱性鉴定
幼苗前期耐碱性鉴定采用水培法。碱胁迫处理浓度为25 mmol·L-1NaHCO3,以清水为对照,2次重复。选取两亲本及其F2∶3家系的180个株系每份100粒种子,打破休眠后,用3%次氯酸钠浸泡30 min,用自来水冲洗3次。将种子分别播种于基质中,并灌溉Hoagland营养液。待幼苗长至二叶一心时,选取生长一致的幼苗移栽至带孔的泡沫板上,漂浮在浓度为25 mmol·L-1NaHCO3的Hoagland营养液的塑料培养盒内,每个材料移栽2排,每排定苗12株,室内培养,光照约1 500~2 000 lx,温度25~28 °C,进行25 mmol·L-1碱胁迫处理,同时设置对照。每天以蒸馏水补充自然蒸发的水分,每隔3 d更换培养液。
处理1周后,调查幼苗生长情况、统计根数,并用直尺测量最大根长(以下简称为根长),同时测定叶绿素含量。以上三个指标及其相对碱害率用于衡量水稻幼苗前期耐碱性的强弱,计算公式示于下方。
相对碱害率(%)=[(对照性状值-处理性状值)/对照性状值)]×100%
1.3 DNA提取及QTL检测
试验于2011年在东北农业大学香坊实验实习基地进行,分别移栽F2∶3家系(东农425/长白10号)180个个体及亲本,在分蘖期每个家系取5片叶片装入带封口的塑料袋,放置于-80℃超低温冰箱里。依照改进的CTAB法[4]提取DNA,测定DNA浓度,检测DNA质量,并稀释DNA原液,备用。
从Gramene网站上下载水稻SSR引物序列(RM系列),筛选600对引物,筛选父母本间有差异的引物,用于构建图谱。经长白10号和东农425两个亲本间SSR标记多态性筛选试验,从中筛选两个亲本间的差异引物,利用这些差异引物对180个F2∶3株系的DNA进行PCR扩增,获得群体标记基因型数据。PCR反应体系(总反应体系体积为10 μL)包括:1.5 μL 模版 DNA(50~100 ng),1 μL PCR buffer,0.75 μL MgCl2(25 mmol·L-1),0.15 μL dNTP(2.5 mmol·L-1),0.1 μL Taq DNA合成酶(5 U·μL-1),1.5 μL正反向引物(4 μmol·L-1),5 μL超纯水。扩增程序94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,共35个循环,72℃延伸1 min,10℃保存。利用6%聚丙烯酰胺凝胶电泳及银染法对扩增结果进行检测。本研究共筛选出120对在两亲本间具有多态性的SSR引物,占总引物数的20%。将两亲本间具有多态性的SSR引物,对F2∶3群体进行多态性检测,选取在F2∶3群体中差异性较好的88对引物进行F2代遗传连锁图谱的构建。
1.4 QTL分析
利用Excel分析软件分别对F2∶3群体幼苗前期的根数、根长以及叶绿素含量进行分析。对F2代180个基因型的染色体片段的交换率计算和连锁分析采用Mapmaker/Expversion 3.0,把染色体的交换率转为遗传图距单位(cM)后,用Kosambi函数计算出遗传距离。用Mapchart 2.1进行遗传连锁图谱的绘制。QTL遵循McCouch等[5]命名原则。
2 结果与分析
2.1 水稻幼苗前期耐碱相关性状的表型分析
分别调查自然条件和碱胁迫条件下,亲本及F2∶3家系180个个体的根数、根长和叶绿素含量及其相对碱害率,变异范围和平均值见表1,F3家系次数分布如图1所示。
自然条件下,东农425的根数为8条,根长为6.7 cm,叶绿素含量是21.6 mg·g-1;长白10号的根数为11.7条,根长为12.2 cm,叶绿素含量是23.5 mg·g-1。在碱胁迫环境下,东农425的根数是7条,根长是3.5 cm,叶绿素含量是10.7 mg·g-1;而长白10号的根数是10.3条,根长是9.2 cm,叶绿素含量是 17.8 mg·g-1。
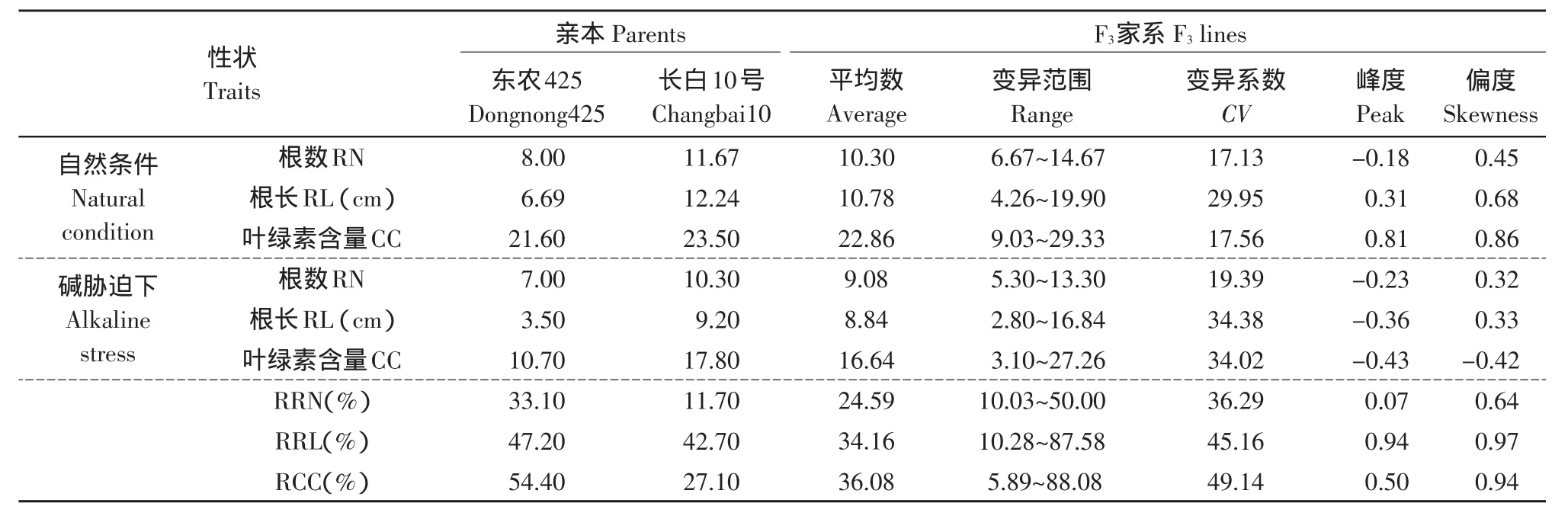
表1 自然和碱胁迫下F2∶3 家系幼苗前期根数、根长和叶绿素含量及其相对碱害率Table 1 Root number,root length,chlorophyll content and their relative alkaline damage rates at early seedling stage for F2∶3 lines under natural condition and alkaline stress

图1 碱胁迫下F2∶3 家系幼苗前期根数、根长和叶绿素含量及其相对碱害率的次数分布Fig.1 Distribution of root number,root length,chlorophyll content and their relative alkaline damage rates at early seedling stage in F2∶3 lines under alkaline stress
碱胁迫下东农425的根数、根长和叶绿素含量相对碱害率分别为33.1%、47.2%和54.4%,而长白10号的根数、根长和叶绿素含量相对碱害率分别为11.7%、42.7%和27.1%。说明东农425的耐碱性明显弱于长白10号,在幼苗前期,两个亲本间耐碱性的差异明显。
F2∶3家系群在自然条件下的根数、根长和叶绿素含量平均值分别为10.30条、10.78 cm和22.86 mg·g-1,而碱胁迫下F2∶3家系群的根数、根长和叶绿素含量平均值分别为9.08条、8.84 cm和16.64 mg·g-1。自然条件下F2∶3家系群体的根数、根长和叶绿素含量变异范围分别为6.67~14.67条、4.26~19.90 cm和9.03~29.33 mg·g-1,而碱胁迫下F2∶3家系的根数、根长和叶绿素含量变异范围分别为5.30~13.30 条、2.80~16.84 cm和 3.10~27.26 mg·g-1。以上说明,碱胁迫明显阻碍幼苗前期的水稻生长,并且F2∶3代群体的根数、根长和叶绿素含量及其相对碱害率之间的差异较为明显。
碱胁迫条件下,F3家系的根数、根长、叶绿素含量及所对应的相对碱害率分布见图1。从图1中可以看出,这三个性状及所对应的相对碱害率均呈单峰连续分布,其平均值都介于双亲之间。通过正态分布的适合性检验,并且发现其峰度和偏度的绝对值都小于1,表明所有性状的表型值基本符合正态分布,呈现典型的数量性状遗传模式,适合QTL定位。
2.2 幼苗前期水稻耐碱性的QTL检测
2.2.1 根数
碱胁迫下,检测到与根数相关的QTLs 3个,处于第1和第6条染色体上(见表2和图2),其LOD值范围为2.65~3.22,表型变异的解释率范围为6.59%~13.48%。在第1染色体RM529~RM302区间的qRN1-2对表型变异的解释率比较大为13.48%,其增效等位基因来自于长白10号,另外2个QTLs的贡献率比较小,分别为7.25%和6.59%。
在第10染色体上只检测到1个与根数相对碱害率有关的QTL,LOD值为2.75,能解释表型变异的14.49%,是主效QTL,其增效等位基因来自东农425。
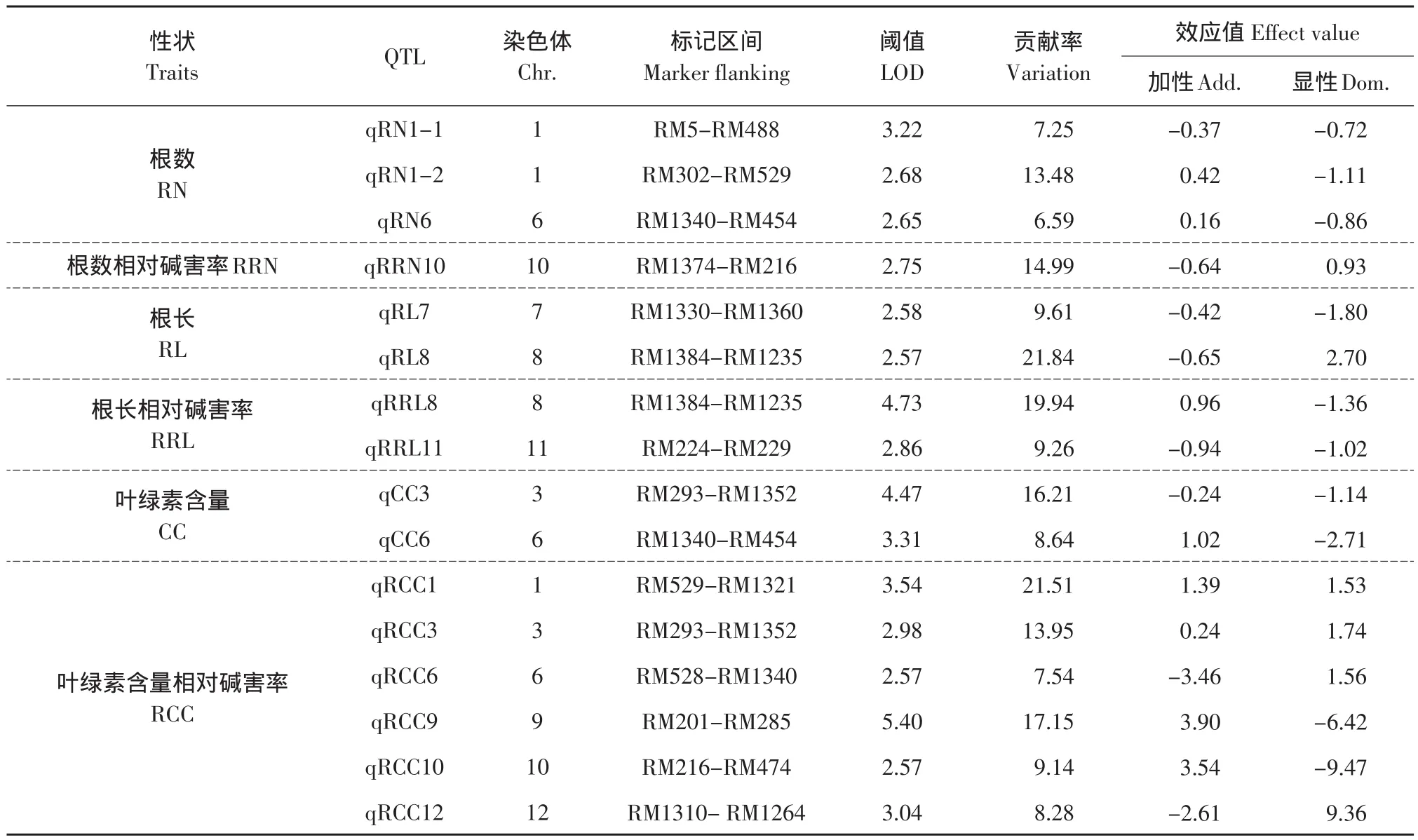
表2 碱胁迫下水稻幼苗前期相关性状的QTL及其遗传效应Table 2 QTL and their genetic effects for some agronomic traits at early seedling period in rice under alkaline stress

图2 碱胁迫下水稻幼苗前期根数、根长和叶绿素含量及其相对碱害率的QTL区间分布图Fig.2 Intervals distribution of QTLs for root number,root length,chlorophyll content,and their relative alkaline damage rates at early seedling stage under alkaline stress
2.2.2 根长
在碱胁迫下,定位出与根长相关的2个QTLs,分别位于第7和第8染色体上,其LOD值为2.58和2.57,分别能解释表型变异的9.61%和21.84%。其中第8染色体上RM1384~RM1235区间的qRL8对表型变异的解释率比较大为21.84%,是主效QTL。qRL7和qRL8的增效等位基因均来自东农425。
碱胁迫下,与根长相对碱害率相关的QTLs检测到2个,在第8和第11染色体上,其LOD值分别为4.73和2.86,分别能解释表型变异的19.94%和9.26%。位于RM1384~RM1235区间的qRRL8具有较大解释率,为19.94%,是主效QTL。qRRL8的增效等位基因来自长白10号,而qRRL11的增效等位基因来自东农425。
2.2.3 叶绿素含量
在碱胁迫条件下,检测到2个与叶绿素含量相关的QTLs,分别位于第3和第6染色体上,其LOD值为4.47和3.31,对表型变异的解释率分别为16.21%和8.64%,其中qCC-3的增效等位基因来自东农425,qCC6的增效等位基因来自长白10号。
在碱胁迫条件下,检测到6个与叶绿素含量相对碱害率相关的QTLs,分别位于第1、3、6、9、10和12染色体上,其LOD值范围为2.57~5.40,对表型变异的解释率范围为7.54%~21.51%。其中位于第1染色体RM529~RM1321区间的qCC1和位于第9染色体RM201~RM285区间的qCC9能较大地解释表型变异,分别为21.51%和17.15%,为主效QTL。qRCC1、qRCC3、qRCC9和qRCC10增效等位基因来自长白10号,而其余QTL增效等位基因则来自东农425。
3 讨论
3.1 水稻耐盐碱性遗传
前人研究认为,水稻耐盐碱性是受多基因控制的数量性状,是水稻受盐碱胁迫时各种生理反应的综合表现[6]。祁祖白等研究认为,环境会影响水稻苗期的耐盐性,若环境不适会导致其遗传力相对较低[7]。贺道耀等研究指出,盐胁迫下脯胺酸含量较高的水稻变异体其耐盐性具有可遗传性[8]。有研究指出,水稻在苗期的耐盐性比较稳定,主要遗传基础就是基因加性效应,在杂交的后代家系群体中水稻耐盐性升高是亲本同时作用的结果,苗期与成熟期遗传基础是共同的[9]。杨庆利等利用模型(主位点组加性-显性)分别对7个水稻品种苗期的耐盐性遗传机制进行研究[10],结果可知,在盐胁迫条件下水稻苗期根系中Na+/K+吸收比率的遗传受2个主效QTLs和微效QTLs的控制,盐害级别的遗传受3个主效QTLs和微效QTLs控制,显性效应和加性效应的共同作用控制水稻苗期根系中Na+/K+吸收比和盐害级别的遗传。
本试验结果表明,在浓度25 mmol·L-1NaHCO3碱溶液胁迫下F2∶3家系的根长、根数和叶绿素含量及其相对碱害率均呈正态连续分布,可知碱胁迫下水稻以上性状是由多基因控制的数量性状。
3.2 水稻耐碱性QTL定位
当前分子标记技术的发展为阐明QTL性状遗传基础提供依据。目前,有关Na+和K+的吸收量的比率[11],成熟期的茎叶干鲜重比率、穗长、株高及空瘪率[9],单株活力指数等耐盐性的QTL检测报道诸多,多数是关于水稻耐盐性的报道,而对水稻耐碱性的研究报道甚少。祈栋灵等利用F2∶3群体在碱胁迫下共检测到7个与水稻发芽率有关的QTLs以及6个与水稻发芽率相对碱害率有关的QTLs[11]。
本研究检测到的与叶绿素含量相对碱害率有关的QTL与祈栋灵等[11]检测到的与发芽率相对碱害率有关的QTL均定位在第9和12条染色体上,且位于相同区间,说明这2个QTLs同时控制着水稻发芽期和幼苗前期的耐碱性,另外祈栋灵等对幼苗前期的根数、根长、苗高以及相对碱害率进行QTL检测,本研究结果与其相比较存在较大共性[12],本研究所检测到的与叶绿素含量相对碱害率有关的QTL与祈栋灵等[12]检测到的与苗高相对碱害率有关的QTL均与RM1340相连锁,且与程海涛等[13]检测到的控制水稻相对苗高的QTL位于同一区间,说明这个QTL与水稻幼苗期的耐碱性相关的可能性极大,同时也可以看出,以叶绿素含量相对碱害率为指标进行水稻幼苗前期耐碱性QTL定位时,与前人有很大的一致性,可考虑将叶绿素含量相对碱害率作为评价水稻幼苗期耐碱性的直接指标。本研究与祈栋灵[12]等都将控制根数和根数相对碱害率的QTL定位在第6条染色体上,并且都将与根长有关的QTL定位在第8条染色体上,具有高度一致性,但由于采用标记不同,不能确定是否为同一区间。因此,QTL定位需要更广泛的研究,力求找到不同遗传材料和环境条件下都能出现的QTL。
将本研究所定位的QTL比较可知,qRN6与qRCC6均位于第6条染色体的RM1340-RM454区间,qRL8与qRRL8均位于第8条染色体的RM1384-RM1235区间,qCC3与qRCC3第3条染色体的RM293-RM1352区间。以上这些QTLs都位于染色体的相同区间,说明在碱胁迫下,上述QTL虽位于同一标记区间,却控制不同性状,这与程海涛等的试验研究结果[13]相似。程海涛等对水稻发芽期和水稻幼苗前期在碱胁迫下的耐碱性进行QTL检测结果表明[13],qRGR1和qRGI1都在第1染色体CT550~CT158区间;qADS3和qRRL3-1同处在第3染色体上的CT339~CT62区间。这些QTL位于同一区间却分别控制不同性状,说明它们有可能为同一QTL,一因多效,或者是它们之间为相近的紧密相连锁的,其部分区域发生重叠,各性状间的相关性与这一特性有关,有待深入研究。
4 结论
在碱胁迫条件下水稻幼苗前期的根数、根长和叶绿素含量及其相对碱害率呈连续的正态分布,认为是由主效基因和微效基因共同控制的数量性状。其中qRN1-2、qRRN10、qRL8、qRRL8、qCC3、qRCC1、qRCC3和qRCC9对表型变异的解释率较大,分别为13.48%、14.99%、21.84%、19.94%、16.21%、21.51%、13.95%和17.15%,为主效QTL。
[1]佟立纯,谷音.盐碱对水稻生产的危害及防治对策[J].垦殖与稻作,2006(2):45-46.
[2]谢国生,柳蔘奎,高野哲夫,等.盐碱胁迫对水稻幼苗中基因差异表达的影响[J].应用与环境生物学报,2005,11(2):129-133.
[3]Flowers T J.Improving crop salt tolerance[J].J Exp Bot,2004,55(396):307-319.
[4]陈文岳,包劲松.一种可用于PCR分析的水稻DNA简易提取法[J].中国水稻科学,2005,19(6):561-563.
[5]MaCouch S R,Cho Y G,Yang M,et al.Report on QTL nomenclature[J].Rice Genetics Newsletter,1997,14:11-13.
[6]赵可夫.植物对盐渍逆境的适应[J].生物学通报,2002,37(6):7-10.
[7]祁祖白,李宝健,杨文广,等.水稻耐盐性遗传初步研究[J].广东农业科学,1991(1):18-21.
[8]贺道耀,余叔文.水稻高脯氨酸变异系高脯氨酸含量和耐盐性的遗传性[J].植物生理学报,1997,23(4):357-362.
[9]顾兴友,梅曼彤,严小龙.水稻耐盐性数量性状位点的初步检测[J].中国水稻科学,2000,14(2):65-70.
[10]杨庆利,王建飞,丁俊杰,等.7个水稻品种苗期耐盐性的遗传分析[J].南京农业大学学报,2004,27(4):6-10.
[11]祈栋灵,李丁鲁,杨春刚,等.粳稻发芽期耐碱性的QTL检测[J].中国水稻科学,2009,23(6):589-594.
[12]祈栋灵,郭桂珍,李明哲,等.碱胁迫下粳稻幼苗前期耐碱性的数量性状基因座检测[J].作物学报,2009,35(2):301-308.
[13]程海涛,姜华,颜美仙,等.两个水稻DH群体发芽期和幼苗前期耐碱性状QTL定位比较[J].分子植物育种,2008,6(3):439-450.
