稳定表达甜味受体蛋白T1R2/T1R3的HEK293细胞系的建立
2013-02-19钱玲玲秦玉梅邓少平
钱玲玲, 秦玉梅, 邓少平
(浙江工商大学 食品与生物工程学院,浙江 杭州310035)
20世纪初甜味受体的发现,揭开了人类研究甜味感受机理的新篇章,研究者开始从甜味受体的结合与激活角度分析甜味剂结构与活性的关系[1]。甜味受体T1R2和T1R3以异二聚体的形式共表达参与甜味识别,对多种天然糖及各种人工甜味剂具有高亲和力,是一种广谱的甜味感受器[2-4]。当不同的甜味物质与T1R2/T1R3受体作用时,或通过激活G蛋白的α亚基,或通过激活α亚基导致与β、γ亚基的分离,从而引起各下游信号分子途径的开放,最终导致细胞膜去极化和神经递质释放[5-6],产生甜味感知。
甜味受体的发现,也使各种新技术如分子模拟、异源表达、离子影像及膜片钳电生理技术[7-10]等如雨后春笋般地涌现出来。作者所在实验室则利用近年来发展起来的等温量热滴定(ITC)技术手段,对细胞水平上甜味感受的热动力学进行研究,以期从新的角度诠释甜味识别机理。以味细胞以及NCIH716作为味细胞的替代细胞[11]为对象,确定了用于细胞甜味识别热力学研究的等温量热滴定各种实验条件;系统的研究了不同浓度的同种甜味剂、同种浓度不同甜味剂与味蕾细胞相互作用的热力学行为;证明了ITC作为一种新型实验手段在活细胞层面上通过热力学参量研究受体与配体分子相互作用的物理化学机制的可行性,在甜味识别的热动力学机制方面做了开创性工作。但不论是原代味细胞还是替代细胞,由于细胞中蛋白质成分的复杂性及细胞的不稳定性,使得甜味剂与甜味受体相互作用时信号较弱,从而影响了实验结果的稳定性。
作者利用异源表达受体蛋白质技术,通过提取总RNA、扩增目的基因和重组表达载体,将甜味受体蛋白基因导入HEK293细胞,通过筛选获得能够稳定、单一地表达甜味受体蛋白的细胞系,从而为ITC实验的顺利进行提供细胞来源,以期实现细胞水平上甜味识别热动力学规律研究。
1 材料与方法
1.1 材料
1.1.1 实验动物、质粒和细胞株 6~8周大C57BL/6J小鼠:SPF级,购自浙江省医学科学院实验动物中心; 大肠杆菌 Stbl3、pEGFP-C1、pDsRed1-N1、pcDNATM6.2/N-YFP-DEST质粒:购自美国Invitrogen公司;HEK293细胞系:由作者所在实验室保存。
1.1.2 主要试剂 Trizol试剂、PCR试剂盒、Marker、T4连接酶和内切酶:均购自TaKaRa公司;转染试剂LipofectamineTM2000转染试剂:购自美国Invitrogen公司;高纯度质粒小提试剂盒:购自OMEGA公司;DMEM高糖培养基、胎牛血清:购自美国Gibco公司;Gustducin兔多克隆抗体:购自美国Santa Cruz公司;T1R2/T1R3鼠单克隆抗体:购自美国Abcam生物技术公司;二抗:购自上海艾比马特公司;预染蛋白质相对分子质量标准、PVDF膜:购自美国Bio-Rad公司。
1.2 方法
1.2.1 小鼠舌组织mRNA的提取 取6~8周大C57BL/6J小鼠置于密闭容器中,通入N2致死,取舌组织,立即投入液氮中,后放入预冷的研钵,研磨至粉末状。在液氮基本挥发完时,加入Trizol,继续研磨至粉末,粉末呈液态状后,转移至玻璃匀浆器中冰上匀浆。最后根据mRNA提取操作方法获取总mRNA。RNA样品短期内于-20℃保存,长期则-80℃保存。
1.2.2 Gα15、T1R2与 T1R3基因的克隆 参考NCBI上Gα15、T1R2与T1R3的蛋白编码全序列,再结合初始转录产物CDS区序列,使用Prime primer 5.0软件设计引物,并在正反向引物的5’端分别加入EcoRⅠ、XhoⅠ酶切位点,设计所得引物见表1。引物由上海生工生物公司合成。以小鼠总mRNA为模板,通过RT-PCR扩增长度为1 124 bp的Gα15基因,以及长度分别为2 531、2 576 bp的T1R2和T1R3基因。反转录条件为65℃5 min、冰浴 5 min 变性、退火,30 ℃ 10 min;42 ℃ 25 min;95℃5 min终止反应。PCR条件为94℃5 min;98℃10 s,68 ℃(Gα15、T1R2、T1R3 退火温度分别为 68、61、63 ℃)30 s,72 ℃ 1 min/kbp,35个循环;72 ℃ 10 min。琼脂糖凝胶电泳后回收纯化PCR产物。回收产物于-20℃保存备用。
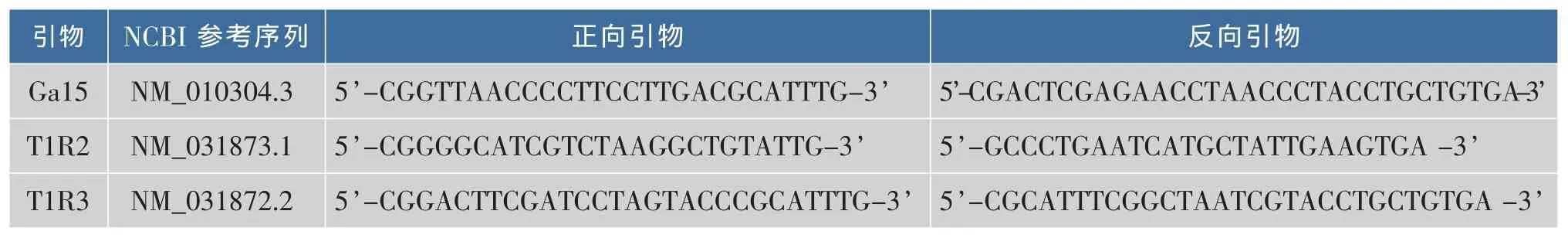
表 1 设计所得Gα15、T1R2、T1R3引物Table 1 Primers designed for Gα15,T1R2,T1R3
1.2.3 表达载体的构建 用EcoRⅠ和XhoⅠ分别双酶切目的基因 Gα15、T1R2与 T1R3,以及质粒pEGFP-C1、pDsRed1-N1 与 pcDNATM6.2/N-YFPDEST,然后T4连接酶16℃反应过夜。将连接产物转化自制Stbl3感受态。氨苄青霉素及卡那霉素培养板筛选出阳性克隆,最后重组质粒经PCR、Xho I和EcoR I双酶切及送上海生工生物公司进行测序鉴定。
1.2.4 稳定株的构建与筛选 取生长状态良好的HEK293细胞接种于10 cm细胞培养皿中,过夜培养,当汇合度达到40%~50%时进行转染。将重组表达质粒 Gα15-pEGFP-C1与 lipofectamine混合的转染复合物加入到已铺好HEK293细胞的培养皿中进行转染。转染6 h后,移除含转染复合物的培养基,加入DMEM完全培养基继续培养。转染48 h后,取部分观察GFP荧光,按照极限稀释法筛选出细胞株后,加入G418至终质量浓度为5 μg/mL。同时将没有转染的细胞作为空白对照,加入含G418质量浓度为4 μg/mL的选择培养基。当对照组细胞全部死亡后,将实验组G418质量浓度降为2 μg/mL,继续培养。筛选培养2周,筛选出的抗性单克隆株继续筛选5 d,挑取单克隆,进行扩大培养。再以相同的方法将 T1R2和T1R3共转染 Gα15/HEK293 细胞。 其中 G418 为 5 μg/mL,neomycin 与灭稻瘟素质量浓度各4 μg/mL。
1.2.5 RT-PCR检测目标基因表达水平 收集稳定转染的 Gα15/T1R2/T1R3/HEK 293细胞,利用RNAiso PLUS试剂提取细胞总mRNA,以GAPDH基因为内参基因,利用自行设计的引物进行PCR反应,扩增出目的基因。PCR扩增程序设为:95℃30 s;95 ℃ 5 s,65 ℃(Gα15、T1R2、T1R3 退火温度分别为 65、59、63 ℃)34 s,72 ℃ 1 min/kbp,40 个循环;72℃ 5min。
1.2.6 Western blot检测蛋白质表达 收集稳定转染的Gα15/T1R2/T1R3/HEK293细胞,常规培养,提取细胞蛋白质后,经SDS-PAGE电泳,转印PVDF膜,封闭2 h,然后依次与一抗(1∶1 000比例稀释)和二抗(1∶5 000比例稀释)反应,最后化学发光,凝胶系统拍照获取结果。
2 结果与分析
2.1 小鼠舌组织总mRNA提取结果
实验提取C57BL/6J小鼠的总mRNA,经1 g/dL琼脂糖凝胶电泳检测,结果见图1。其中28S的条带的亮度和宽度大约为18S条带的两倍,说明该总mRNA样品完整性好且降解较少。因此本实验所得到的小鼠总mRNA可以作为RT-PCR模板。

图1 小鼠舌组织总mRNA琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of total mRNA products
2.2 目的基因PCR扩增结果
以小鼠总mRNA为模板,利用自行设计的Gα15、T1R2及T1R3引物,进行RT-PCR扩增,预计分别获得长度为1 124、2 531、2 576 bp的目的片段,经1 g/dL琼脂糖凝胶电泳检测,结果见图2。发现经PCR扩增后,获得目的基因片段大小与预计大小基本一致。
2.3 重组表达质粒的鉴定
pEGFP-C1-Gα15、pDsRed1-N1-T1R2 和pcDNATM6.2/N-YFP-DEST-T1R3重组质粒经Xho I和 EcoR I双酶切后,将分别产生长度为1 124、2 531、2 576 bp 的 Gα15、TIR2、T1R3 目的基因片段及相应的载体片段。双酶切结果见图3、图4。将重组表达质粒送往上海生工生物公司测序,测序结果与源序列比对后发现,Gα15与TIR2同源性达到100%,仅T1R3在2 545 bp位点发生一个位点突变,经密码子翻译后,所编码的氨基酸种类保持不变,属于同义突变,证明重组表达质粒构建成功。
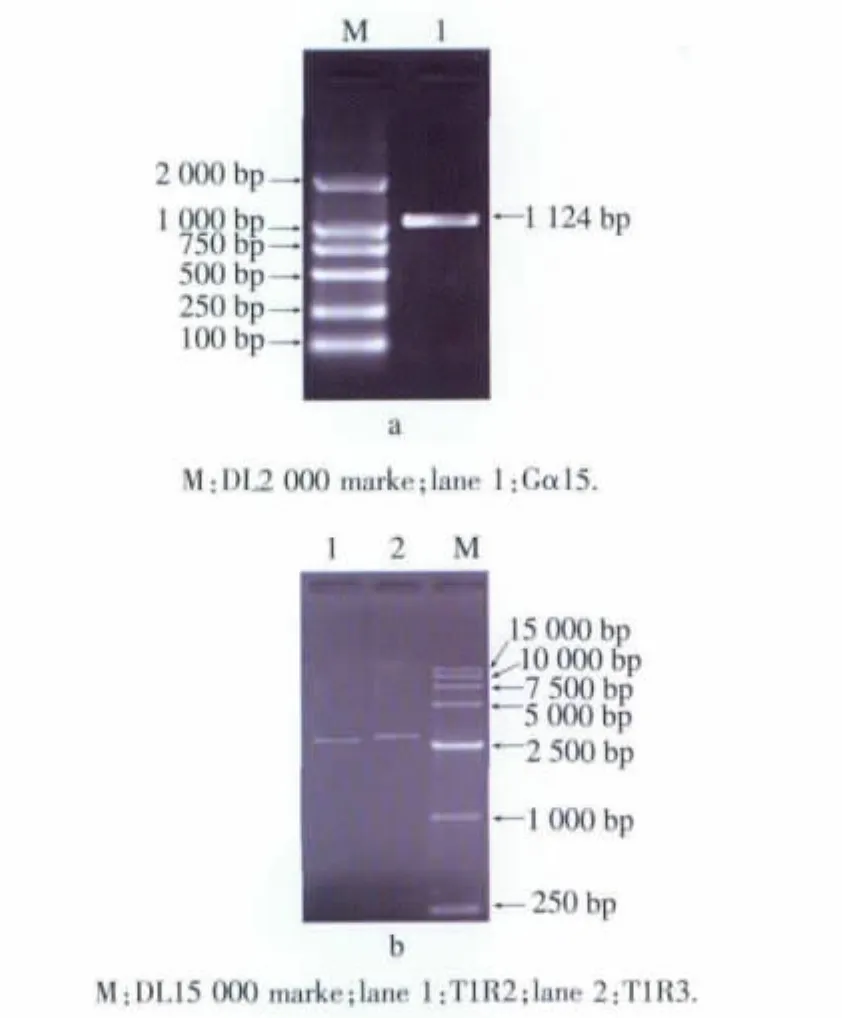
图2 RT-PCR产物琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of RT-PCR products
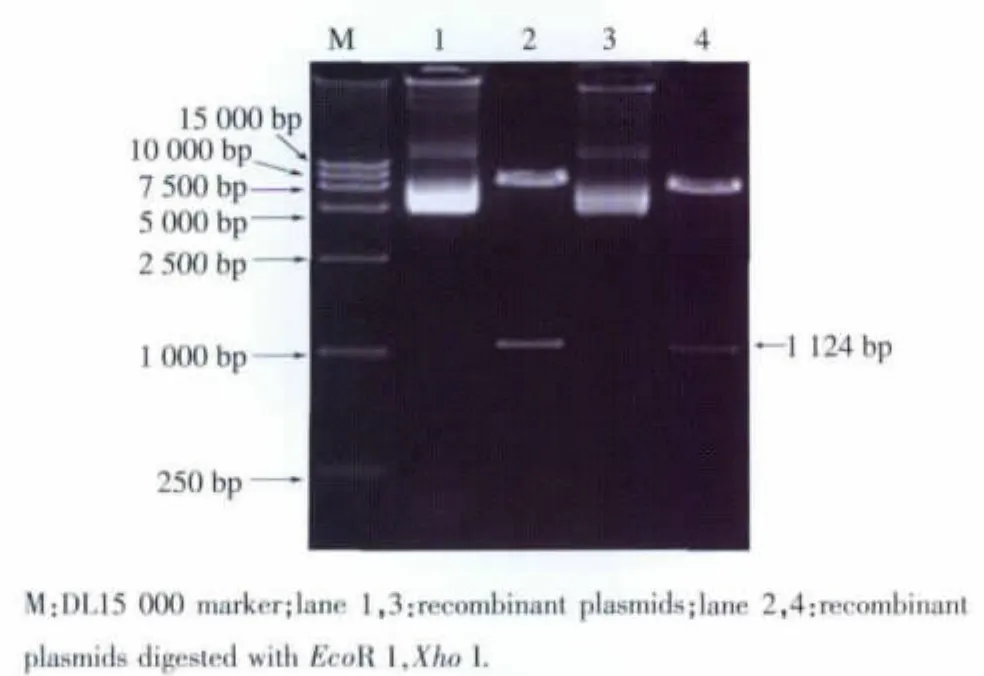
图3 pEGFP-C1-Gα15重组质粒双酶切产物琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis of double digestion productsofpEGFP-C1-Gα15recombinant plasmid
2.4 质粒转染效果鉴定
按比例将 PEGFP-Gα15表达载体转染至HEK293细胞中。以成功构建的Gα15/HEK293细胞为基础,将pDsRed1-N1-T1R2与pcDNATM6.2/NYFP-DEST-T1R3表达载体共转染至 Gα15/HEK293细胞中,经单克隆筛选后,将细胞置于激光扫描共聚焦显微镜下观察GFP/YFP/RFP荧光,结果见图 5。 结果说明,PEGFP-Gα15、pDsRed1-N1-T1R2与pcDNATM6.2/N-YFP-DEST-T1R3三种表达载体已被成功转入HEK293细胞且转染效率良好。
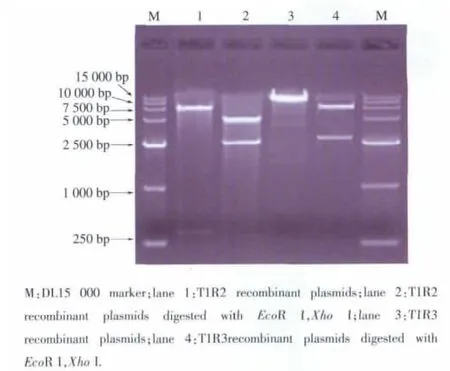
图 4 pDsRed1-N1-T1R2、pcDNATM6.2/N-YFP-DESTT1R3重组质粒双酶切产物琼脂糖凝胶电泳图Fig.4 Agarose gel electrophoresis of double digestion products of pDsRed1-N1-T1R2、pcDNATM6.2/NYFP-DEST-T1R3 recombinant plasmids

图5 稳定表达Gα15/T1R2/T1R3的HEK293细胞Fig.5 HEK293 cells express Gα15/T1R2/T1R3.Scale bar represent 30μm in A-D
2.5 RT-PCR 检测 Gα15、T1R2、T1R3表达结果
所得内参基因 GAPDH和 Gα15、T1R2、T1R3 PCR产物经1 g/dL琼脂糖凝胶电泳后,电泳条带分别位于 400、1 124、2 531、2 576 bp 左右位置,与实际长度基本一致,结果见图6、图7。
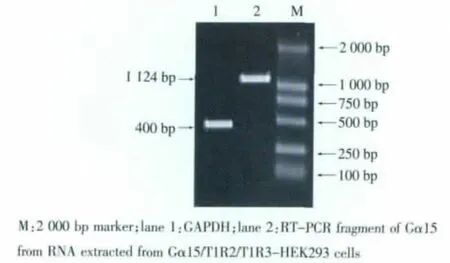
图6 RT-PCR产物的琼脂糖凝胶电泳图Fig.6 Agarose gel electrophoresis of RT-PCR products

图7 产物的琼脂糖凝胶电泳图Fig.7 Agarose gel electrophoresis of RT-PCR products
2.6 Western blot蛋白质表达检测结果
表达产物经Western blot鉴定结果见图8。
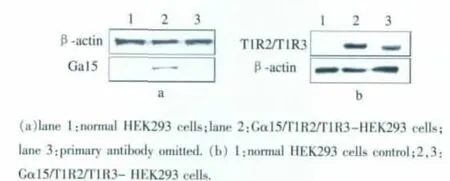
图8 Western Blot 结果Fig.8 Western Blot results
与空白对照组相比,稳定细胞株HEK293可以检测到Gα15,T1R2,T1R3。因此表明所筛选出来的HEK293细胞稳定表达了 Gα15,T1R2以及 T1R3蛋白。
3 结 语
甜味剂是一类重要的食品添加剂,它赋予食品以甜味。目前人工合成甜味剂在日常食品中应用范围越来越广,使用量越来越大,同时人工合成甜味剂的安全性一直是各国政府和相关科研机构所关注的热点[12]。大批科学家正在从各个方面寻找方法诠释甜味感受的机制,不仅用来指导新型甜味剂的开发,也利于研究甜味剂的安全性。近年来发展起来的等温滴定微量技术(ITC),通过一次实验便可提供热力学和动力学信息[13-14]。作者所在实验室即利用ITC,研究了细胞水平甜味感受的热动力学机制,从新的角度进一步研究甜味感受机制。通过前期研究[15]发现,要实现甜味识别热力学机制的诠释,稳定单一的细胞来源是实验的前提保障。异源表达技术在甜味机理研中究发挥着重要作用[10],所以作者所在实验利用异源表达技术以C57BL/6J小鼠舌组织提取的总RNA为模板,扩增了甜味受体T1R2和T1R3,以及甜味受体偶联的G蛋白α15亚基;选择 pEGFP-C1、pDsRed1-N1、pcDNATM6.2/N-YFPDEST构建表达,因上述质粒表达特定的荧光蛋白,简化了转染效率的检测及稳定表达细胞株的筛选,最后利用PCR与Western Blot技术证明,构建了稳定表达甜味受体蛋白T1R2/T1R3的Gα15/HEK293细胞株,从而为研究生物动力学和生物热力学提供了稳定的细胞来源。为甜味机理研究提供了良好的材料,也为细胞水平上的其他研究提供方法学基础。蛋白质晶体的获得成为了蛋白质的结构与功能特性研究的瓶颈问题[16]。甜味研究亦是如此。作者成功构建了稳定单一表达甜味受体的细胞株,同时也为获得甜味受体蛋白提供了坚实的物质基础。
[1]Vigues S,Dotson C D,Munger S D.The receptor basis of sweet taste in mammals[J].Results Probl Cell Differ,2009,47:187-202.
[2]Nelson G,C A J,Hoon M A,et al.An amino acid taste receptor[J].Nature,2001,416:199-202.
[3]Nelson G,H M A,Chandrashekar J,et al.Mammalian sweet taste receptors[J].Cell,2002,106:381-390.
[4]Assadi-Porter F M,Tonelli M,Maillet E L,et al.Interaction between the human sweet-sensing T1R2-T1R3 receptor and sweeteners detected by saturation transfer difference NMR spectroscopy[J].Biochimica et Biophysica Acta,2010,1798:82-86.
[5]Shin Y K,Martin B,Golden E,et al.Modulation of taste sensitivity by GLP-1 signaling[J].Journal of Neurochemistry,2008,106:455-463.
[6]Chaudhari N,Roper S D.The cell biology of taste[J].Journal of Cell Biology,2010,190(3):285-296.
[7]Cui M,J P,Maillet E,et al.The heterodimeric sweet taste receptor has multiple potential ligand binding sites[J].Curr Pharm Des,2006,12:4591-4600.
[8]Jiang P,J Q,Liu Z,et al.The cysteine-rich region of T1R3 determines responses to intensely sweet proteins[J].The Journal of Biological Chemistry,2004,279:45068-45075.
[9]Jiang P,C M,Zhao B,et al.Identification of the cyclamate interaction site within the transmembrane domain of the human sweet taste receptor subunit T1R3[J].The Journal of Biological Chemistry,2005,280:34296-34305.
[10]Winnig M,Bufe B,Kratochwil N A,et al.The binding site for neohesperidin dihyrochalcone at the human sweet taste receptor[J].BMC Struct Biol,2007,7:66.
[11]Wang T H,Hui G H,Deng S P.A novel sweet taste cell based sensor[J].Biosensors and Bioelectronics,2010,26(2):929-934.
[12]吴世嘉,王洪新,陶冠军.超高压液相色谱—质谱同时测定白酒中6种微量甜味剂的方法研究 [J].食品与生物技术学报,2010,29(5):670-675.WU Shi-jia,WANG Hong-xin,TAO Guan-jun.Ultra-high pressure liquid chromatography-mass spectrometry method for simutaneous determination of six micro-sweeteners in distilled spirit[J].Jounal of Food Science and Biotechnology,2010,29(5):670-675.(in Chinese)
[13]Chen Z X,Guo G M,Deng S P.Isothermal titration calorimetry study of the interaction of sweeteners with fullerenols as an artificial sweet taste receptor model[J].Journal of Agricultural and Food Chemistry,2009,57:2945-2954.
[14]Weber P C,Salemme F R.Applications of calorimetric methods to drug discovery and the study of protein interactions[J].Current Opinion in Chemical Biology,2003,13:115-121.
[15]秦玉梅,张根华,石锦芹,等.小鼠味蕾细胞分离及体外培养方法[J].细胞生物学杂志,2009,31(1):119-122.QIN Yu-mei,ZHANG Gen-hua,SHI Jin-qin,et al.The isolation and in vitro culture of mouse taste bud cells[J].Journal of Cell Biology,2009,31(1):119-122.(in Chinese)
[16]耿利强,尹大川,卢慧甍,等.原子力显微镜在蛋白质晶体生长研究中的应用[J].硅酸盐通报,2008,27(3):512-518.DI Li-qiang,YIN Da-chuan,LU Hui-meng,et al.Investigations of protein crystals growth by atomic force microscope[J].J silicate bulletin,2008,27(3):512-518.(in Chinese)
