植物抗冻蛋白分离纯化方法的研究进展
2013-02-19徐化能马淑凤张连富
徐化能, 马淑凤, 张连富
(江南大学 食品学院,江苏 无锡214122)
抗冻蛋白(Antifreeze Protein,AFP)或冰结构蛋白是一类能够抑制冰晶生长和重结晶的蛋白质,它能以非依数性形式降低水溶液的冰点而对其熔点影响甚微,这种引起的熔点与冰点的差值称为热滞活性,因而抗冻蛋白亦称为热滞蛋白[1]。抗冻蛋白可通过直接混合、浸泡、真空渗透等物理手段,添加到冰淇淋、冷冻肉制品和冷冻面团等食品中,来减少冰晶形成和重结晶对冷冻食品质构的破坏,改善冷冻食品的品质与性能,延长货架期[2-11]。
抗冻蛋白在植物、海洋鱼类、昆虫和微生物中均有分布,而植物抗冻蛋白最容易为食品生产企业和一般消费者所接受,其来源也比较广泛易得。因此,关于抗冻蛋白的商业利用和研究就集中到植物来源的分离上。研究发现,植物抗冻蛋白的热滞活性比鱼类和昆虫抗冻蛋白的热滞活性低,但植物抗冻蛋白有高的重结晶抑制功能[1]。目前,多种植物抗冻蛋白已被分离纯化和表征,包括冬黑麦(Secale cereale L.)[12]、 胡 萝 卜 (Daucus carota)[13-14]、冬 小 麦(Triticum aestivum)[15]、 沙 冬 青 (Ammopiptanthus mongolicusere)[16-18]、女真叶(Ligustrum lucidum)[19]、连翘[20]等。对多种植物抗冻蛋白的分析结果表明,不同来源的抗冻蛋白的多肽结构有明显区别,有些含有糖配基,有些则不含有糖配基。
鉴于抗冻蛋白在冷冻食品工业领域具有的广阔应用前景,GB2760-2011已将其列为可用于冷冻食品中的新型食品添加剂。因此,对植物抗冻蛋白进行高效分离纯化的方法亟待研究。作者拟对目前植物抗冻蛋白的分离纯化方法进行归纳,并对存在的优缺点进行分析,以期为未来抗冻蛋白分离技术的发展提供一定的参考。
1 传统层析分离方法
传统从冷带植物中分离抗冻蛋白的步骤一般包括植物原料均浆、离心、硫酸铵或乙醇分级沉淀、超滤、脱盐、上离子交换柱、梯度洗脱、过凝胶过滤层析柱、浓缩、冷冻干燥等步骤。例如,Kontogiorgos等[15]将冷诱导的冬小麦草非原质体提取物经过热处理、超滤膜浓缩、乙醇分级沉淀和体积排阻色谱等步骤,获得了一种热稳定的抗冻蛋白,并研究了其对冷冻面团超微结构的影响。尉姗姗等[17]将新疆沙冬青叶片配合液氮用搅拌机打磨至粉状,加入缓冲液混匀,高速离心,取上清液后超滤脱脂;然后,将脱脂后的样品,用美国Bio-Rad公司的双流速层析系统进行DE-52离子交换柱进行层析分离,NaCl梯度洗脱后收集各洗脱峰;最后经脱盐、冷冻干燥,得到相对分子质量为119 24的抗冻蛋白。Simpson等[20]将连翘的蛋白质提取液依次经过阴离子交换柱、羟基磷灰石色谱和凝胶过滤进行分离纯化,获得了一种相对分子质量为20 000的抗冻蛋白。王维香等[21]将沙冬青提取液依次经过热处理、弱阴离子交换层析 (DEAE-cellulose A52)、凝胶过滤层析(Sephacryl S300)、 疏 水 高 效 液 相 层 析 (Poros 20HP2)和强阴离子高效液相交换层析(Sourcel5Q),分离纯化到抗冻蛋白amAFP28。
传统层析方法存在分离周期长、过程繁琐、得率低、分离工艺不稳定和重复性差等缺点,并且在大规模生产中,由于耗资昂贵不能使产品维持合理的价格。另外,利用硫酸铵或乙醇分级沉淀法来纯化抗冻蛋白,硫酸铵或乙醇可能会改变活性潜伏的蛋白质二级结构,造成抗冻活性的损失。
2 SDS-PAGE电泳分离方法
SDS-PAGE电泳分离方法是将具有热滞活性的抗冻蛋白的电泳条带进行切割分离,该方法步骤少、时间短,适用于高精度和高纯度抗冻蛋白样品纯化。Hon等[12]对冬黑麦非质体提取液进行SDSPAGE电泳,然后直接回收凝胶上的抗冻蛋白。Wang等[22]则首先采用经典的蛋白质色谱技术来分离沙冬青叶片中的抗冻蛋白质,然后经非变性PAGE胶分离、回收,得到具有热滞活性的抗冻蛋白的条带。Zhang等[23]则采用SDS-PAGE电泳电泳条带切割法与柱层析分离相结合的方法获得了冬小麦麸皮抗冻蛋白。
然而,SDS-PAGE电泳分离过程中,电泳分离的各峰间相互叠加,分离效率不太理想,并且分离过程有时会发生蛋白质沉淀,使收集电泳组分困难。另外,该方法必须在有标准样品的基础上才可以有效地纯化,纯化的样品也非常少。
3 冰特异性吸附分离方法
目前,利用抗冻蛋白对亲水性表面具有自发的亲和吸附能力,开发和制备新型的吸附分离介质开始受到关注。例如,Kuiper等[24]根据抗冻蛋白和冰晶之间存在特异吸附性,设计了一个 “冷手指(Cold Finger)”(图 1)。样品置于烧杯中,缓慢的磁力搅拌,保证溶液体系均匀,“冷手指”通过与其相连的管路控制温度。该“冷手指”可以从粗提物中纯化与冰结合的抗冻蛋白,使用一次就使抗冻蛋白浓度提高50倍,操作效率高。

图1 冷手指装置Fig.1 Cold finger device
Zhang等[25]参照Kuiper的试验方法,并对分离装置进行了改良(图2)。首先通过热重分析仪法和分配系数法研究证明冬小麦麸皮抗冻蛋白具有较强的亲水性和亲冰性,然后使用冰特异性亲和吸附法对其纯化,获得了产率为1.64%的电泳纯小麦麸皮抗冻蛋白。

图2 冰特异性吸附分离小麦麸皮抗冻蛋白Fig.2 Separation antifreeze proteins from wheat bran(Triticum aestivum L.) by ice specific adsorption
刘尚等[26]根据抗冻蛋白与冰结合的特性,利用碎冰从女贞叶提取液中分离出抗冻蛋白。结果表明,通过碎冰吸附、凝胶过滤和离子交换层析可以获得4个组分的蛋白质,经过差式扫描量热仪鉴定,其中的1个具有热滞活性。
Gupta等[27]也使用类似的方法来分离沙棘中的抗冻蛋白。首先通过二维电泳、质谱和冰晶修饰活性鉴定出沙棘提取液中含有抗冻蛋白,进而通过冰特异性亲和吸附法对沙棘抗冻蛋白进行了制备纯化(图 3)。
冰特异性吸附分离法利用了抗冻蛋白对冰的特异吸附性,经一步分离步骤即可使植物抗冻蛋白的纯化倍数显著提高,比传统的色谱方法更加快捷高效;但是该方法对纯化过程的控制要求严格,目前的分离装置还比较复杂。随着蛋白质分离纯化设备的发展与改进,该方法具有广阔的应用前景。
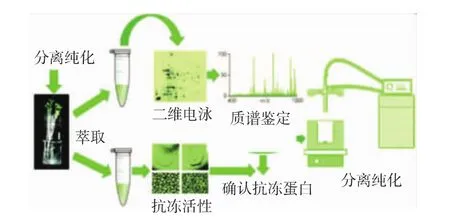
图3 沙棘抗冻蛋白的分离纯化Fig.3 Separation and purification of antifreeze protein from Hippophae rhamnoides
4 浊点萃取方法
浊点萃取(Cloud-Point Extraction,CPE)是近年来在分离科学领域备受关注的一种新颖分离方法,它不使用挥发性有机溶剂,不影响环境。它利用非离子表面活性剂水溶液在加热到浊点温度时形成界面清晰的胶束/水两相(图4),而组分可在两相中进行分配来实现分离[28-31]。浊点系统可基于包括脂肪酸聚氧乙烯醚和烷基酚聚氧乙烯醚系列,以及烷氧基嵌段共聚物类化合物等。CPE法具有经济、安全、高效、操作简便、易于大规模生产等优点。
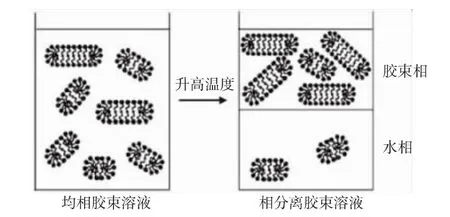
图4 非离子表面活性剂的浊点相分离Fig.4 Cloud pointphase separation of nonionic surfactants
作者首次将浊点萃取法用于冬小麦抗冻蛋白的分离纯化[32]。首先采用含非离子表面活性剂的缓冲溶液从冬小麦和女真叶中的浸取抗冻蛋白;然后加热到浊点温度后分成水相和胶束相两相,疏水性杂质富集于胶束相,而亲水性的抗冻保留在水相;最后经透析浓缩、冷冻干燥得到纯化的抗冻蛋白产品。应用SDS-PAGE和差示扫描量热仪(DSC)分别测定了其相对分子质量范围和热滞活性值。抗冻蛋白相对分子质量范围为20 200~66 100,热滞活性范围为0.20~0.38℃,浊点萃取过程对抗冻蛋白的热滞活性不产生显著影响。抗冻蛋白由于具有很强的亲水性将保留在水相,而疏水性杂质选择性地萃取到胶束相,这是浊点萃取纯化抗冻蛋白的基础。另外,还研究了净电荷、相对分子质量不同的女贞叶抗冻蛋白在SDS/Triton X-114双水相系统的的分配行为[32]。其分配行为受胶束与抗冻蛋白的体积排阻作用而影响,而蛋白净电荷作用对其分配无显著影响。抗冻蛋白的分配系数与蛋白质相对分子质量、SDS质量浓度和温度呈正相关性,其值在1.56~9.51之间;随着SDS质量浓度和温度的增加,表面活性剂聚集体的尺寸增加,胶束相对抗冻蛋白的体积排阻增强,进而促进其相水相转移。以上研究结果表明:浊点萃取法的表面活性剂用量少、成本低、体系组成简单,是一种极具潜力的抗冻蛋白分离方法。
5 展望
目前,大多数研究重点均集中在新抗冻蛋白的发现及分析上,而对其分离制备过程的关键技术则研究较少。另外,抗冻蛋白的分离纯化方法研究主要还局限在实验室分析规模,将其发展到对抗冻蛋白的大规模分离纯化还面临着许多问题和挑战。例如,如何筛选出对抗冻蛋白具有特异性作用的功能基团,抗冻蛋白与分离介质间如何相互作用、怎样匹配,等等。因此,有必要对这些科学问题进行系统深入的基础研究,揭示其内在的科学规律和原理。
通过抗冻蛋白的相对分子质量、等电点、极性、特异性冰晶吸附等性质进行分离方法的设计是抗冻蛋白分离方法的发展方向。特别需要指出的是,具有高度专一性和选择性的亲和分离材料的开发应在抗冻蛋白的分离纯化中得到关注。此外,亲和分离材料与表面活性剂(或聚合物)双水相萃取体系的结合,以及与其他相关技术的集成和联用,将促进抗冻蛋白分离纯化的规模化和产业化发展。
[1]Hassas-Roudsari M,Goff H D.Ice structuring proteins from plants:Mechanism of action and food application[J].Food Research International,2012,46:425-436.
[2]张晖,丁香丽.抗冻蛋白在食品中应用研究进展及安全性分析[J].食品与生物技术学报,2012,31(5):455-461.ZHANG Hui,DING Xiang-li.Research progress of antifreeze proteins application in food and its safety analysis[J].Journal of Food Science and Biotechnology,2012,31(5):455-461.(in Chinese)
[3]JIA C L,HUANG W N,WU C,et al.Frozen bread dough properties modified by thermostable ice structuring proteins extract from hinese Privet(Ligustrum vulgare) leaves[J].Cereal Chemistry,2012,89(3):162-167.
[4]汪少芸,赵珺,吴金鸿,等.抗冻蛋白的研究进展及其在食品工业中的应用[J].北京工商大学学报:自然科学版,2011,29(4):50-57.WANG Shao-yun,ZHAO Jun,WU Jin-hong,et al.Research progress in antifreeze proteins and application in food industry[J].Journal of Beijing Technology and Business University:Natural Science Edition,2011,29(4):50-57.(in Chinese)
[5]Li L,Kim Y,Huang W,et al.Effects of ice structuring proteins on freeze-thaw stability of corn and wheat starch gels[J].Cereal Chemistry,2010,87:497-503.
[6]YEH C M,KAO B Y,PENG H J.Production of a recombinant type 1 antifreeze protein analogue by L.lactis and its applications on frozen meat and frozen dough[J].Journal of Agricultural and Food Chemistry,2009,57(14):6216-6223.
[7]XU H N,HUANG W N,JIA C L,et al.Evaluation of water holding capacity and breadmaking properties for frozen dough containing ice structuring proteins from winter wheat[J].Journal of Cereal Science,2009,49:250-253.
[8]Kontogiorgos V,Goff H D,Kasapis S.Effect of aging and ice-structuring proteins on physical properties of frozen flour-water mixtures[J].Food Hydrocolloid,2008,22:1135-1147.
[9]潘振兴,邹奇波,黄卫宁.冰结构蛋白对长期冻藏冷冻面团抗冻发酵特性与超微结构的影响[J].食品科学,2008,29(8):39-42.PAN Zhen-xing,Zou Qi-bo,HUANG Wei-ning,et al.Effects of ice structuring protein on fermentation characteristics and microstructure of frozen dough during long-term cold storage[J].Food Science,2008,29(8):39-42.(in Chinese)
[10]Kontogiorgos V,Goff H D,Kasapis,S.Effect of aging and ice structuring proteins on the morphology of frozen hydrated gluten networks[J].Biomacromolecules,2007,8:1293-1299.
[11]ZHANG C,ZHANG H,WANG L.Effect of carrot (Daucus carota) antifreeze proteins on the fermentation capacity of frozen dough[J].Food Research International,2007,40:763-769.
[12]Hon W C,Griffith M,Chong P,et al.Extraction and isolation of antifreeze protein from winter rye (Secale cereal L.) leaves[J].Plant Physiology,1994,104:971-980.
[13]Smallwood M,Worrall D,Byass L,et al.Isolation and charaterization of a novel antifreeze protein from carrot (Daucus Carota)[J].Biochemical Journal,1999,340:385-391.
[14]Meyer K,Keil M,Naldrett M J.A leucine-rich repeat protein of carrot that exhibits antifreeze activity[J].Febs Letters,1999,447(2-3):171-178.
[15]Kontogiorgos V,Regand A,Yada R Y,et al.Isolation and characterization of ice structuring proteins from cold acclimated winter wheat grass extract for recrystallization inhibition in frozen foods[J].J Food Biochemistry,2007,31:139-160.
[16]WANG W,WEI L.Purification of boiling-soluble antifreeze protein from the Legume Ammopiptanthus mongolicus[J].Preparative Biochemistry&Biotechnology,2003,33(1):67-80.
[17]尉姗姗,尹林克,牟书勇,等.新疆沙冬青抗冻蛋白的提取分离及其热滞活性测定[J].云南植物研究,2007,29(2):251-255.YU Shan-shan,YIN Lin-ke,MU Shu-yong,et al.Extraction,separation and measuration of the thermal hysteresis activity of antifreeze proteins from Ammopiptanthus nanus(Leguminosae)[J].Acta Botanica Yunnanica,2007,29(2):251-255.
[18]FEI Y B,CAO P X,GAO S.Q et al.Purification and Structure Analysis of Antifreeze Proteins from Ammopiptanthus mongolicus[J].Preparative Biochemistry&Biotechnology,2008,38:172-183.
[19]CAI Y,LIU S,LIAO X,et al.Purification and partial characterization of antifreeze proteins from leaves of Ligustrum lucidum Ait[J].Food and Bioproducts Processing,2011,89(2):98-1022.
[20]Simpson D J,Smallwood M,Twigg S.Purification and characterisation of an antifreeze protein from Forsythia suspensa (L.)[J].Cryobiology,2005,51:230-234.
[21]王维香,魏令波,张虎.沙冬青热稳定抗冻蛋白的分离纯化及其部分性质研究[J].四川大学学报:自然科学版,2007,44(4):912-917.WANG Wei-xiang,WEI Ling-bo,ZHANG Hu.Study on purification and partial characterization of heat-stable antifreeze protein from A.mongolicus[J].Journal of Sichuan University:Natural Science Edition,2007,44(4):912-917.(in Chinese)
[22]WANG W,WEIL,WANG G.Multisteppurificationofanantifreezeproteinfrom Ammopiptanthusmongolicusby chromatographic and electrophoretic methods[J].Journal of Chromatographic Science,2003,41:489-493.
[23]张超,赵晓燕,马越,等.冬小麦麸皮抗冻蛋白的筛选及其分离纯化[J].中国粮油学报,2009,24(5):16-20.ZHANG Chao,ZHAO Xiao-yan,MA Yue,et al.Purification and characterization of winter wheat (Triticum aestivum L.) bran antifreeze protein[J].Journal of the Chinese Cereals and Oils Association,2009,24(5):16-20.(in Chinese)
[24]Kuiper M J,Lankin C,Gauthier SY,et al.Purification of antifreeze proteins by adsorption to ice[J].Biochemical and Biophysical Research Communications,2003,300(3):645-648.
[25]Zhang C,Zhang H,Wang L,et al.Purification of antifreeze protein from wheat bran (Triticum aestivum L.) based on its hydrophilicity and ice-binding capacity[J].Journal of Agricultural and Food Chemistry,2007,55:7654-7658.
[26]刘尚,廖祥儒,张建国,等.一种女贞叶抗冻蛋白的分离纯化[J].植物学通报,2007,24(4):505-510.LIU Shang,LIAO Xiang-ru,ZHANG Jian-guo,et al.Purification of an antifreeze protein from Ligustrum lucidum leaves and its partial characteristics[J].Chinese Bulletin of Botany,2007,24(4):505-510.(in Chinese)
[27]Gupta R,Deswal R.Low temperature stress modulated secretome analysis and purification of antifreeze protein from Hippophae rhamnoides,a Himalayan wonder plant[J].Journal of Proteome Research,2012,11:2684-2696.
[28]Mukherjee P,Padhan S K,Dash S,et al.Clouding behaviour in surfactant systems[J].Advances in Colloid and Interface Science,2011,162:59-79.
[29]Becker J S,Thomas O R T,Franzreb M.Protein separation with magnetic adsorbents in micellar aqueous two-phase systems[J].Separation and Purification Technology,2009,65:46-53.
[30]Mashayekhi F,Meyer A S,Shiigi S A,et al.Concentration of mammalian genomic DNA using two-phase aqueous micellar systems[J].Biotechnology and Bioengineering,2009,102:1613-1623.
[31]da Silva M A O,Arruda M A Z.An aqueous two-phase system as a strategy for serum albumin depletion[J].Talanta,2009,77:985-990.
[32]Xu H N,Chen H Y,Huang W N.Purification of ice structuring protein complexes from winter wheat using Triton X-114 phase partitioning[J].Frontiers of Chemical Engineering in China,2009,3(4):383-385.
[33]Xu H N.An aqueous anonic/nonionic surfactant two-phase system in the presence of salt.2.Partitioning of ice structuring proteins[J].RSC Advances,2012,2:12251-12254.
