PCl3水解反应机理的理论研究*
2013-02-13陈晓峰赵静李晓东吴勇
陈晓峰 赵静 李晓东 吴勇
(南京师范大学化学与材料科学学院 江苏南京210046)
在现有的大学无机化学教材中,将非金属卤化物的水解分为亲核水解和亲电水解两大类。发生亲核水解的条件是中心原子带有部分正电荷和有空的价轨道,如BX3、SiCl4等,中心原子可以接受H2O中O上的孤对电子的进攻;而发生亲电水解的条件是中心原子有孤对电子,可以进攻H2O中的H,如NCl3[1]。PCl3中的P有空的3d价轨道,可以接受H2O中O的进攻;另一方面P上又有孤对电子,可以进攻H2O中的H。不同教材对PCl3的水解机理有不同的解释。一种观点认为PCl3的水解过程既有亲电部分也有亲核部分,即PCl3可以同时发生亲电和亲核水解反应[1];另一种观点则认为PCl3是亲核水解[2]。迄今为止,还未见对PCl3水解过程的理论和实验研究的报道。为此,我们对PCl3的两种水解机理从理论上进行了研究,以期为无机化学理论课的教学提供一定的参考。
1 计算方法
利用Gaussian03软件程序[3],采用密度泛函理论在B3LYP/6-311+G**水平上对反应物、产物、中间体及过渡态的几何构型进行了优化。稳定点的性质通过对其构型计算振动频率来确认,反应物、产物及中间体的频率全部为正值,而过渡态有且仅有1个虚频。在同一理论计算水平上采用IRC确定了过渡态与反应物、中间体及产物的关系,获得了最小的能量途径。
2 结果与讨论
2.1 PCl3同时发生亲电和亲核水解反应机理[1]
PCl3的水解是分步进行的。第一步是由H2O中的H和O同时与P作用,经过过渡态TS1-e后得到中间体IM1-e;IM1-e经过过渡态TS2-e脱去HCl后得到中间体IM2-e;第一步水解后,P上不再具有孤对电子。第二步水解则采取亲核方式,由H2O中的O进攻IM2-e中的P,经过过渡态TS3-e脱去HCl后得到中间体IM3-e。第三步水解与第二步相似,由H2O中的O进攻IM3-e中的P,经过过渡态TS4-e脱去HCl后得到最终水解产物二元酸H3PO3。水解过程如图1所示。
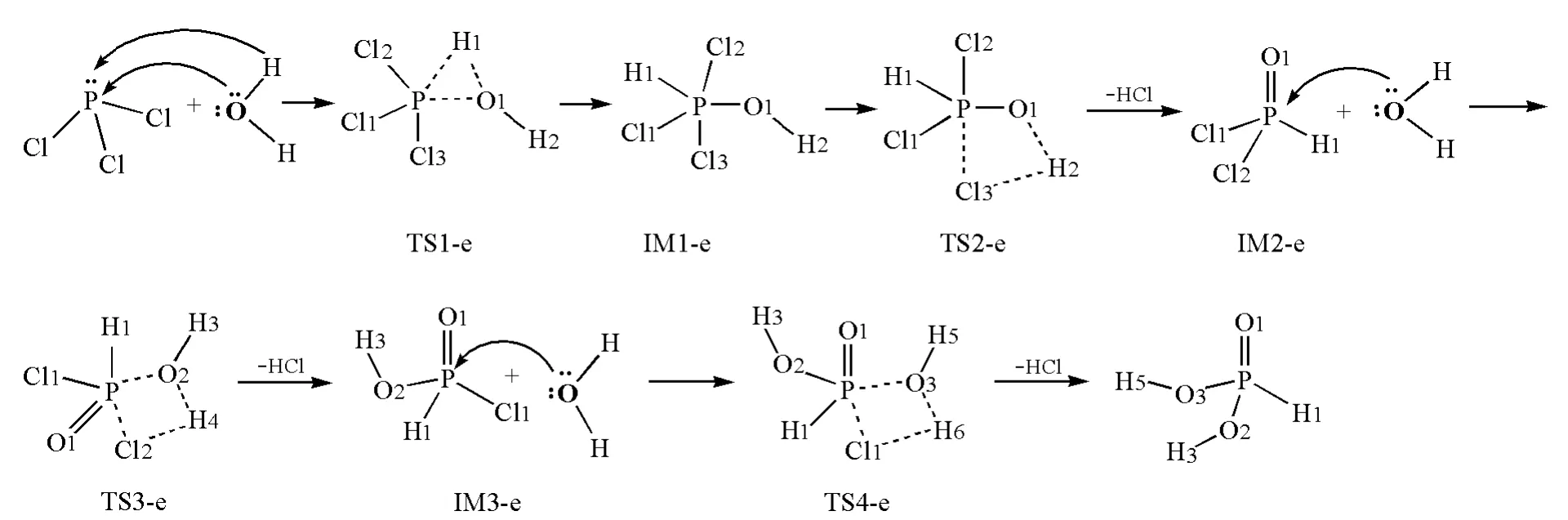
图1 PCl3同时发生亲电和亲核水解反应机理示意图
在B3LYP/6-311+G**水平上优化得到上述水解过程反应物、产物、中间体、过渡态的几何构型的主要参数见表1和表2。从表1和表2可见,PCl3、H2O、HCl及H3PO3分子优化后得到的键长及键角与文献值比较吻合,表明采用B3LYP/6-311+G**方法计算是合理的。
优化H3PO3的结构,得到两种可能的稳定结构,如图2所示。
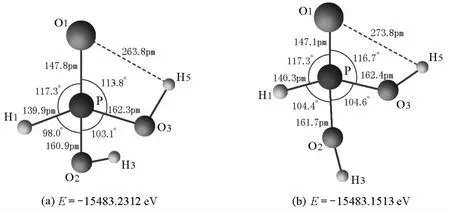
图2 H3PO3可能的稳定结构及能量
由图2可知,优化得到的H3PO3的可能结构均为C1点群,两个结构主要区别是H3的空间取向不同,(a)结构中的O1—H5间距为263.8pm,较(b)结构中的273.8pm小。(a)结构能量低,稳定,因此选择(a)结构作为讨论对象,其中P =O1键长为147.8pm,P—OH键长分别为160.9pm和162.3pm,与H3PO4中的P=O双键键长152pm及P—OH键长157pm[2]也很接近。H3PO3与H3PO4一样,P=O间也存在d-pπ键作用。
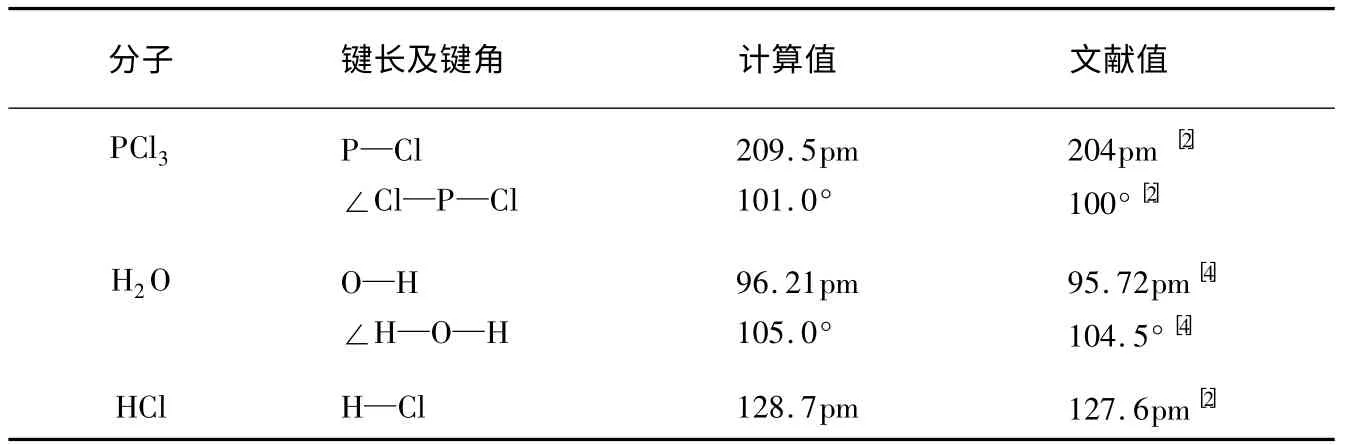
表1 PCl3、H2O及HCl的键长和键角(B3LYP/6-311+G**)
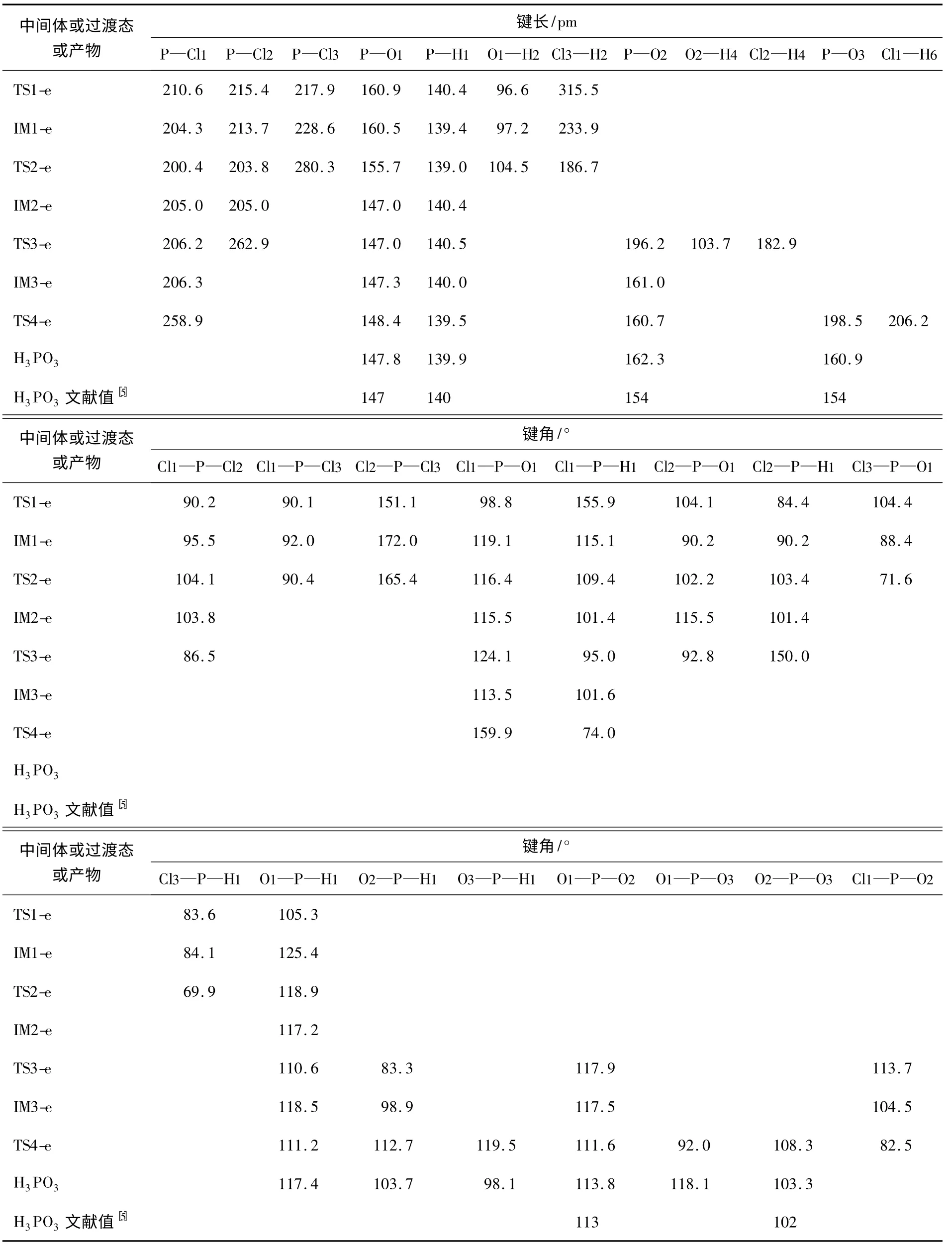
表2 PCl3同时发生亲电和亲核水解反应的中间体、过渡态及H3PO3的主要原子间距和键角(B3LYP/6-311+G**)
从图1和表2可看出,在PCl3同时发生亲电和亲核水解反应过程中,过渡态TS1-e、TS2-e、TS3-e和TS4-e及中间体IM1-e均是三角双锥构型,P采取sp3d杂化,TS1-e、IM1-e和TS2-e中的Cl2、Cl3原子位于轴向上,TS3-e中的H1、Cl2原子以及TS4-e中的O1、Cl1原子位于轴向上。TS1-e、IM1-e、TS2-e结构相似,从TS1-e到TS2-e,P—O1、P—H1及H2—Cl3间距逐渐变短,P—Cl3间距逐渐变长,直至形成HCl后脱去。
2.2 PCl3亲核水解反应机理[2]
将PCl3看作Lewis酸,水解第一步是H2O中的O进攻P,经过渡态TS1-n后脱去HCl,得到中间体IM1-n;水解反应第二步及第三步与第一步类似,均是H2O中的O进攻P,经过渡态TS2-n和TS3-n后脱去HCl,得到中间体IM2-n和IM3-n。IM3-n再经过过渡态TS4-n异构化为二元酸H3PO3。水解过程如图3所示。
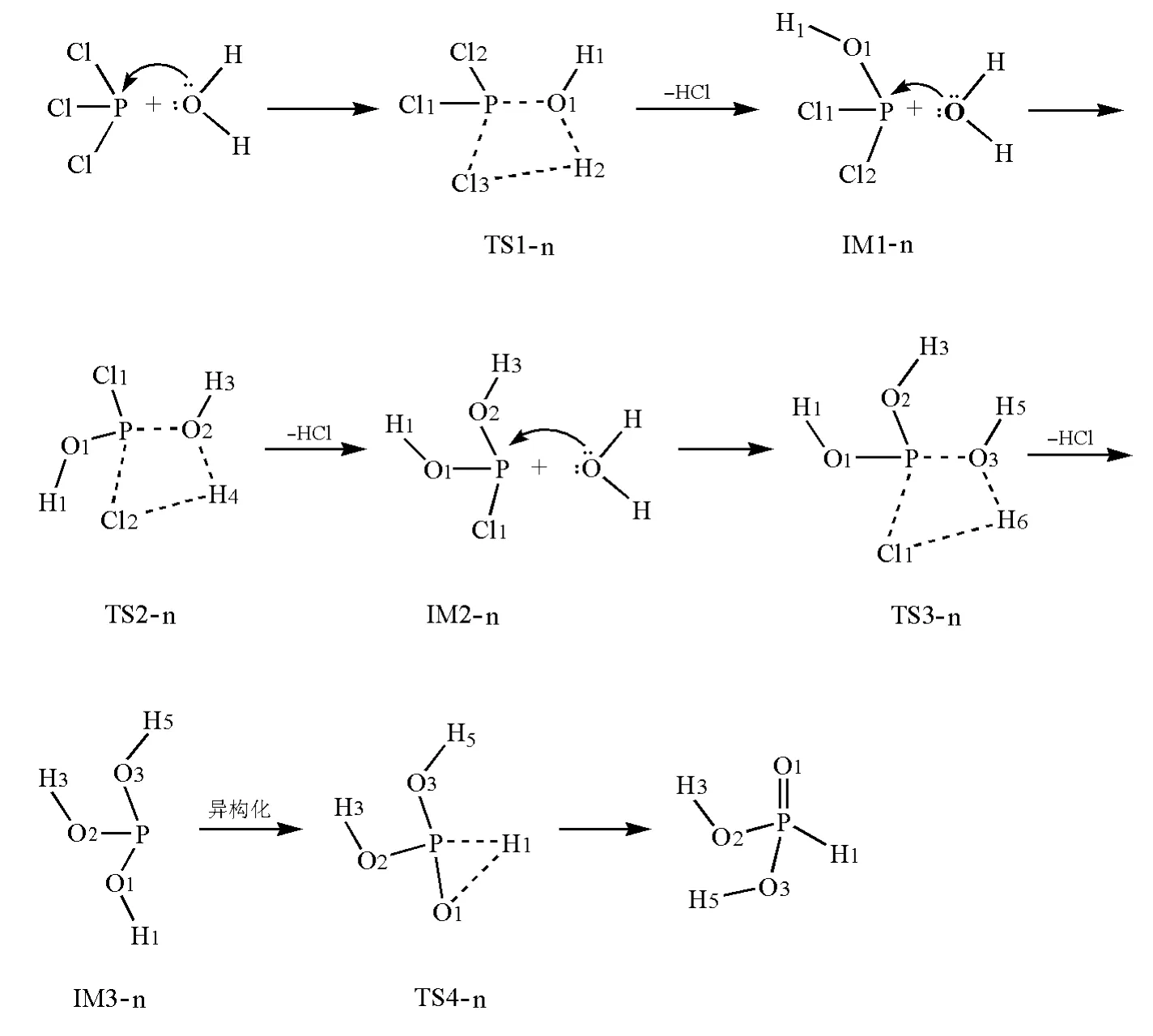
图3 PCl3亲核水解反应机理示意图
在B3LYP/6-311+G**水平上优化得到PCl3亲核水解反应过程的中间体和过渡态的几何构型的主要参数见表3。从图3和表3可看出,在PCl3亲核水解反应过程中,过渡态TS1-n、TS2-n、TS3-n和TS4-n均是四面体构型,P采取sp3杂化。
优化中间体IM2-n和IM3-n的结构,均得到3种可能的稳定结构,如图4和图5所示。
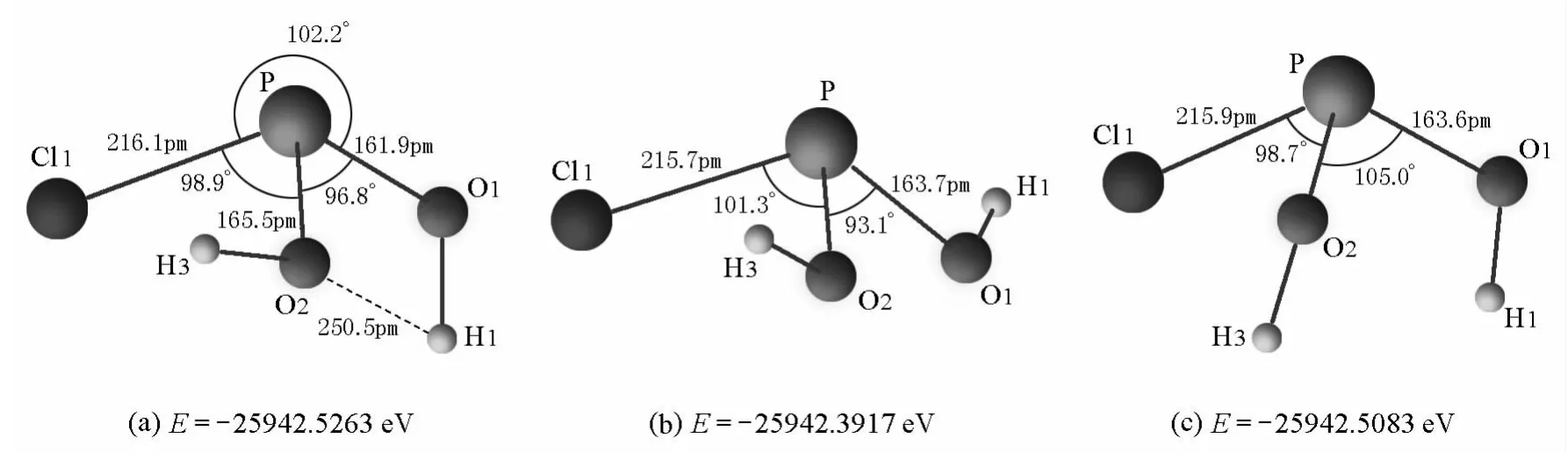
图4 IM2-n可能的稳定结构及能量
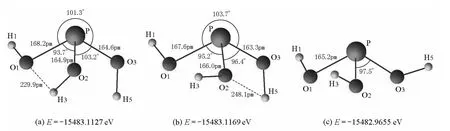
图5 IM3-n可能的稳定结构及能量
在IM2-n的3种可能的稳定结构中,(a)结构为C1点群,(b)、(c)结构为Cs点群。O和H的范德华半径分别为140pm和120pm[6],而IM2-n(a)结构中的O2—H1间距为250.5pm,小于O与H的范德华半径和(260pm),表明IM2-n的(a)结构中可能存在弱氢键,使得两个OH不等价,(a)结构能量最低。在IM3-n的3种可能的稳定结构中,(a)、(b)结构为C1点群,(c)结构为C3点群。(a)结构中O1—H3间距为229.9pm,(b)结构中O2—H5间距为248.1pm,均小于O与H的范德华半径和,表明IM3-n的(a)和(b)结构中也可能存在弱氢键,使得3个OH不等价,且(b)结构的能量比(a)结构还要低。因此,在讨论PCl3亲核水解反应过程中间体的几何构型时,选择IM2-n(a)和IM3-n(b)能量最低结构作为讨论对象。
IM3-n(b)结构中3个P—OH键长分别为163.3pm、166.0pm和167.6pm,比正常的P—O单键160pm[2]要长,说明P—OH键的结合力弱;3个键角∠O1—P—O2、∠O1—P—O3和∠O2—P—O3分别为95.2°、103.7°和96.4°,键角较小,3个OH基团间的排斥力增大。IM3-n不稳定,经过TS4-n异构化为最终水解产物H3PO3。尽管IM3-n中3个P—OH键不等价,3个H至P的距离及O—H键强度也稍有差别,异构化能垒自然也会有些差别,但不会太显著,所以本文仅以H1的转移为例进行异构化讨论。从IM3-n经TS4-n异构化为H3PO3,3个P—O键长均逐渐减小,3个键角∠O1—P—O2、∠O1—P—O3和∠O2—P—O3逐渐增大。TS4-n中P—O1的距离为156.0pm,介于H3PO3中P =O1键长(147.8pm)和P—OH键长(160.9pm)之间。
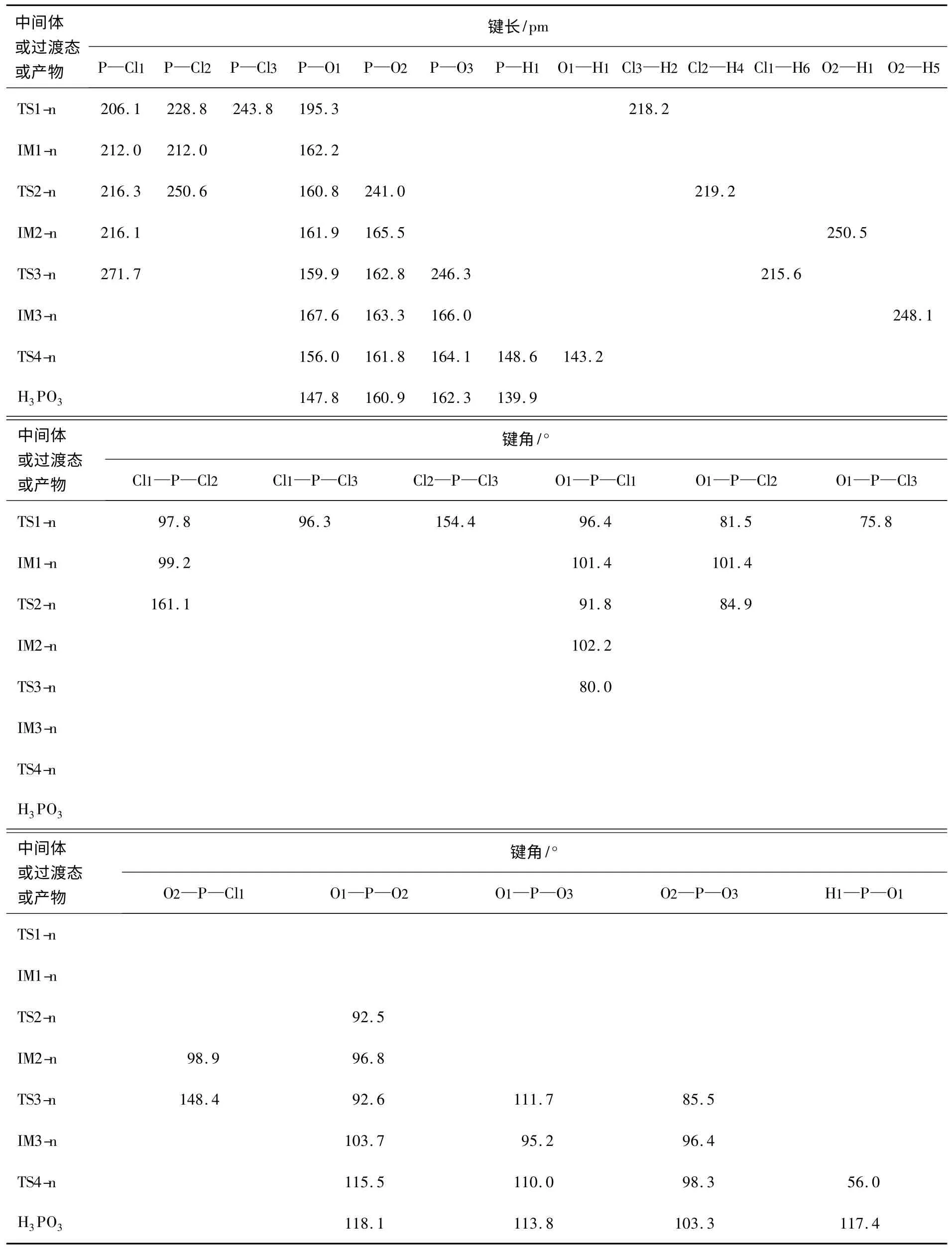
表3 PCl3亲核水解反应的中间体、过渡态及产物的主要原子间距和键角(B3LYP/6-311+G**)
2.3 PCl3两种水解机理的能量比较
在B3LYP/6-311+G**水平上优化两种水解反应过程中反应物、过渡态、中间体及产物结构后得到相应的总能量,并对总能量进行了零点能校正,结果见表4。从表4可以看出,二元酸H3PO3比中间体IM3-n更稳定。表5列出了两种水解机理各步水解反应的活化能。
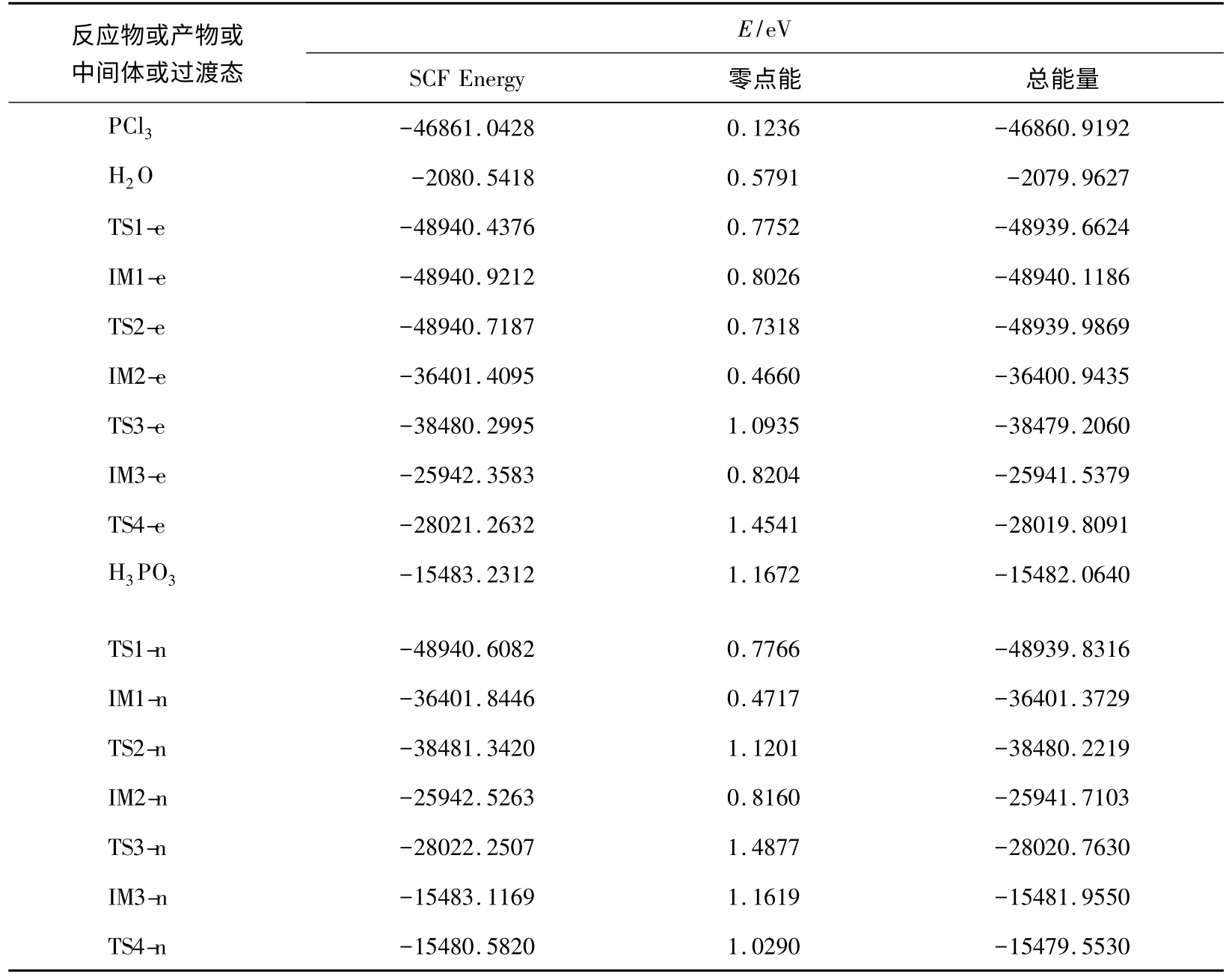
表4 PCl3两种水解反应机理中反应物、产物、中间体及过渡态的能量(B3LYP/6-311+G**)

表5 PCl3两种水解反应机理的活化能(B3LYP/6-311+G**)
从表5可以看出,就水解反应的第一步和第三步而言,亲核水解反应要比同时发生亲电和亲核水解反应需要的活化能低;但就水解反应的第二步和第四步来看,亲核水解反应需要的活化能要高,特别是亲核水解反应第四步从中间体IM3-n异构化为H3PO3的活化能为231.76kJ·mol-1,表明异构化速率很小,异构化难以进行。因此,PCl3同时发生亲电和亲核水解反应机理比发生亲核水解反应机理更容易进行。
3 小结
采用密度泛函理论在B3LYP/6-311+G**水平上对PCl3水解生成H3PO3的两种反应机理进行了理论研究。对两种水解反应机理活化能的研究表明,PCl3同时发生亲电和亲核水解反应比PCl3发生亲核水解更容易进行。
[1]唐宗薰.中级无机化学.北京:高等教育出版社,2003
[2]北京师范大学,华中师范大学,南京师范大学无机化学教研室.无机化学(下册).第4版.北京:高等教育出版社,2002
[3]Frisch M J,Trucks G W,Schlegel H B,et al.Gaussian03.Gaussian Inc,PittsbuPA,2003
[4]麦松威,周公度,李伟基.高等无机结构化学.北京大学出版社,香港中文大学出版社,2001
[5]Well A F.Structural Inorganic Chemistry.5th ed.Oxford University Press,1984
[6]迪安J A.兰氏化学手册.北京:科学出版社,1991
