Alcalase酶解羊乳酪蛋白制备ACE抑制肽的研究
2013-01-29舒国伟张秋红高丽嫚
陈 合, 王 娟, 舒国伟, 张秋红, 高丽嫚
(陕西科技大学 生命科学与工程学院, 陕西 西安 710021)
0 引言
心血管疾病以冠心病为主,冠心病又称冠状动脉硬化性心脏病,而高血压是动脉粥样硬化的重要危险因素,且血压水平与心血管发病危险呈正相关[1].2010年中国高血压防治指南指出,我国人群高血压患病率仍呈增长态势,每10个成人中就有2人患高血压;估计目前全国高血压患者至少2亿.
目前有6 种主要的降压药物常用于抗高血压药物的治疗,分别是利尿剂、α-受体拮抗剂、钙通道阻滞剂、血管紧张素转化酶抑制剂、血管紧张素Ⅱ受体拮抗剂和α-肾上腺素受体阻滞剂.这些药物虽然降压效果显著,但有毒副作用,如咳嗽、过敏性血管水肿及肾功能不全加重等[2].
有研究报道将食物蛋白质进行水解后形成的小分子多肽,即血管紧张素转化酶(ACE)抑制肽,具有显著的降血压作用,与普通降压药物比较无毒副作用,且对正常的血压无影响[3].
目前用于研究ACE 抑制肽的食物来源主要有乳蛋白、鱼蛋白、植物蛋白、发酵食品及天然ACE抑制肽.姜瞻梅等[4]利用胰蛋白酶、胃蛋白酶、木瓜蛋白酶、As.1398中性蛋白酶和Alcalase 5 种蛋白酶对牛乳酪蛋白水解,均得到了具有降血压作用的ACE抑制肽.
陕西是我国羊奶生产大省,奶山羊的存栏数、产奶量均居全国第一位.但羊乳产品品种少,仅限于羊奶粉、液态羊奶及大包装工业羊奶粉,产品科技含量不高,附加值低,因此开发功能性羊乳制品很有必要.本研究采用单因素方法,考察了温度、pH、酶添加量、底物浓度以及反应时间对Alcalase酶解羊乳酪蛋白制备ACE抑制肽中水解度及ACE抑制率的影响.
1 材料与方法
1.1 材料
1.1.1 原料与主要试剂
全脂羊奶粉 陕西红星乳业有限公司;Alcalase、血管紧张素转化酶(ACE)及Hip-His-Leu(HHL) 美国Sigma公司;乙酸乙酯 天津市天力化学试剂有限公司;硼酸 天津市登峰化学试剂厂;四硼酸钠(硼砂)天津市红岩化学试剂厂;盐酸 北京化工厂;氢氧化钠 西安化学试剂厂.
1.1.2 主要仪器设备
PHS-3C型酸度计上海精科仪器公司;78-1磁力加热搅拌器江苏省金坛市正基仪器有限公司;UV-5300PC型紫外分光光度计上海元析仪器有限公司;Q2-901型旋涡混合仪海门市其林贝尔仪器制造有限公司;FD-1D-50型真空冷冻干燥机北京博医康实验仪器有限公司;TG16A-WS型台式高速离心机湖南赛特湘仪离心机仪器有限公司;离心机 北京时代比利离心机有限公司.
1.2 试验方法
1.2.1 酪蛋白的制备
称取一定量的羊奶粉,按照 1∶9(重量/体积)加入蒸馏水配成羊乳,再经高速离心机 6 400 r/min离心15 min,制得脱脂乳.用1 mol/L HCL调 pH 至4.5,使酪蛋白沉淀, 6 400 r/min离心15 min,将沉淀与乳清分开,用蒸馏水反复洗涤酪蛋白沉淀,使其pH为7,离心分离得到沉淀,将沉淀预冻一定时间,冷冻干燥 24 h后备用.
1.2.2 ACE抑制肽的制备
精确称取一定量的酪蛋白,用热水溶解,置于温水浴锅中,待反应体系温度达到水解温度,加入HCL或NaOH,调节pH为酶最适pH.加入一定量的Alcalase酶水解,在水解过程中不断的搅拌,并不断的加入适量浓度的NaOH以维持pH值保持不变,记录加碱量和时间.到预定时间后,将反应体系在90 ℃水浴中保温10 min,终止反应.将水解物调节 pH=3.4~3.6后在5 000 r/min离心15 min,取上清液至管制瓶中调节pH=8.3,5 000 r/min再次离心15 min,取上清液备用.
1.3 测定方法
1.3.1 水解度的测定[5]
水解度的测定按照pH-STAT 法,计算公式为:
水解度DH%=(B×Mb)/(α×Mp×8.2)
公式中:B:NaOH的体积(mL);Mb:NaOH 的浓度(mol/L);1/α:酪蛋白水解反应的解离度的倒数;Mp:蛋白质的质量(g);8.2:每克原料蛋白质中肽键的毫摩尔数(mmol),对于酪蛋白,该值取8.2.
1.3.2 ACE抑制活性的体外检测[6]
此测定方法采用Cushman和Cheung的方法根据具体情况对反应体系的大小、乙酸乙酯的萃取量、离心速度等进行了一定改进.
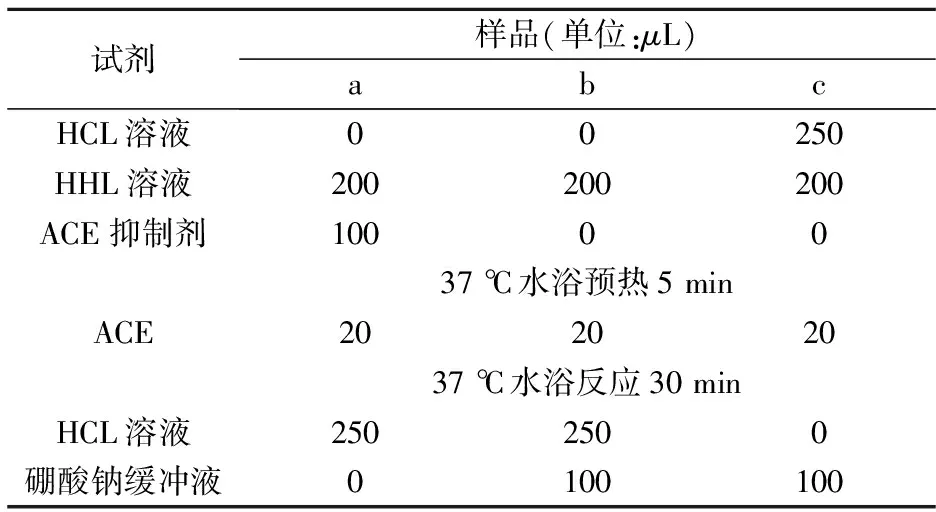
表1 ACE抑制率检测方法
据表1所示,将各试剂加入试管,于37 ℃水浴中反应30 min,反应结束后加入1 mol/L HCl终止反应,再加入乙酸乙酯1.7 mL,震荡15 s,静置5 min,取1 mL乙酸乙酯层,120 ℃烘箱30 min蒸干,冷却后重新溶解于3 mL去离子水中,波长228 nm处测定吸光度,由下式计算ACE抑制率:
ACE抑制率%=(Ab-Aa)/(Ab-Ac)×100%
式中:Ab为反应中不加ACE抑制剂的吸光度;Aa为反应中ACE抑制剂和ACE同时存在的吸光度;Ac是ACE和HHL空白反应的吸光度.
2 结果与分析
2.1 温度对Alcalase水解羊乳酪蛋白制备ACE抑制肽的影响
选定底物浓度10%,E/S5%,pH7.5条件下分别于45 ℃、50 ℃、55 ℃、60 ℃、65 ℃下水解2 h,结束后滴加0.1 mol/L NaOH至pH到7.5,计算水解度,取样4 mL,紫外分光光度法测定ACE抑制率,结果如图1所示.
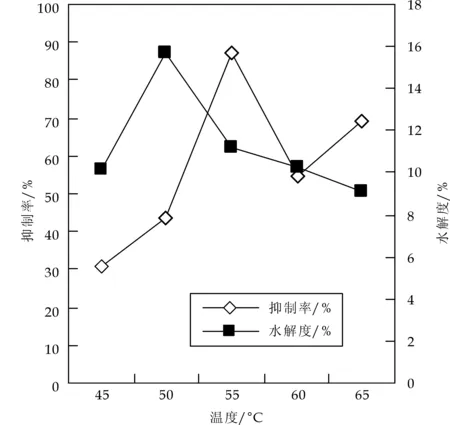
图1 温度对Alcalase水解羊乳酪蛋白制备ACE抑制肽的影响
由图1可知,在一定范围内,随着温度的升高,水解度逐渐增大,50 ℃时达最大,升到一定温度后水解度逐渐降低,而抑制率的变化不与水解度同步,没有固定的规律性,呈现出升高降低又升高的趋势,55 ℃时达最大,此时ACE抑制率和水解度分别为87.45%及11.2%.表明并非水解度越高,ACE抑制率越高,因为50 ℃时酪蛋白深度水解,破坏了已经产生的ACE抑制肽,导致ACE抑制率的降低.需将水解度控制在适当的水平,选择55 ℃为水解温度.
2.2 pH对Alcalase水解羊乳酪蛋白制备ACE抑制肽的影响
选定底物浓度10%,E/S5%,55 ℃条件下,分别于pH为6.5、7、7.5、8、8.5下水解2 h,测定对应pH下的水解度及酪蛋白水解液的ACE抑制率,结果如图2所示.
由图2可知,在一定范围内,随pH值的升高,水解度不断升高,pH7.5时水解度达最大值,此后,随着pH值的继续升高,水解度开始减小,而ACE抑制率的变化不与水解度同步,呈现出增大减小又增大的趋势,在pH为7.0时取得最大值,ACE抑制率和水解度分别为88.4%及6.06%.洪伟[7]等人研究了Alcalase水解牛乳酪蛋白制备ACE抑制肽,发现在pH 7.5时,ACE抑制率达到了最大,说明Alcalase作用于牛乳与羊乳酪蛋白时,最适pH有差异.
2.3 酶添加量对Alcalase水解羊乳酪蛋白制备ACE抑制肽的影响
选定底物浓度10%,pH7.5,温度T 55 ℃条件下,分别于酶添加量E/S为3%、4%、5%、6%、7%时水解2 h,测定对应E/S时的水解度和ACE抑制率,结果如图3所示.
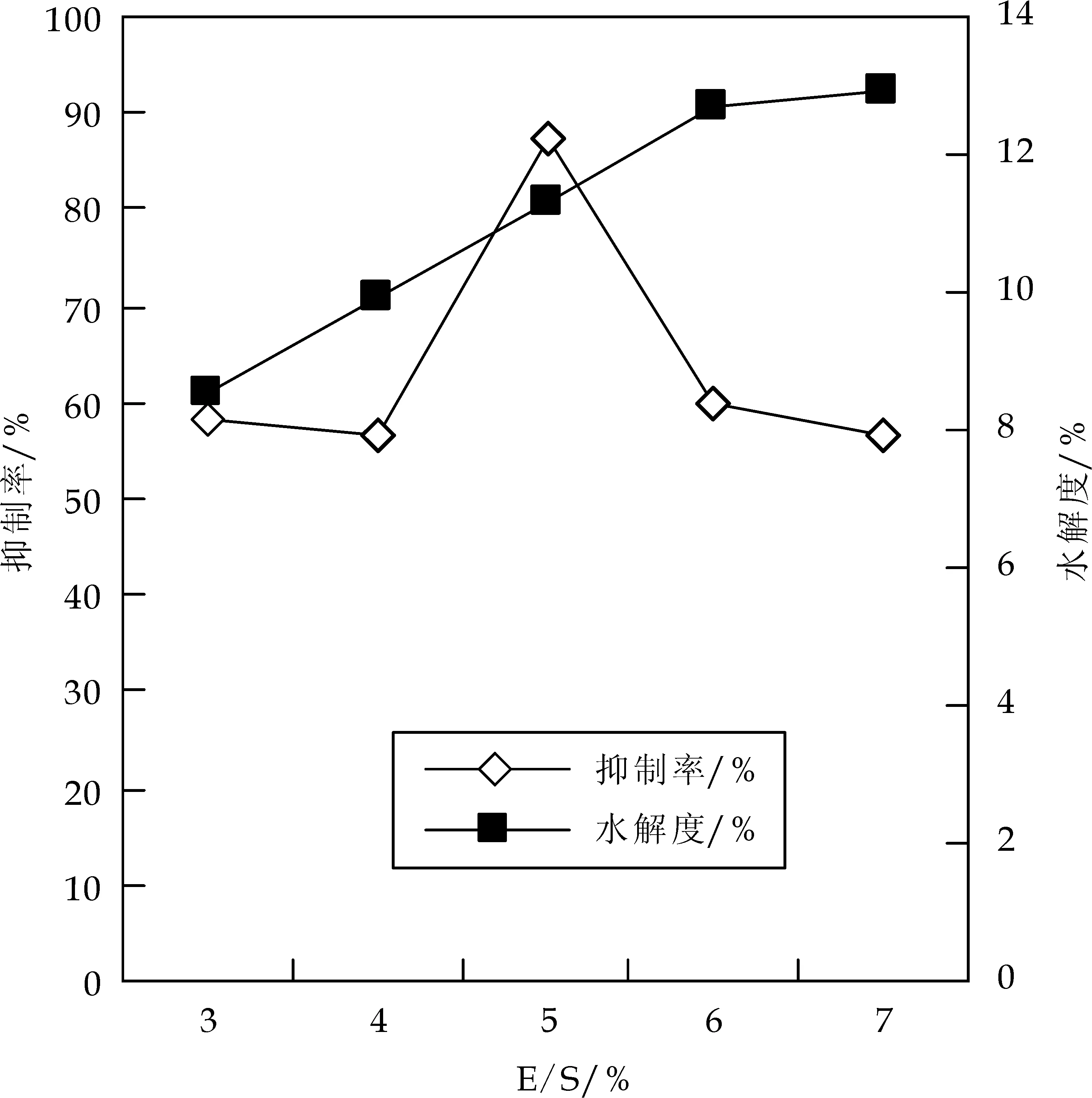
图3 E/S对Alcalase水解羊乳酪蛋白制备ACE抑制肽的影响
由图3可知,随着E/S的增加,水解度不断增大,最后几乎趋于不变,而抑制率的变化趋势不与水解度同步,大致呈现出增大又减小的趋势,在E/S为5%时,酪蛋白水解液的ACE抑制率达到最大,ACE抑制率和水解度分别为87.27%及11.3%.其原因在于水解初产生的ACE 抑制肽与酶分子结合后,又与底物结合,形成了抑制剂-酶-底物的三元复合物,酶分子不再催化底物反应,形成了非竞争性抑制.
2.4 底物浓度对Alcalase水解羊乳酪蛋白制备ACE抑制肽的影响
选定pH7.5,温度55 ℃,E/S5%,分别在底物浓度为2%、4%、6%、8%、10%和12%时水解2 h,测定对应底物浓度时的水解度和ACE抑制率,结果如图4所示.

图4 底物浓度对Alcalase水解羊乳酪蛋白制备ACE抑制肽的影响
由图4可知,随着底物浓度的增加,水解度不断升高,最后几乎趋于不变,而抑制率的变化大致呈先增大后减小的趋势,在底物浓度为10%时,酪蛋白水解液的ACE抑制率达到最大,ACE抑制率和水解度分别为86.8%及12.82%.表明水解初期,底物浓度大,有利于水解,水解度及ACE抑制率迅速增大.
2.5 水解时间对Alcalase水解羊乳酪蛋白制备ACE抑制肽的影响
选定底物浓度10%,E/S5%,pH7.5,温度55 ℃条件下,分别将酪蛋白在Alcalase酶作用下水解30、60、90、120、150、180、210、240 min,测定不同时间下的水解度和ACE抑制率,结果如图5所示.

图5 水解时间对Alcalase水解羊乳酪蛋白制备ACE抑制肽的影响
由图5可知,随着水解时间的增加,水解度不断升高,最后几乎趋于不变,而抑制率的变化大致呈先增大后减小的趋势,水解到120 min时,酪蛋白水解液的ACE抑制率达到最大,ACE抑制率和水解度分别为89.09%及18.91%.表明水解前120 min,酪蛋白水解较为充分,生成了大量的ACE抑制肽,120 min后,水解度基本不变,而ACE抑制率迅速减小.
3 结论
研究了Alcalase 酶解羊乳酪蛋白制备ACE抑制肽的影响因素,确定了最佳的酶解条件为:温度55 ℃、pH 7.0、酶添加量E/S5%、底物浓度10%、水解时间120 min.为Alcalase水解羊乳酪蛋白制备ACE抑制肽提供了理论参考和技术支撑,对开发陕西羊乳资源、提高羊乳制品的功效和附加值、丰富羊乳的花色品种有重要意义.
[1] 王佳佳,胡志和.乳源ACE抑制肽的制备及应用[J].食品科学,2012,33(3):286-291.
[2] Jing Bo Liu,Zhi Peng Yu,Wen Zhu Zhao,et al.Isolation and identification of angiotensin-converting enzyme inhibitory peptides from egg white protein hydrolysates[J].Food Chemistry,2010,122:1 159-1 163.
[3] Fazheng Ren,Shunliang Zhang,Huiyuan Guo,et al.Systemic screening of milk protein-derived ACE inhibitors through a chemically synthesised tripeptide library[J].Food Chemistry,2011,128:761-768.
[4] 姜瞻梅,田 波,吴 刚,等.酶解牛乳酪蛋白制备ACE 抑制肽的研究[J].中国食品学报,2007,7(6):39-43.
[5] 王海燕.发酵乳中降血压产品的制备工艺[D].保定:河北农业大学,2002.
[6] 姜瞻梅,吴 刚,刘丽波,等.酪蛋白源降血压肽稳定性及其抑制作用机理的研究[J].食品科学,2008,29(4):249-252.
[7] 洪 伟,薛正莲,陈 玲.酪蛋白制备ACE抑制肽的酶解工艺优化[J].食品与发酵科技,2010,46(2):37-40.
