生物表面活性剂逆胶束中漆酶催化性能的研究
2013-01-18彭子原袁兴中黄华军崔凯龙赵艳鸽
彭子原,袁兴中*,彭 馨,黄华军,崔凯龙,赵艳鸽
(1.湖南大学环境科学与工程学院,湖南 长沙410082;2.湖南大学环境生物与控制教育部重点实验室,湖南 长沙 410082)
逆胶束(RMS,也称反胶团、反胶束)是由溶解在含有微量水的有机溶剂中的表面活性剂自组装形成的聚集体[1].其中,表面活性剂分子疏水的非极性尾部指向有机溶剂,亲水的极性头部聚集形成纳米级中心水核[2],可增溶酶等亲水性物质.逆胶束具有独特的结构特征,其中心水核能较好的模拟酶的天然微环境[3],其极性头部壳能隔离酶与有机溶剂[4].这些特征使逆胶束能有效提高多种酶在有机相中的活性及稳定性.因此,近年来逆胶束酶体系受到越来越多的关注.
漆酶(Laccase,E.C.1.10.3.2)是一种含铜的氧化酶,存在于高等植物、白腐真菌、细菌等多种生物之中,可催化氧化大部分酚类和芳香胺类化合物[5],目前已被广泛应用于有机合成、生物制药、生物检测、食品工业、造纸工业等领域[6],有较高的工业应用价值.除此之外,研究发现,由于具有催化木质纤维素降解、催化酚类污染物氧化及使偶氮染料脱色等特性,漆酶在降解含木质纤维素的废弃物、处理含酚类污染物的工业废水及印染废水脱色等环境保护相关领域也有很大的发展潜力[6],被誉为“绿色化学的酶”[7].因此,研究漆酶催化性能对资源节约、环境保护有着重要意义.
以往对漆酶的研究多局限于水介质中[8-9],逆胶束酶体系出现后漆酶在逆胶束中的催化性能开始受到关注.传统的逆胶束酶体系通常采用化学表面活性剂.由于化学表面活性剂具有毒性、难溶解性、难生物降解性等缺点,使用化学表面活性剂构建的逆胶束体系不仅会对包裹其中的酶产生毒性,不利于其活性的保持,还可能对环境造成二次污染[10].同传统化学表面活性剂相比,生物表面活性剂直接产生于生物的代谢过程,具有低毒性、可生物降解性、生态相容性等优点,是环境友好型的天然表面活性剂,其研究对于推进逆胶束酶体系的应用意义重大[11].然而目前对基于生物表面活性剂的逆胶束体系中酶的催化性能的研究报道仍然较少.
本文采用生物表面活性剂——鼠李糖脂(RL)构建逆胶束,研究了漆酶在该体系中的催化性能.以单因素实验分别考察了有机相组成、RL浓度、逆胶束体系含水率W0、缓冲溶液酸碱度及盐浓度对该体系中漆酶的活性及稳定性的影响.此外,通过与同浓度传统化学表面活性剂磺基琥珀酸二乙基己酯钠(AOT)逆胶束体系中漆酶的催化性能的对比,旨在证明生物表面活性剂逆胶束体系在保持酶催化性能上的优越性,为生物表面活性剂逆胶束酶体系的发展及应用提供参考.
1 材料与方法
1.1 材料
1.1.1 主要试剂 2,6-二甲氧基酚(2,6-DMP,Sigma)、漆酶(Sigma)、磺基琥珀酸二乙基己酯钠(AOT,Sigma),鼠李糖脂RL(实验室自制[12]),正己醇、异辛烷、柠檬酸、柠檬酸钠、氯化钾等其他试剂均为国产分析纯,水为去离子水.
1.1.2 主要仪器 紫外分光光度计(Shimadzu UV-2552,Japan);pH计(PHS-2F,上海雷磁仪器厂);磁力搅拌仪(RCT,IKA);电子天平(AL204,梅特勒-托利多仪器有限公司);超声波清洗仪(JMTD-A3,北京金门通达机电设备有限公司).
1.2 实验方法
1.2.1 逆胶束酶体系的配制 以一定比例的正己醇/异辛烷混合溶剂作为逆胶束油相,以10mmol/L的一定pH值和KCl浓度的柠檬酸-柠檬酸钠缓冲溶液作为水相.将10μL漆酶浓度为10mg/mL的含酶缓冲溶液和一定量相同pH值和KCl浓度纯缓冲溶液加入含有5mL混合有机溶剂的锥形瓶中,磁力搅拌至均匀,制得RL-正己醇/异辛烷-漆酶逆胶束溶液.通过调节含酶缓冲溶液和纯缓冲溶液的pH值和KCl浓度控制逆胶束酶体系的水相酸碱度和盐浓度,调节纯缓冲溶液体积控制体系的含水量.逆胶束的含水量以含水率W0(无量纲,其大小等于缓冲液总摩尔浓度与表面活性剂摩尔浓度之比)来表示.
1.2.2 漆酶酶活测定 漆酶能催化氧化2,6-二甲氧基酚(2,6-DMP,以下简称DMP),其聚合产物C-C偶氮联合物 3,5,3′5′-四甲氧基二苯醌(TMDQ)在470nm处有特征吸收峰.以DMP为底物可测定逆胶束中漆酶的酶活.取2.9mL配制好的RL-正己醇/异辛烷-漆酶逆胶束溶液,加入100μL 300mmol/L的DMP-正己醇/异辛烷混合溶液,迅速振荡均匀,室温下反应3min,并使用紫外分光光度计测量470nm处该混合体系吸光度随时间的变化曲线.以初始反应速率定义漆酶酶活,一个酶活单位(U)定义为每分钟1mg漆酶催化DMP氧化所引起的吸光度改变量.
1.2.3 逆胶束体系中漆酶催化性能的表征 配制一定参数的RL-正己醇/异辛烷逆胶束-漆酶体系后迅速测定体系中漆酶酶活,将该值定义为体系的初始酶活(IA);将配制好的逆胶束酶体系于室温下静置90min后再次测定体系中的漆酶酶活,将该值定义为体系的剩余酶活(RA);定义剩余酶活与初始酶活的比例为体系中漆酶的相对稳定性 (RS).
2 结果与讨论
2.1 有机溶剂组成对漆酶催化性能的影响
与大多数表面活性剂一样,鼠李糖脂只有在助表面活性剂存在的条件下才能在异辛烷中形成稳定的逆胶束.助表面活性剂是一类对表面活性剂分子有强吸引力的油溶性化合物,它能增加表面活性剂在烃中的溶解度,减弱表面活性剂极性头部间的相互作用,使他们更容易聚集成逆胶束极性外壳[13].助表面活性剂与有机溶剂一起构成逆胶束的有机相,其具体组成比例将对其中酶的催化性能产生重大影响.本实验以异辛烷为溶剂,以常用助表面活性剂正己醇为助表面活性剂构建鼠李糖脂逆胶束,设置一系列正己醇/异辛烷体积比(V正己醇/V异辛烷分别为 1:2;1:1.8;1:1.6;1:1.4;1:1.2;1:1),以改变有机相的组成,研究其对逆胶束中漆酶催化性能的影响,其结果如图1所示(每个实验3个平行,取平均值,其他实验同理).其他参数分别为:鼠李糖脂浓度 13mmol/L,含水率W0=42,水相pH 5.0,水相KCl浓度10mmol/L.

图1 有机相组成对RL逆胶束中漆酶催化性能的影响Fig.1 Effect of organic phase on the catalytic performance of laccse in RL-RMS
由图 1 看出,当V正己醇/V异辛烷低于 1:1.8(正己醇体积分数为35.7%)时,适当增加正己醇含量,逆胶束中漆酶的活性及稳定性均有所提高,这可能是因为较低浓度醇的加入能增加逆胶束结构的刚性[14],且能减弱表面活性剂极性头部与酶蛋白之间的相互作用[15],从而减缓酶在逆胶束中心的失活.但当其体积比超过1:1.8后,继续增加正己醇含量漆酶的活性及稳定性都明显降低,这可能是由于过高浓度的醇抑制了逆胶束界面的流动性,降低了酶与底物接触的几率,从而导致酶活的下降[16].此结果与AOT逆胶束中正己醇含量对角质酶活性的影响[14]及CTAB逆胶束中正己醇对木素过氧化物酶活性影响[15]的研究结果类似.
2.2 RL浓度对漆酶催化性能的影响
作为逆胶束的重要组成之一,表面活性剂对维持逆胶束的特殊结构及逆胶束体系中酶的催化性能至关重要[2].保持其他条件不变(V正己醇/V异辛烷=1:1.8,含水率W0=42,水相 pH5.0,水相 KCl浓度10mmol/L),设置一系列RL浓度,考察鼠李糖脂浓度对体系中漆酶催化性能的影响,其结果如图2所示.

图2 RL浓度对RL逆胶束中漆酶催化性能的影响Fig.2 Effect of RL concentration on the catalytic performance of laccse in RL-RMS
图2显示,当鼠李糖脂浓度低于13mmol/L时,逆胶束体系中漆酶的初始酶活、剩余酶活和相对稳定性随着其浓度的增加而上升,当RL浓度达到13mmol/L时,3项指标均达到最大值.但当其浓度超过该值后,继续增加RL含量反而会对漆酶的活性产生抑制,其稳定性也随之下降.此结果与张文娟等[17]对木素过氧化物酶在Brij30逆胶束中催化性能的研究结果相似.
表面活性剂对逆胶束酶体系的具体作用机理较为复杂.目前普遍认为表面活性剂浓度主要通过影响逆胶束聚集体数目等性质及酶和底物在逆胶束体系中的分配这2个方面来影响酶在逆胶束体系中的催化性能[18]:在较小范围内,提高RL浓度能增加逆胶束聚集体的数目,有利于漆酶在逆胶束中心水核的溶解,同时也增加了酶与底物相互作用的聚集体的数目,使酶的催化活性及稳定性提高.然而浓度过高的RL可能抑制底物或产物在有机相及逆胶束中心水核间的扩散,进而影响逆胶束中酶的催化性能[19].
2.3 含水率W0对漆酶催化性能的影响
缓冲溶液总含量与表面活性剂含量的摩尔比为逆胶束酶体系的含水率W0,它是决定逆胶束酶体系中酶催化性能的主要因素之一.图3为逆胶 束体系中V正己醇/V异辛烷=1:1.8,RL 浓度13mmol/L,水相 pH5.0,缓冲溶液 KCl浓度10mmol/L时,不同W0对漆酶催化性能的影响.

图3 含水率W0对RL逆胶束中漆酶催化性能的影响Fig.3 Effect of W0on the catalytic performance of Laccase in RL-RMS
结果表明,体系中漆酶的催化活性随W0的变化曲线为钟罩型曲线:当体系含水率较低时,增大W0将显著提高漆酶的初始酶活及剩余酶活,当W0=42时,2项指标达到峰值,但超过此临界值后继续增大W0,初始酶活和剩余酶活迅速下降.逆胶束中的水以自由水和结合水2种形式存在[20].当逆胶束体系含水率过低时,大部分水都是与表面活性剂相结合的结合水,自由水含量较少,中心水核粒径较小,限制了酶构象的变化,使其难以转化为具有催化作用的活性构象,因此表现出来的酶活较低;然而过高的含水率会使逆胶束中心水核自由水过多,大大增加了酶的流动性,不利于其活性构象的保持,也将影响酶的活性[14].
与酶活的变化规律不同,随W0增加,逆胶束酶体系中漆酶的相对稳定性呈递减趋势.这是因为在较高含水率下,酶结构的刚性减弱,容易失活[21].从图3看出,当W0低于42时,随含水率的上升,漆酶活性增加迅速,与之相比相对稳定性下降得较为缓慢,综合考虑,在后续实验中含水率均采用42.
2.4 水相酸碱度对漆酶催化性能的影响
逆胶束中酶所处微环境的pH值决定了酶所带电荷的种类,其改变将对逆胶束中酶的催化构象、溶解能力及酶与表面活性剂分子间相互作用力产生影响,从而影响逆胶束中酶的催化性能[22].固定其它条件不变(V正己醇/V异辛烷=1:1.8,RL 浓度13mmol/L,W0=42,KCl浓度10mmol/L),通过改变缓冲溶液pH值控制逆胶束酶体系中水相的pH值,观察逆胶束水相pH值的改变对体系中漆酶催化性能的影响,其结果如图4所示.
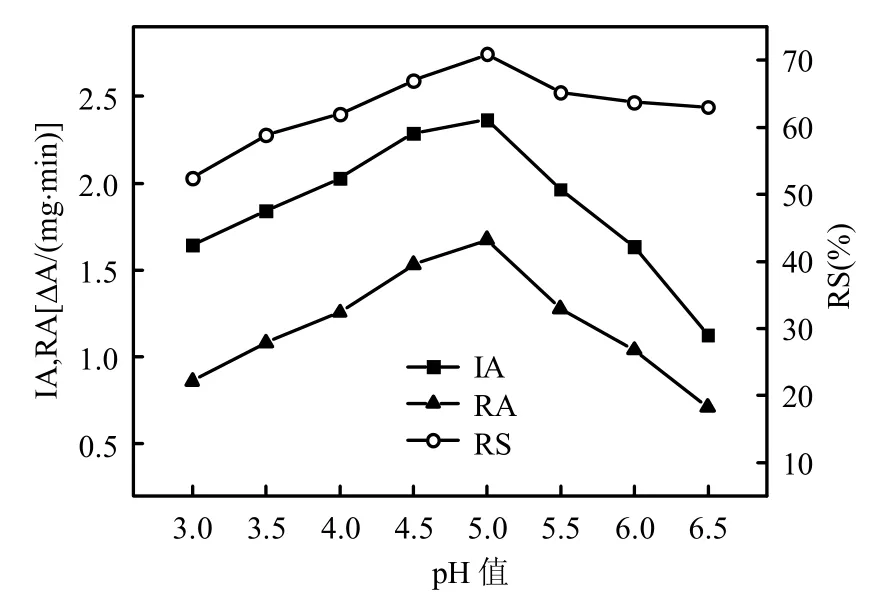
图4 水相pH值对RL逆胶束中漆酶催化性能的影响Fig.4 Effect of aqueous phase pH value on the catalytic performance of laccase in RL-RMS
从图4看出,当水相pH值在3.0~5.0之间时,体系中漆酶活性与水相pH值呈正相关,当pH>5.0时,继续增大pH值漆酶活性下降.漆酶稳定性随水相pH值变化的规律与其活性变化规律一致.此结果与Carvalho等[18]的研究结果相似.该结果说明,在RL逆胶束体系中漆酶表现最高催化性能的最适pH值为5.0,该值略高于其在水溶液中的最适pH值(约为4.5),类似的情况在以往对逆胶束酶体系的研究中也常见报道[5,23].这可能是因为鼠李糖脂是阴离子表面活性剂,其表面所带的负电荷能提高界面周围的质子浓度,使界面周围的局部pH值下降,从而导致酶的最适水相pH值向高值移动[24].
2.5 水相盐浓度对漆酶催化性能的影响
逆胶束中心水核盐浓度对逆胶束体系中酶的催化性能有显著影响,是构建逆胶束酶体系时是因考虑的另一因素.以KCl为代表,研究盐浓度对RL逆胶束中漆酶催化性能的作用.图5固定逆胶束酶体系其他条件参数不变(V正己醇/V异辛烷=1:1.8,RL 浓度 13mmol/L,含水率W0=42,水相pH5.0),仅改变RL逆胶束缓冲溶液KCl浓度时漆酶活性及稳定性的变化趋势.
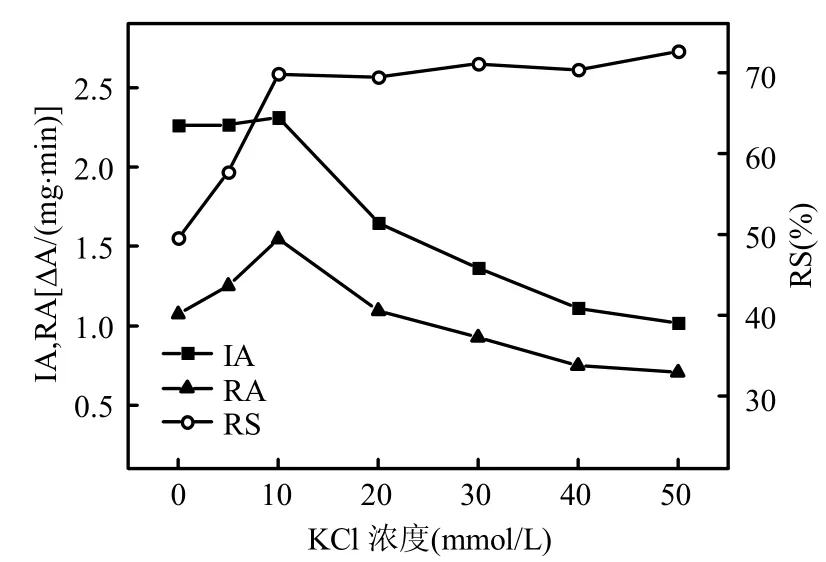
图5 水相KCl浓度对RL逆胶束中漆酶催化性能的影响Fig.5 Effect of aqueous phase KCl concentration on the catalytic performance of laccase in RL-RMS
逆胶束中心水核盐浓度主要通过改变逆胶束结构和酶的性质2个方式来影响逆胶束中酶的催化性能.水相中的盐离子能影响表面活性剂分子极性头部间的静电作用,从而引起逆胶束聚集体大小和数目的改变[14].当盐浓度较低时,适当增加盐浓度能缩小逆胶束中心水核的体积,增加逆胶束结构的刚性,有利于溶解在其中的酶保持其催化活性[14].然而过高浓度的盐可能使酶蛋白变性失活.由图5看出,当逆胶束酶体系中水相KCl浓度低于10mmol/L时,增加其含量虽然对漆酶初始酶活的影响较小,却能显著提高其相对稳定性.但当KCl浓度超过该值后,继续增大其浓度漆酶相对稳定性不再有明显提高,却将使酶活迅速下降.综合考虑,认为10mmol/L为该逆胶束体系中漆酶催化反应的最适水相KCl浓度.
2.6 与化学表面活性剂逆胶束的对比
不同种类的表面活性剂会对溶解在其中的酶的催化性能产生不同的影响.本课题组在前期研究中已发现,与水介质相比,鼠李糖脂逆胶束中的漆酶具有更好的催化性能[25].为进一步探讨其与传统化学表面活性剂逆胶束对漆酶催化作用影响的差异,比较了相同表面活性剂浓度的鼠李糖脂逆胶束与常用化学表面活性剂AOT逆胶束中,漆酶在各自最适条件下的催化性能,其结果如表1所示.

表1 RL逆胶束与AOT逆胶束中漆酶催化性能的对比Table 1 Comparison of laccase’s catalytic performance in synthetic surfactant-based reverse micelle and RL-RMS
表1显示,RL逆胶束中漆酶的初始酶活高于同浓度AOT逆胶束中的初始酶活,AOT逆胶束中漆酶的活性在90min内下降到50%以下,而RL逆胶束中的漆酶具有较好的稳定性,其活性在90min后仍维持在70%左右.这是因为人工合成的化学表面活性对溶解在其逆胶束中的酶具有一定的毒性,而鼠李糖脂是产生自生物的代谢过程中的生物表面活性剂,它对生物的毒性较低,具有更高的生物相容性,使溶解在其逆胶束中的酶表现出较好的催化性能[10].说明与传统化学表面活性剂相比,生物表面活性剂在构建逆胶束酶体系上具有一定的优越性.
3 结论
3.1 漆酶在基于鼠李糖脂生物表面活性剂构建的逆胶束中具有较高的催化活性及较好的稳定性,其大小受到逆胶束有机相组成、表面活性剂浓度、含水率W0、水相酸碱度、水相盐浓度等条件的影响.在鼠李糖脂-正己醇/异辛烷逆胶束中,漆酶体现出最佳催化性能的条件为:正己醇/异辛烷体积比为1:1.8,RL浓度为13mmol/L,含水率W0=42,水相pH5.0,水相KCl浓度10mmol/L.
3.2 鼠李糖脂逆胶束中漆酶的活性和稳定性均高于同浓度的AOT逆胶束,说明使用生物表面活性剂代替化学表面活性剂有利于提高逆胶束体系中酶的催化性能.
[1]Melo E P,Aires-Barros M R,Cabral J M S.Reverse micelles and protein biotechnology[J].Biotechnology Annual Review,2001,7:87-129.
[2] 梁运姗,袁兴中,曾光明,等.表面活性剂在逆胶束酶反应体系中的作用机制 [J].中国科学,2011,41(5):763-772.
[3] Chen C W,Ou-Yang C C,Yeh C W.Synthesisof galactooligosaccharides and transgalactosylation modeling in reverse micelles[J].Enzyme and Microbial Technology,2003,33(4):497-507.
[4]Andrade S L A,Brondino C D,Kamenskaya E O,et al.Kinetic behavior of Desulfovibrio gigas aldehyde oxidoreductase encapsulated in reverse micelles[J].Biochemical and Biophysical Research Communications,2003,308(1):73-78.
[5]Okazaki S,Michizoe J,Goto M,et al.Oxidation of bisphenol A catalyzed by laccase hosted in reversed micelles in organic media [J]. Enzyme and Microbial Technology,2002,31(3):227-232.
[6]Mayer A M,Staples R C.Laccase:new functions for an old enzyme[J].Phytochemistry,2002,60(6):551-565.
[7]Riva S.Laccases:blue enzymes for green chemistry[J].Trends in Biotechnology,2006,24(5):219-226.
[8]Kim Y J,Nicell J A.Impact of reaction conditions on laccase-catalyzed conversion of bisphenol A [J].Bioresorce Technology,2006,97(12):1431-1442.
[9]Franciscon E,Piubeli F,Fantinatti-Garboggini F,et al.Polymerization study of the aromatic amines generated by the biodegradation of azo dyes using the laccase enzyme[J].Enzyme and Microbial Technology,2010,46(5):360-365.
[10]崔凯龙,袁兴中,曾光明,等.生物表面活性剂用于逆胶束体系的构建及微水相条件优化 [J].中国环境科学,2011,31(9):1444-1450.
[11]王伟伟,袁兴中,曾光明,等.逆胶束体系中纤维素酶降解特性的研究 [J].环境科学,2010,31(9):2202-2207.
[12]Liang Y S,Yuan X Z,Zeng G M,et al.Biodelignification of rice straw by Phanerochaete chrysosporium in the presence of dirhamnolipid[J].Biodegeration,2010,21(4):615-624
[13]Tonova K,Lazarova Z.Reversed micelle solvents as tools of enzyme purification and enzyme-catalyzed conversion[J].BiotechnologyAdvances,2008,26(6):516-532
[14]Biasutti M A,Abuin E B,Silber J J,et al.Kinetics of reactions catalyzed by enzymes in solutions of surfactants[J].Advances in Colloid and Interface Science,2008,136(1/2):1-24
[15]张文娟,王丹,黄锡荣,等.直链醇对反胶束体系中木素过氧化物酶催化活性的影响 [J].化学学报,2005,63(21):2009-2012.
[16]Lopez F,Cinelli G,Ambrosone L,et al.Role of the cosurfactant in water-in-oil microemulsion:interfacial properties tune the enzymatic activity of lipase[J].Colloids and Surfaces A:Physicochemical and EngineeringAspects,2004,237(1):49-59.
[17]张文娟,王 丹,黄锡荣,等.非离子反胶束中木素过氧化物酶催化性能研究 [J].生物工程学报,2005,21(4):654-657.
[18]Carvalho C M L,Cabral J M S.Reverse micelles as reaction media for lipases[J].Biochime,2000,82(11):1063-1085.
[19]Franquevile E,Loutrari H,Mellou F,et al.Reverse micelles,a system for antibody-catalysed reaction[J].Journal of Molecular Catalysis B:Enzymatic,2003,21(1/2):15-17.
[20]Venables D S,Huang K,Schmuttenmaer C A.Effect of reverse micelle size on the librational band of confined water and methanol[J].The Journal of PhysicalChemistry B,2001,105(38):9132-9138.
[21]张玉霞,赵继华,杜中玉,等.AOT/Triton X-100混合反胶束体系中假丝酵母脂肪酶催化蓖麻油水解的活性 [J].物理化学学报,2007,23(9):1483-1486.
[22]刘伟东,聂开立,鲁吉珂,等.反胶束体系中脂肪酶催化合成生物柴油 [J].生物工程学报,2008,24(1):142-146.
[23]Zhang W J,Huang X R,Li Y Z,et al.Catalytic activity ofligin peroxidase and partition ofveratrylalcoholin AOT/isooctane/toluene/waterreversemicelles[J].Applied Microbiology and Biotechnology,2006,70(3):315-320.
[24]Kimura M,Michizoe J,Oakazaki S,et al.Activation of lignin peroxidase in organic media by reversed micelles[J].Biotechnology and bioengineering,2004,88(4):495-501.
[25]韩增辉.表面活性剂构建体系中漆酶对木素模式化合物的催化降解 [D].长沙:湖南大学,2012.
