楚雄核桃内生真菌分离及抗菌活性研究*
2013-01-14王建文陈华红段亚霞杨彝华
王建文,陈华红*,段亚霞,杨彝华
(1.楚雄师范学院化学与生命科学系,云南 楚雄 675000;2.楚雄州林业科学研究所,云南 楚雄 675000)
核桃 (Juglans regia L.)是核桃属植物中分布最广、经济价值最高的栽培种[1]。自古以来,核桃的保健功能就为人们所认识和推崇,《本草纲目》中也有补气养血、润燥化炎、益命门、利三焦、温肺润肠等功能的记载[2]。核桃在云南楚雄的栽培历史悠久,是主要经济作物。但是在核桃种植过程中会出现多种疾病如炭疽病、黑斑病、白粉病、枝枯病、腐烂病、黄化病、灰斑病、核桃花叶病、木腐病、种仁霉烂病和顶端坏死病等[3—7]。资料显示拟盘多毛孢 (Pestalotiopsis)和链格孢 (Alternaria)会引起核桃组织的多种病害[7]。而使用农药防治核桃病害,残留的农药会危害人类健康,由此人们迫切需要寻找更为高效、环保的防治方法。
植物内生真菌 (Plant endophytic fungi)是指那些在其生活史的一定阶段或全部阶段生活于健康植物各种组织器官内部的真菌,被感染的宿主植物 (至少是暂时)不表现出外在症状,可通过组织学方法或从严格表面消毒的植物组织中分离或从植物组织内直接扩增出微生物DNA的方法来证明其内生[8]。内生真菌长期生活在植物体内的特殊环境中,并与宿主协同进化。一方面植物体为其提供生长必需的营养和能量;另一方面,内生真菌又可通过自身的代谢产物或借助于信号传导作用对植物体产生影响[9]。
许多植物体内都存在着特殊的内生真菌,它们在植物体内作为生防菌,能有效地防治植物病害,增强植物对病原菌的抗性。近几年,人们在植物内生真菌防治植物病害方面进行了大量的研究[10]。植物内生真菌的生防机制是其分泌抗菌物质、与病菌竞争生态位和营养物质、诱导系统抗性、产生植物激素等。但其作为植物病害生防因子进行开发与应用中还存在一些问题[10]。翟梅枝等人研究表明,核桃和黑核桃的内生真菌有广泛的抗菌谱,对棉花立枯病菌、苹果炭疽病菌、梨黑星病菌、小麦赤霉病菌和油菜菌核病菌菌丝生长具有抑制作用[11]。
近年来,植物病害的生物防治研究越来越受到人们的重视。从植物内生菌寻找具有拮抗活性的生物活性物质物质,成为无公害生物性农药创制的一条途径[11]。对楚雄地区核桃内生真菌进行分离、纯化以及抗菌活性研究,可为筛选防治核桃病害的活性菌株提供优良的种质资源。
1 实验材料
1.1 实验材料
取自楚雄州楚雄市,牟定县等地不同品种的生长良好的核桃树的根、茎、叶,选取无病斑,无虫害的健康核桃组织作为实验材料.
1.2 培养基
内生菌分离培养基:TWYE培养基 (yeast extract 0.25g,KH2PO40.5 g,Taping Water 1L,agar 15g,pH自然),琥珀酸钠培养基 (sodium succinate 2g,KH2PO40.3 g,Mg-SO4.7H2O 0.1 g,CaCO31g,FeSO4.7H2O 0.01g,agar 15g,ddH2O 1L,pH7.2),苹果酸钠培养基 (苹果酸钠0.6g,MgSO4.7H2O 0.2 g,FeSO4.7H2O 0.01g,CaCO30.6g,KH2PO40.3 g,KNO30.5g,agar 15g,ddH2O 1L,pH7.2)。
分离菌株纯化、活化培养基:PDA培养基 (马铃薯200g、蔗糖20g、琼脂15~20g、PH自然、水1000ml)。
发酵培养基:大豆粉 20g,蛋白胨 2g,葡萄糖 20g,淀粉 5g,酵母膏 2g,NaCl 4g,K2HPO40.5g,MgSO4.7H2O 0.5g,CaCO32g,ddH2O 1L,pH7.8
促孢培养基:KH2PO42g,KNO31g,MgSO40.5g,淀粉0.2g,葡萄糖0.2g,蔗糖0.2g,琼脂20g,水1L,pH自然。
1.3 指示菌
拟盘多毛孢 (Pestalotiopsis spp.)、链格孢 (Alternaria spp.)、德氏孺孢 (Drechslera spp.)、灰葡萄孢 (Botrytis cinerea)和疫霉 (Phytophthora spp.)。
2 实验方法
2.1 内生菌的分离
核桃样品用自来水冲洗干净后,进行表面消毒 (程序:0.01%Tween 20浸泡1 min→70%乙醇溶液处理2 min→无菌去离子水洗4—5次→有效氯含量为5%的次氯酸钠浸泡5 min→硫代硫酸钠溶液浸泡10 min→无菌去离子水洗4—5次。)取0.5 mL最后一遍清洗植物样品的水涂布于TSA固体培养基上,28℃培养1周,检测表面消毒效果。
将表面消毒的植物组织打碎,均匀接种于分离培养基中,置于28℃恒温培养箱中培养1至3周,待长出菌丝后挑取,使用PDA培养基进行纯化,纯化的菌株使用PDA培养基培养及保存。
2.2 核桃内生真菌的鉴定
使用插片法观察真菌形态特征,即将纯化的菌株接种到促孢培养基,28℃下恒温培养4周后,显微观察菌丝形态、产孢结构特征及孢子形态,参照文献进行菌株的鉴定[12]。
2.3 核桃内生真菌的发酵
将内生真菌菌株接种于PDA平板活化后,接种于发酵培养基中,在28℃,使用摇床(120rpm/min)培养7d,发酵液用乙酸乙酯浸提48小时后,高速离心,取上清液用旋转蒸发仪蒸干,加入无菌水制成发酵样品。
2.4 指示菌的活化及培养
将拟盘多毛孢、链格孢、德氏孺孢、灰葡萄孢和疫霉5种指示菌菌株接种于PDA固体培养基上恒温培养4~6天,活化用于抑菌实验。
活化好的病原菌接种于PDA液体培养基,在28℃,摇床 (120r/min)培养至对数生长期。
2.5 抑菌实验
取200μl菌液加入PDA培养基制成含菌平板,采用滤纸片法进行抑菌实验,28℃恒温培养48h后,测量抑菌圈的直径大小,以两性霉素溶液40g/mL为阳性对照。
3 结果与讨论
共分离得到具不同形态特征的核桃内生真菌22株,其中从叶片分离得到的内生真菌数量最多,为10株,占分离菌株总数的45.5%,从根分离得到8株,占36.4%,从茎分离得到4株,占18.2%。因此,楚雄核桃的内生真菌在不同部位的分布数量为根>叶>茎,主要分布于根和叶中。
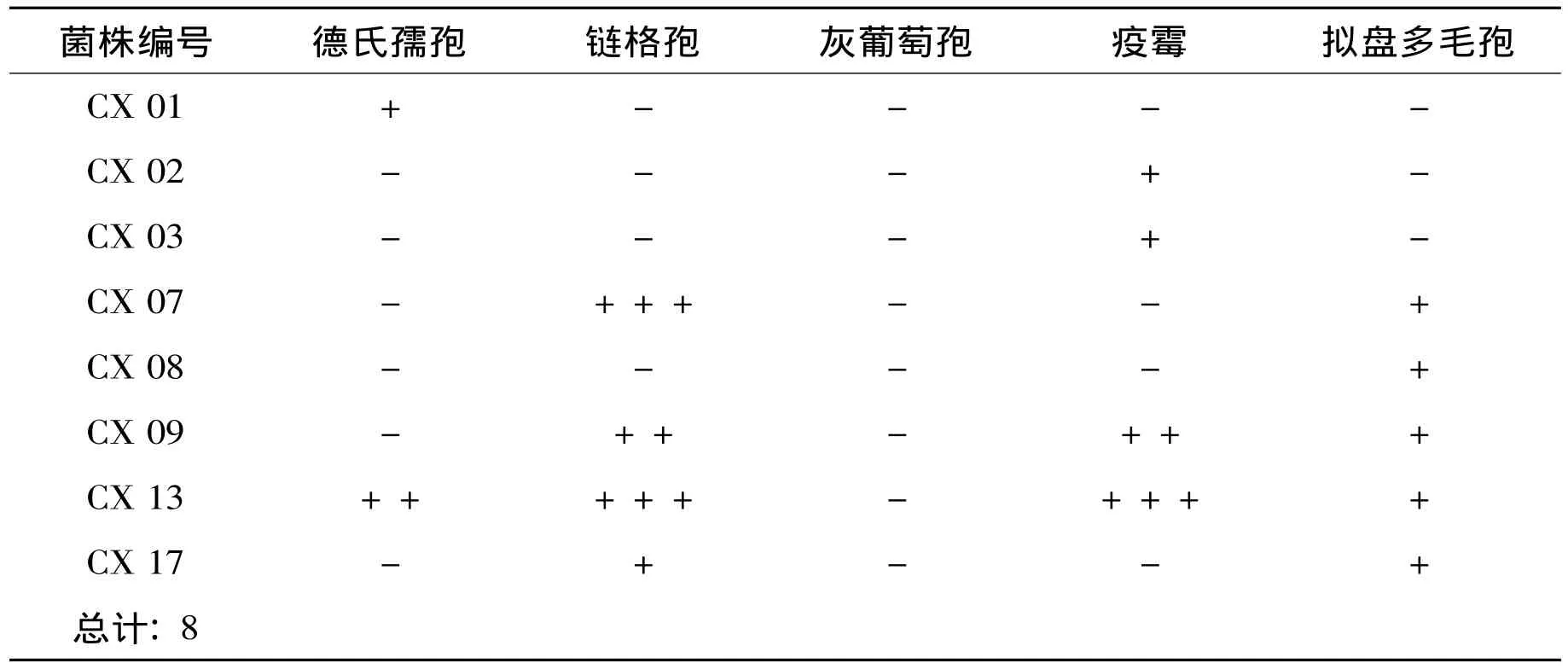
表1 核桃内生真菌中对五种指示菌的抑菌效果Table 1 Antifungus activity of endophytic fungus
22个核桃内生真菌分离菌株分属于6个属,其中瓶霉属 (Phialophora)有2株,占分离菌株总数的9.1%;明枝霉属 (Hyalodendron)有1株,占4.5%,单襄霉属 ()有1株,占 4.5%;青霉属 (Penicillium)有 10株,占总量的 45.5%;拟青霉属(Paecilomyces)有2株,占总量的9.4%;镰孢属 (Fusarium)有6株,占总量的27.3%。由此可知22株核桃内生真菌中青霉属菌株占优势,其次是镰孢属,明枝霉属和单襄霉属最少。从根分离得到的8个菌株分属瓶霉属,明枝霉属,单襄霉属和镰孢属4个属,从茎分离得到的有拟青霉属和镰孢属的菌株,从叶中分离得到的10个菌株则属于单襄霉属和青霉属。因此虽然从叶中分离得到的菌株数量最多,但种群组成相对较为单一,从核桃根分离得到的内生真菌较为多样。根据李晓红等的研究,核桃内生真菌菌株分布于镰孢属、链格孢属、壳满孢属 (Plenodomus)、葡萄孢属 (Botrytideae)、大茎点霉属(Phomopsis)和炭疽菌属 (Colletotrichum)六个属[13],本研究分离得到的内生真菌虽然也分布于6个属,但仅有镰孢属与之相同;高智辉等分离得到的核桃内生真菌分布于半知菌亚门的21个属[14],与本研究分离结果差异较大。这可能是由于环境因子 (土壤、温度、水分等)对植物内生菌的种群组成影响较大,各个研究所采集的核桃样品产地不同,以及实验所采用的分离方法不同有关。
22株核桃内生真菌菌株中有8株有抑菌活性,约占分离菌株数的36.4%。8株有抑菌活性的真菌分属于镰孢属 (3株)、瓶霉属 (2株)、青霉属 (2株)和明枝霉属 (1株)。由表1可知,对4种供试菌株有抑菌作用的有1株,占总量的4.5%;对3种病原菌有抑菌作用的有1株,占总量的4.5%;对两种供试菌株有抑菌作用的有2株,占抑菌菌株总量的9%;菌株对一种供试菌株有抑菌作用的有4株,占总量的18.2%。菌株CX13,对链格孢和疫霉菌株均有很强抑制活性,对德氏孺孢和拟盘多毛孢也有一定抑制作用。菌株CX07对链格孢菌株有很强抑制活性。
德氏孺孢 (Drechslera spp.)能引起许多植物病害如离孺孢叶枯病、弯孢霉叶枯病、德氏霉叶枯病、叶斑病等[15]。8株具抑菌活性的真菌菌株中,对德氏儒孢有抑菌作用的有2株,其中分离自核桃叶的CX13对德氏孺孢的生长具有较好的抑制作用。
链格孢属 (Alternaria spp.)真菌为世界性分布,主要引起核桃的顶端坏死病、褐斑病和黑斑病等[16],是核桃主要的病原菌。针对这些病害采取了多种防治方法,从核桃内生组织中分离出的CX07,CX09,CX13,和CX17菌株对链格孢的生长均具有抑制作用,其中,分离菌株CX07和CX13的抑菌活性较强,可进一步研究,应用于链格孢属菌株引起的植物病害的生物防治。
疫霉属 (Phytophthora spp.)大多寄生,诱发许多植物病害,但该病菌生理分化明显、遗传变异迅速,现有措施难以完全有效控制该病。致病疫霉主要引起马铃薯和番茄的晚疫病;马铃薯腐烂病、柑橘腐烂病;大豆根腐病等病症[17—18]。CX02,CX03,CX09和CX13菌株均可抑制疫霉的生长,其中,CX13的抑菌效果较为明显,可作为研发安全高效的微生物农药的菌种资源。
拟盘多毛孢 (Pestalotiopsis spp.)长期以来一直被当作植物病原真菌来研究,如枯斑拟盘多毛孢是松树的病原菌;污斑拟盘多毛孢在一些地方的山茶植物上是寄生性病原真菌[19]。拟盘多毛孢属在大理州对核桃的叶、花、枝和果产生严重危害,影响核桃生长和产量[4]。对拟盘多毛孢引起的植物病害的防治仍采用传统的防治方法,5个分离菌株CX7,CX8,CX9,CX13和CX17均对拟盘多毛孢菌株有一定抑制作用,这可为利用核桃内生真菌来防治核桃病害提供丰富的菌种资源。
但所有测试菌株都对能引起蔬菜、瓜果、花卉等作物的灰霉病、腐烂病和霉烂病的灰葡萄孢菌 (Botrytis cinerea)无抑制活性。
结果表明青霉属的cx13对四种供试菌具有明显的抑菌效果,镰孢属的cx09号菌株对三种供试菌有一定的抑菌作用。8株具抑菌作用的核桃内生真菌中有四株 (青霉属2株、镰孢属2株)对链格孢有抑菌作用,且抑菌效果较明显。
本研究表明,植物内生真菌对多种引起植物病害的常见植物病原菌具有抑制作用,可为安全高效的生物农药和菌肥的开发提供丰富的微生物资源,在植物病害的生物防治方面具有广阔的应用前景。
[1]翟梅枝,高智辉,徐文涛,等.核桃内生真菌G8菌株的分离鉴定及抑菌活性[J].中南林业科技大学学报,2008,28(04):92—97.
[2]刘玲,陈朝银.核桃功能研究进展[J].安徽农业科技,2009,37(27):13227—13228,13240.
[3]申红妙.核桃主要病害极其防治[J].河北林业,2010,(06):37—37.
[4]马建鹏,涂国信,孔暄,等.核桃病害病原菌Pestalotiopsis sp.的防治研究[J].林业调查规划,2010,35(06):94—95.
[5]黄吉林.核桃常见病害防治[J].中国林业,2006,(08)A:43—43
[6]雍付恩,陈京元,刘文爱,等.核桃虫害研究进展[J].湖北林业科技,2008,(150):33—38.
[7]曲文文,刘霞,杨克强,等.山东省危害核桃的链格孢属真菌鉴定及其系统发育[J].植物保护学报,2012,2(39):121—127.
[8]杨春平,陈华保,吴文君,等.植物内生真菌次生代谢产物的多样性及潜在应用价值[J].西北农业学报,2005,14(02):126—132.
[9]王伟,翟梅枝,徐文涛,等.核桃内生菌的分离及代谢产物活性研究[J].西北农业学报,2008,17(01):77—81.
[10]杨玉锋,李保利.植物内生真菌在植物病害生物防治中的作用[J].河南农业科学,2011,40(03):25—28.
[11]翟梅枝,问小强,刘枫等.核桃属植物内生真菌的分离及其抑菌活性研究[J].西北林学院学报,2009,24(03):144—147.
[12](美)巴尼特,H.L.,亨特B.半知菌属图解 (第三版)[M].沈崇尧译.北:科学出版社,1977:54—211.
[13]李晓红,傅本重,麻春花,等.不同表面消毒方法对核桃叶内生菌分离效果的比较[J].中国农学通报,2012,28(28):163—168
[14]高智辉,翟梅枝,王云果,等.核桃内生真菌的分离鉴定[J].西北林学院学报,2012,27(05):121—123.
[15]张成霞,南志标,李春杰,等.杀菌剂拌种防治草坪草病害的研究进展[J].草业学报,2005,14(06):14—22.
[16]曲文文,刘霞,杨克强,等.山东省危害核桃的链格孢属真菌鉴定及其系统发育[J].植物保护学报,2012,2(39):121—127.
[17]毕朝位,黎艳平,罗国全,等.致病疫霉 (Phytophthora infestans)的分离与培养方法[J].植物保护学,2005,10(21):306—308.
[18]蒋继志,郭俊亭,李丽艳,等.致病疫霉拮抗真菌研究进展[J].河北大学学报(自然科学版),2012,(01):110—117.
[19]韦继光,徐同.植物拟盘多毛孢的生物多样性[J].生物多样性,2003,11(02):162—168.
