C57BL/6J胚鼠听皮层神经干细胞分离培养的研究*
2013-01-10孟德静陈继川任红苗
孟德静 陈继川 任红苗
神经干细胞(neural stem cells,NSCs)是具有自我更新增殖能力的细胞,可以分化为神经元、星形细胞、胶质细胞。Villa等[1]研究发现神经干细胞高表达端粒末端转移酶,能保持稳定的细胞周期长度、有丝分裂潜能、分化和神经元形成能力,所以神经干细胞成为神经系统疾病细胞治疗的良好的种子细胞。目前神经干细胞移植在治疗脑中风、帕金森病、脑创伤[2~4]等疾病方面取得了一定的进展,成为研究热点。本研究采用不同方法培养神经干细胞,为神经干细胞的临床应用奠定基础。
1 材料与方法
1.1实验动物与试剂 孕14 d C57BL/6J小鼠购于第三军医大学大坪医院野战外科研究所动物中心;Neurobasal培养基、0.25%胰蛋白酶、胎牛血清(FBS)、青霉素-链霉素双抗、碱性成纤维生长因子(bFGF)、表皮生长因子(EGF)、胰岛素、B27均购于Gibco公司;多聚赖氨酸(Poly-L-lylin)、巢蛋白多克隆抗体(Nestin PcAb)、β微管蛋白(β-tubulin Ⅲ)单克隆抗体、胶质纤维酸性蛋白(GFAP)多克隆抗体购于Sigma公司;CCK-8(cell counting kit-8)试剂盒购于碧云天生物技术研究所;免疫荧光二抗购于北京中杉金桥生物技术有限公司。
1.2实验方法 将12只孕14 d C57BL/6J小鼠随机分为酶消化组和机械吹打组,每组6只,将孕14 d的孕鼠颈椎脱臼处死,放入75%酒精中浸泡5 min,无菌条件下取出胚鼠,解剖显微镜下分离胚鼠听皮层脑组织并剥离脑膜,分别用酶消化法(酶消化组)和机械吹打法(机械吹打组)进行原代培养。
1.2.1酶消化法胚鼠NSCs原代培养 将剥离脑膜后的胚鼠脑组织放入小瓶中,并用无菌剪刀将脑组织剪成1 mm×1 mm×1 mm的组织块,瓶中加入5~10倍0.25%胰蛋白酶37 ℃孵箱中消化10 min。随后5%胎牛血清终止消化,培养基洗两遍后,剪刀进一步剪碎组织,加入培养基轻轻吹打直至培养基变浑浊见不到组织块为止。用200目细胞筛过滤后移入离心管中800 r/min离心5 min,弃去上清,用无血清条件培养基(Neurobasal培养基、2% B27、EGF 20 ng/ml、bFGF 20 ng/ml、insulin 100 μg/ml)重悬细胞,细胞计数,以2×105个/ml的密度接种于直径6 cm培养皿中,于37 ℃、5% CO2、95%湿度培养箱中培养,隔天半量换液一次。
1.2.2机械吹打法胚鼠NSCs原代培养 将剥离脑膜后的听皮层脑组织放入离心管中,用无菌剪刀将脑组织剪碎,然后加入培养基轻轻吹打直至变浑浊见不到组织块为止。用200目细胞筛过滤后移入离心管中800 r/min离心5 min,用条件培养基(Neurobasal培养基、2% B27、EGF 20 ng/ml、bFGF 20 ng/ml、insulin 100 μg/ml)重悬细胞,并进行细胞计数,然后以2×105个/ml的细胞密度接种于直径6 cm培养皿中,于37 ℃、5% CO2、95%湿度培养箱中培养,隔天换液一次。
1.2.3小鼠NSCs巢蛋白免疫荧光鉴定 用传到第三代的细胞行Nestin蛋白鉴定。将培养的神经干细胞离心重悬吸取少许滴在经多聚赖氨酸包被的盖玻片上,细胞培养箱中培养4~6 h,待贴壁后PBS洗3次,4%多聚甲醛固定30 min,PBS洗3次,每次5 min;0.3% TritonX-100 30 min,PBS洗3次,每次5 min;正常山羊血清封闭30 min;弃去血清勿洗,滴加兔来源Nestin一抗(1:800),4 ℃孵育过夜,PBS洗3次,每次5 min;滴加TRITC标记的山羊抗兔IgG(1:100),37 ℃孵育1 h,PBS洗3次,每次5 min;DAPI( 4'-6-Diamidino-2-phenylindole dihydrochloride,4',6-二脒基-苯基吲哚;Sigma公司)染核后甘油封片,激光共聚焦显微镜(LeicaTCS SP2,德国)观察照相。同时做阴性对照试验(只加二抗,不加一抗)。
1.2.4小鼠NSCs分化能力鉴定 培养的神经干细胞离心后,用Neurobasal培养基重悬,在放入多聚赖氨酸包被的盖玻片的六孔板中培养并加入10%胎牛血清,诱导分化培养7天。取出盖玻片PBS洗3次,每次5 min;4%多聚甲醛固定30 min,PBS洗3次,每次5 min;0.3% TritionX-100 30 min,PBS洗3次,每次5 min;正常山羊血清封闭37 ℃ 30 min;弃去血清,分别滴加兔来源GFAP一抗(1:400)和小鼠来源β-tubulin Ⅲ一抗(1:800),4 ℃孵育过夜,PBS洗3次,每次5 min;滴加TRITC和FITC标记的山羊抗兔和山羊抗小鼠二抗(1:100),37 ℃孵育1 h,PBS洗3次,每次5 min;DAPI(4'-6-Diamidino-2-phenylindole dihydrochloride,4',6-二脒基-苯基吲哚;Sigma公司)染核后甘油封片,激光共聚焦显微镜(LeicaTCS SP2,德国)下观察照相,同时做阴性对照(只加二抗,不加一抗)。
1.2.5CCK-8检测两种方法培养的NSCs细胞增殖 将酶消化法和机械吹打法培养的NSCs分别以2×105个/ml的密度接种于96孔板中,每孔100 μl,各设6个复孔。分别在0、24、48、72 h每孔加入10 μl的CCK-8工作液,37 ℃中避光孵育4 h后,检测450 nm处的吸光度值(A450)。
2 结果
2.1酶消化法和机械吹打法分离的神经干细胞的生长状况 酶消化法分离下来的神经干细胞单个分散存在,呈圆形,折光性强,并且杂质比较少(图1e)。机械吹打神经干细胞杂质比较多(图1a)。酶消化法原代培养的单个神经干细胞计数为(1.57±0.05)×105个/ml,机械吹打法分离的细胞计数为(1.07±0.04)×105个/ml,酶消化法分离下来的细胞比机械吹打法分离的神经干细胞多,差异有统计学意义(P<0.05)(表1)。
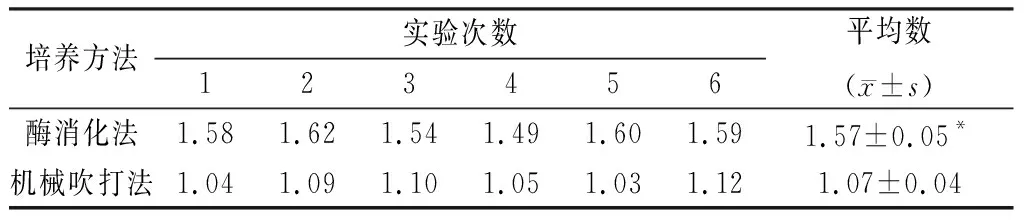
表1 酶消化法和机械吹打法分离的神经干细胞原代培养计数(×105 个/ml,n=6)
注:*与机械吹打法比较,P<0.05
接种第二天,酶消化组神经干细胞悬浮生长并克隆生长成球,形状规则呈桑葚样(图1f);机械吹打组没有形成规则的神经干细胞球,而是聚集成片(图1b),可能由于杂质太多,影响神经干细胞克隆成规则的神经干细胞球。
接种第三天,酶消化组神经干细胞球继续克隆生长,体积增大,由于体积过大,营养不够,干细胞球中央变暗坏死(图1g),要进行换液或是传代处理。机械吹打组细胞仍然没有形成规则的神经干细胞球,成云片样聚集生长(图1c)。
酶消化组传代后神经干细胞仍然克隆成球,形态规则(图1h),具有自我更新和不断增值的能力。机械吹打组传代后神经干细胞逐渐克隆形成规则的神经干细胞球(图1d),说明机械吹打原代培养杂质影响神经干细胞的生长,而酶消化法原代培养杂质很少。
2.2神经干细胞巢蛋白(Nestin)鉴定 两组细胞 免疫荧光显示细胞球巢蛋白(Nestin)染色均为阳性(图2),说明两组培养的细胞均为神经干细胞,两种培养方法均可行。
2.3神经干细胞诱导分化能力鉴定 两种方法培养的神经干细胞在有血清和无生长因子情况下均分化成神经元,在7天后形成比较成熟的神经元,神经元突起较少、较长(图3a~c)。神经干细胞分化形成的星形胶质细胞较多,突起较多,且粗大(图3d~g)。
2.4两种方法培养神经干细胞的增殖情况 两组细胞接种后生长良好,形成神经干细胞球,在接种后24、48、72 h测得的A450值酶消化组大于机械吹打组,差异有统计学意义(P<0.05),说明酶消化法分离培养的细胞增殖快于机械吹打法分离的细胞,机械吹打组杂质多影响细胞的增殖生长(表2)。
3 讨论
神经干细胞在无血清培养基和分裂原的情况下可以保持不断增殖的能力,去除分裂原或是加入血

表2 两种方法培养的神经干细胞不同时间点的
注:*与机械吹打法比较,P<0.05
清都可导致神经干细胞分化为神经元、星形胶质和少突胶质细胞[5]。碱性成纤维生长因子(bFGF)和表皮生长因子(EGF)是神经干细胞增殖生长必不可少的生长因子[6],除去碱性成纤维生长因子的细胞将在二十四小时内分化。培养神经干细胞时加入bFGF和EGF或是灭活的血清可以使巢蛋白表达阳性的细胞从44.1%上升到62.5%[7]。本研究采用无血清培养的方法并分别加入20 ng/ml的bFGF和EGF,神经干细胞生长良好,增殖成神经干细胞球,呈桑葚状,折光性强;用加入胎牛血清的无生长因子培养基诱导其分化,一周后分化为成熟的神经元和星形胶质细胞。有研究显示接种细胞的密度对细胞的生长也有影响,细胞密度过低会导致细胞生长缓慢,而密度过高对细胞的生长有抑制作用[8],以密度2×(104~105)个/ml接种的细胞生长状态良好[9]。故本实验以2×105个/ml的密度接种,结果显示细胞生长良好。
巢蛋白(Nestin)最初形成于胚鼠的中枢神经系统,最早在胚鼠的神经干细胞中发现[10]。随着神经干细胞的分化其表达量下降,最终表达终止。很多研究显示神经干细胞都表达Nestin,可用其作为神经干细胞的标志,用于神经干细胞的鉴定[11]。β微管蛋白在神经元中表达,在非神经元和胶质细胞中不表达,近来用于神经元的鉴定。星形胶质细胞胞体比较大,神经干细胞可以分化为数量比较多的神经胶质细胞,很多研究者应用胶质纤维酸性蛋白(GFAP)作为星形胶质细胞的特异性标志蛋白[12]。本研究用传代培养后的第三代细胞进行荧光鉴定,显示Nestin表达阳性,说明培养的神经干细胞比较纯,两种培养方法均可行,并且可以诱导分化为神经元和星形胶质细胞,培养的神经干细胞具有诱导多向分化能力。
神经干细胞的培养是目前很多疾病细胞治疗研究的基础,Lendahl等[10]成功地从孕13.5 d的胚鼠海马脑组织中分离出神经干细胞,为其后的研究奠定了基础。Anna Erlandsson等[13]用孕15 d的小鼠脑组织机械研磨,沉淀10分钟,然后离心后重悬细胞,进行神经干细胞培养。本研究显示机械研磨培养的神经干细胞含有的杂质多,生长速度受到杂质的影响,并且克隆增殖形成的神经干细胞球不规则,要经过多次传代才能培养出生长快速并且形态
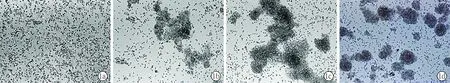

图1原代和传代后神经干细胞(×100) a~c:机械吹打法培养细胞(培养即刻、1天、2天);d:机械吹打法传代细胞培养1天 ;e~g:酶消化法培养细胞(培养即刻、1天、2天);h:酶消化法传代细胞培养1天
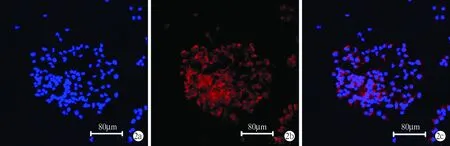
图2酶消化组神经干细胞鉴定a:DAPI标记细胞核;b:神经干细胞的Nestin抗体表达阳性(红色) ;c:a与b的合成图
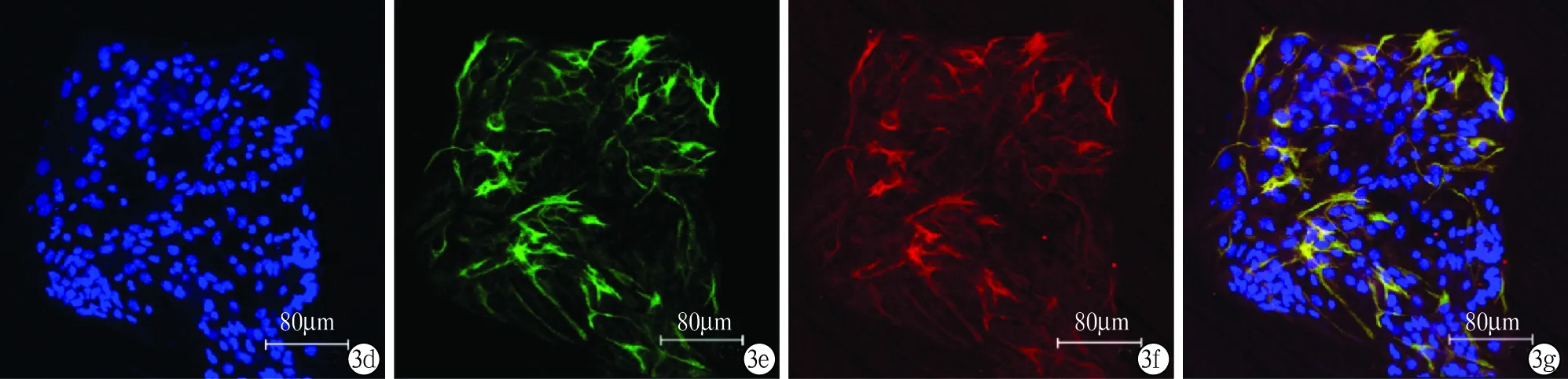
图3神经干细胞分化能力鉴定a:DAPI标记细胞核;b:神经元β-tubulin Ⅲ表达阳性(绿色);c:a与b的合成图;d:DAPI标记细胞核;e、f:星形胶质细胞GFAP表达阳性(绿色、红色);g:d与e、f的合成图
规则的神经干细胞。而酶消化法获得的神经干细胞杂质少,细胞生长快,且规则,所需的传代次数少就可以获得比较纯的神经干细胞,比机械吹打法更迅速,方法更简捷。由于机械吹打原代培养很难把组织块吹散,用力过大会影响细胞的活性,并且杂质很难去除,只有经过多次传代才能克服这些缺点,比较费时。本研究利用CCK-8检测两种方法原代培养的细胞的增殖情况,结果显示在培养后24、48、72 h酶消化组细胞增殖比机械吹打组快,差异有统计学意义(P<0.05),说明机械吹打法培养的细胞杂质较多,对细胞的增殖可产生不良的影响。
综上所述,用酶消化法和机械吹打法均能分离培养出具有自我增殖和诱导多向分化能力的神经干细胞,但与机械吹打法相比,酶消化法传代次数少就可以获得比较纯的神经干细胞,形成的神经干细胞比较规则,省时便捷。
4 参考文献
1 Villa A,Bueno C,Frcuso S,et al.Long-term molecular and cellular stability of human neural stem cell lines[J]. Experimental Cell Research, 2004,294: 559.
2 Chen B,Yan AH,Zhang K,et al.Neuroprotective effect of grafting GDNF gene-modified neural stem cells on cerebral ischemia in rats[J]. Brain Research, 2009,1 284: 1.
3 Kim SJ,Chu K,Lee ST, et al.Anti-inflammatory mechanism of intravascular neural stem cell transplantation in haemorrhagic stroke[J]. Brain, 2008,131:616.
4 Lin YT, Chern Y, Shen CKJ,et al. Human mesenchymal stem cells prolong survival and ameliorate motor deficit through trophic support in hunting's disease mouse models[J]. PLoS ONE,2011,6:e22 924.
5 Gage FH.Mammalian neural stem cells[J]. Science, 2000, 287:1 433.
6 Temple S,Qian X. Vertebrate neural progenitor cells: Subtypes and regulation[J]. Curr Opin Neurobiol,1996,6:11.
7 Tsymbaliuk VI.Human nerve stem cells in vitro[J].Tsitol Genet,2012,46:71.
8 谭新杰,胡长林,蔡文琴.新生大鼠海马神经干细胞的分离、培养、分化和鉴定[J].国际脑血管病杂志,2006,14:107.
9 田志红,黄国伟,姬长珍.胚鼠神经干细胞分离培养和鉴定[J].天津医科大学学报,2007,1:476.
10 Lendahl U, Zimmerman LB, McKay RD.CNS stem cells express a new class of intermediate filament protein[J].Cell,1990,60:585.
11 Cai J, Wu Y, Mirua T, et al.Properties of a fetal multipotent neural stem cell (NEP cell)[J]. Dev Biol, 2002, 251:221.
12 Goh EL, Ma D, Ming GL, et al.Adult neural stem cells and repair of the adult central nervous system[J]. Hematother Stem Cell Res, 2003,12:671.
13 Erlandsson A.Immature neurons from CNS stem cells proliferate in response to platelet-derived growth factor[J]. The Journal of Neuroscience,2001,21:3 483.
