东方山羊豆Go MIPS双元表达载体的构建及鉴定*
2013-01-07李春艳刘建宁高洪文
李春艳,刘建宁,高洪文
(1.山西省农业科学院 畜牧兽医研究所,山西 太原030032;2.中国农业科学院 北京畜牧兽医研究所,北京100193)
肌醇-1-磷酸合成酶(MIPS)调控着细胞内肌醇的含量,肌醇作为一种重要的渗透保护物质不仅是植物细胞中磷元素的主要贮存形式,而且在信号转导、保护植物免受外部逆境伤害、激素贮存与运输、细胞壁生物合成等方面都起到十分重要的作用[1]。Munnikt等[2]在1998年的研究中表明肌醇是植物第二信使分子IP3(1,4,5-三磷酸肌醇)的前体物质,IP3通过与位于液泡膜和粗糙内质网上的Ca2+通道结合,使Ca2+激活钙调蛋白,形成Ca2+/Ca M 复合物,该复合物通过激活一系列下游蛋白,从而调控生理代谢及基因表达,并由此引发与抗胁迫相关的一系列级联反应。对MIPS蛋白表达的调控将会影响到肌醇及其复合产物的表达调控。本研究对东方山羊豆Go MIPS基因cDNA全长编码区进行了分子克隆,构建了东方山羊豆(Galega.orientalis L.)Go MIPS基因pCAMBIA1302双元表达载体(含有绿色荧光蛋白GFP),为研究Go MIPS基因亚细胞定位及利用转基因技术对Go MIPS基因编码蛋白的生物学功能的研究奠定基础。
1 材料与方法
1.1 载体和菌株
大肠杆菌感受态DH5α购自天根生化科技有限公司,p MD19-Tvector购自Ta KaRa公司,pCAMBIA1302载体由中国农业科学院北京畜牧兽医研究所友情馈赠。
1.2 酶及试剂
限制性内切酶、TaqDNA聚合酶、T4DNA连接酶和DNaseI酶及DNA纯化回收试剂盒均购自Ta KaRa公司,cDNA Synthesis Kit为Promega公司产品,Trizol和引物均购自Invitrogen公司,其他试剂均为国产分析纯。
1.3 方 法
1.3.1 引物设计 根据已克隆出的东方山羊豆Go MIPS基因序列,应用Primer Premier5.0设计一对在目的基因两侧带有NcoI/SpeI酶切位点的引物P1和P2,上游引物是加有NcoI酶切位点(CCATGG),下游引物是去掉终止子TGA后加有SpeI酶切位点(ACTAGT)的引物。

1.3.2 RNA的提取 取培养的东方山羊豆的幼嫩叶片,采用Trizol法提取制备总RNA,提取后采用DNase I去除痕量DNA,方法依照说明书进行。
1.3.3 RT-PCR扩增Go MIPS基因 将所提取的组织总RNA按照cDNA Synthesis Kit使用说明书进行RT(反转录)反应合成cDNA第一链,再以c DNA第一链为模板进行PCR扩增,取5μL PCR产物进行1%的琼脂糖凝胶电泳。
PCR循环反应条件是:98℃预变性5 min,98℃变性10 s,55℃退火5 s,72℃延伸90 s,30个循环,最后72℃延伸5 min。
1.3.4 PCR产物的克隆、鉴定和测序 回收的PCR产物与p MD19-Tvector连接、转化,挑选阳性克隆摇菌过夜,然后进行菌液PCR鉴定,选正确的阳性菌落植菌,提取质粒p MD-MIPS,送Invitrogen公司测序鉴定。
1.3.5 表达载体构建 将中间载体p MD-MIPS和p CAMBIA1302空载体进行NcoI/SpeI双酶切,37℃16 h,经凝胶电泳检测,利用凝胶电泳DNA回收试剂盒分别回收目的片段。在T4连接酶的作用下,将回收的目的片段连接,连接体系为10μL,37℃过夜培养,挑选阳性菌落植菌,提取阳性克隆质粒pCAMBIA1302-MIPS。
1.3.6 双酶切鉴定 对p CAMBIA1302-MIPS质粒进行NcoI/SpeI双酶切鉴定,取10μL进行1%琼脂糖凝胶电泳。
1.3.7 序列测定与分析 将重组载体pCAMBIA1302-MIPS送Invitrogen公司测序,以p CAM-BIA1302载体通用引物双向序列测定,测定结果通过GenBank检索分析,并验证其阅读框架。
2 结果与分析
2.1 总RNA质量检测
总RNA的凝胶电泳结果见图1。从图1可以看出,在凝胶上显示出两条清晰的条带,分别是28 s和18 s,结果表明试验所提取的总RNA较完整。经核酸/蛋白质浓度测定仪测定,所提取的总RNA的OD260/OD280比值在1.8~2.0之间,表明总RNA纯度较高。
2.2 Go MIPS基因RT-PCR扩增
取5μL Go MIPS基因的RT-PCR扩增产物,经1%的琼脂糖凝胶电泳检测,显示RT-PCR产物约1 500 bp左右的特异性扩增片段(图2),与预期结果相符。
2.3 Go MIPS重组表达载体的构建
东方山羊豆Go MIPS基因重组表达载体的构建见图3所示。

图1 总RNA的凝胶电泳M.DNA Marker DL 2 000;1.总 RNAFig.1 Eectrophoresis of total RNAM.DNA Marker DL 2 000;1.Total RNA

图2 RT-PCR扩增产物的电泳图M.DNA Marker DL 2 000;1.RT-PCR产物Fig.2 Gel ectrophoresis of RT-PCR productM.DNA Marker DL 2 000;1.RT-PCR Product
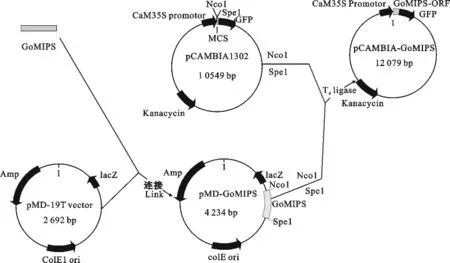
图3 重组表达载体构建示意图Fig.3 Procedure of construction of the recombinant expression vector
2.4 双酶切鉴定
提取p MD-MIPS质粒,用NcoI/SpeI双酶切,琼脂糖凝胶电泳得到了一条1 500 bp左右的条带,与目的片段的大小相符,提取pCAMBIA1302-MIPS质粒,同样用NcoI/SpeI双酶切,也在约1 500 bp处获得了一条特异性条带,与预期大小相符(图4),测序后也无碱基突变,表明p CAMBIA1302-MIPS增强型表达载体构建成功。
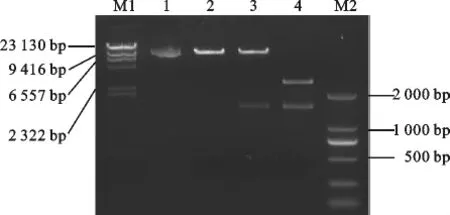
图4 重组质粒pCAMBIA1302-MIPS和pCAMBIA1302空质粒、pCAMBIA1302-MIPS质粒及p MD-MIPS质粒双酶切验证电泳图谱M1.λ-Hind III digest;1.pCAMBIA1302-MIPS质粒;2.pCAMBIA1302质粒酶切;3.pCAMBIA1302-MIPS质粒双酶切;4.p MD-MIPS质粒双酶切;M2.DNA Marker DL 2 000Fig.4 Agarose gel electrophotesis analysis of reconstructed plasmidp CAMBIA1302-MIPS and the double enzymes digesting indentification of pCAMBIA1302 plasmid、pCAMBIA1302-MIPS plasmid and p MD-MIPS plasmid.M1.λ-Hind III digest;1.pCAMBIA1302-MIPS plasmid;2.the enzymes digesting indentification of pCAMBIA1302 plasmid;3.the enzymes digesting indentification of pCAMBIA1302-MIPS plasmid;4.the enzymes digesting indentification of p MD-MIPS plasmid;M2.DNA Marker DL 2 000
2.5 序列测定及分析
测定结果显示p CAMBIA1302-MIPS重组载体中插入序列具有完整的东方山羊豆Go MIPS基因开放阅读框去掉终止密码子TGA的序列。在NCBI的Genbank数据库中进行序列检索分析,并通过NCBI的Blast比对分析,表明本试验利用已经克隆的东方山羊豆Go MIPS基因序列成功的构建了该基因的增强型表达载体p CAMBIA1302-MIPS。
3 讨 论
肌醇-1-磷酸合成酶是肌醇代谢中的关键酶,也是唯一的催化6磷酸葡萄糖合成肌醇-1-磷酸的一种酶[3],它做为一种可溶性酶已在多种单细胞和多细胞真核生物中被发现[4],因此,人们普遍认为该酶主要是限于细胞质中。而Lackey KH等[5]在2003年的研究表明肌醇-1-磷酸合成酶在膜结合细胞器上也存在,并应用微生物和生化分析手段检测到该酶在豆科植物的质膜,质体,线粒体,内质网,细胞核和细胞壁中均表达。
Donahue等[6]通过对拟南芥mips1-gfp融合表达的转基因植物、野生型和缺失型突变体的研究,表明植物含有多个mips基因,它编码高度相似的酶。但它们的表达模式各不相同,mips1大多数在细胞发育阶段中表达,而mips2和mips3主要局限在血管及其相关组织中,且mips1在种子发育,对盐和脱落酸的生理反应及抑制细胞死亡中均表现出重要作用,而mips2或mips3则没有。在对丧失功能的突变体在不同生态型拟南芥mips1基因的研究中发现,所有的空mips1突变体有缺陷的胚胎发育,其叶脉图案,根系生长,根帽的发展均受到抑制,且由上往下运输的生长素也大大减少[7]。由此可见mips1对维持肌醇含量,保持抗坏血酸,磷脂,和神经酰胺水平及调节生长,发育和细胞死亡等方面均具有重大影响[6]。
研究发现,肌醇-1-磷酸合酶基因在一些植物基因组中是以基因家族的形式出现[6,8-9]。本试验前期的研究表明,以东方山羊豆幼嫩叶片为材料,在克隆MIPS基因的时候有同源性较高的序列出现,经过序列比对我们选取了一条序列进行了构建载体等后续的研究。这说明,克隆的东方山羊豆肌醇-1-磷酸合酶基因可能也存在一个基因家族。
选择有效的表达系统是进行外源基因高效表达的重要前提。pCAMBIA1302是一种含有绿色荧光蛋白GFP可以高效表达和纯化外源蛋白的载体,被广泛应用于重组蛋白的表达和纯化。本次试验是在前期已经从东方山羊豆中克隆得到了MIPS基因上进行的,构建了含有起始密码子ATG和绿色荧光蛋白GFP的增强型双元表达载体p CAMBIA1302-MIPS,这一结果为今后进一步进行亚细胞定位和构建转基因植物及对该基因编码的蛋白进行功能验证创造了必要的条件。
[1] Toker A.The synthesis and cellular roles of phosphatidylinositol 4,5-bisphosphate[J].Curr Opin Cell Biol,1998,10(2):254-261.
[2] Munnikt,Irvine R F,Musgrave A.Phospholipid signaling in plants[J].Biochimica et Biophysica Acta,1998,1389(3):222-272.
[3] Majumder A L,Johnson M D,Henry S A.1L-myo-inositol-1-phosphate synthase[J].Biochimica et Biophysica Acta,1997,1348(1-2):245-256.
[4] Bachhawat N,Mande S C.Complex evolution of the inositol-1-phosphate synthase gene among archaea and eubacteria[J].Trends Genet,2000,16(3):111-113.
[5] Lackey K H,Pope P M,Johnson M D.Expression of 1L-myo inositol-1-phosphate synthase in organelles[J].Plant Physiol,2003,132(4):2 240-2 247.
[6] Donahue J L,Alford S R,Torabinejad J,et al.The Arabidopsis thaliana Myo-inositol 1-phosphate synthase1 gene is required for Myo-inositol synthesis and suppression of cell death[J].Plant Cell,2010,22(3):888-903.
[7] Hao Chen,Liming Xiong.Myo-inositol-1-phosphate synthase is required for polar auxin transport and organ development[J].Biol Chem,2010,285(31):24 238-24 247.
[8] Johnson M D,Sussex I M.1L-myo-inositol 1-phosphate synthase from Arabidopsis thaliana[J].Plant Physiol,1995,107(2):613-619.
[9] Abreu E F M,Aragao F J L.Isolation and characterization of a myo-inositol-1-phosphate synthase gene from yellow passion fruit(Passiflora edulis f.flavicarpa)expressed during seed development and environmental stress[J].Annals of Botany,2007,99(2):285-292.
