造纸用碱性脂肪酶的固定化研究
2013-01-05赵光磊何北海陈礼辉黄六莲
刘 凯 赵光磊 何北海 陈礼辉 黄六莲
(1.福建农林大学材料工程学院,福建福州,350002;2.华南理工大学制浆造纸工程国家重点实验室,广东广州,510640)
对于以木材为主要原料的制浆造纸厂,特别对我国南方以马尾松为主要原料生产新闻纸的纸厂来说,树脂障碍问题一直是生产中的一大难题。在制浆造纸过程中,树脂以多种形式沉积在制浆造纸设备表面,并产生一系列的树脂障碍问题,树脂障碍造成的危害主要有产品质量下降及由纸机可操作性差而引起的产量降低。另外,随着现代化纸厂用水封闭循环的日趋完善,造纸用材种类的扩展以及碱性抄纸技术的应用等因素的影响,树脂障碍问题将日益突出[1-2]。
树脂中的三油酸甘油酯(TG)是产生树脂障碍的主要有害组分之一,三油酸甘油酯是非极性组分,在白水循环回用过程中很容易通过范德华力黏附在一些憎水性设备的表面上,从而形成大量的树脂沉积物[3]。利用生物技术控制树脂障碍问题是切实可行的方法,国内外都已经开展了这方面的研究。此方法主要是利用脂肪酶将树脂中的酯类物质水解成低黏性的脂肪酸和醇类,从而达到控制树脂沉积的目的[4-5]。但在利用脂肪酶控制树脂沉积物时,由于游离脂肪酶无法回收利用,不仅造成了脂肪酶的浪费,还给工厂带来了过高的处理成本。为了实现脂肪酶的回收利用,本实验采用先进的生物酶固定化技术对脂肪酶进行固定化处理,并考察固定化脂肪酶的酶学性质,为利用固定化脂肪酶控制树脂障碍提供理论基础。
1 实验
1.1 原料及药品
碱性脂肪酶(A-2X),诺维信生物科技有限公司;1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl,以下简称 EDC),纯度 >98.5%,上海晶纯试剂有限公司;聚乙烯醇(PVA,AH-26),上海润捷化学试剂有限公司;橄榄油,化学纯,国药集团化学试剂有限公司;三油酸甘油酯(TG),化学纯,上海晶纯试剂有限公司。
1.2 实验方法
1.2.1 壳聚糖微球的制备
称取2 g壳聚糖粉末溶解在100 mL 5%的乙酸溶液中,缓慢加热至50℃,搅拌使其完全溶解,然后吸入注射器中并慢慢滴入由NaOH(浓度2 mol/L)与无水乙醇(NaOH溶液与无水乙醇体积比4∶1)组成的凝结剂中,充分搅拌使其凝固成颗粒状,浸泡3 h后,抽滤并用去离子水充分洗涤至pH值为中性。
1.2.2 单元固定化脂肪酶[6]
方法Ⅰ:称取3 g壳聚糖微球加入10 mL一定质量分数的EDC溶液,室温下置于转速为150 r/min的摇床中活化反应1 h后,用去离子水洗去残余的EDC。然后加入5 mL稀释至一定浓度的碱性脂肪酶,置于转速为150 r/min的摇床中振荡反应3 h后,用去离子水洗去残余酶液,并置于4℃的冰箱中冷藏备用。
方法Ⅱ:称取3 g壳聚糖微球加入10 mL一定质量分数的戊二醛溶液,室温下置于转速为150 r/min的摇床中交联反应1 h后,用去离子水洗去残余戊二醛。然后加入5 mL稀释至一定浓度的碱性脂肪酶,置于转速为150 r/min的摇床中振荡反应3 h后,用去离子水洗去残余酶液,并置于4℃的冰箱中冷藏备用。
1.2.3 双元固定化脂肪酶[7]
方法Ⅲ:称取3 g壳聚糖微球加入10 mL一定质量分数的EDC溶液,室温下置于转速为150 r/min的摇床中活化反应30 min后,用去离子水洗去残余EDC。然后加入5 mL稀释至一定浓度的碱性脂肪酶,置于转速为150 r/min的摇床中振荡反应1 h后,倾倒出多余酶液,加入10 mL一定质量分数的戊二醛溶液,置于转速为150 r/min的摇床中交联反应30 min。然后用去离子水洗去残余戊二醛,加入5 mL稀释至一定浓度的碱性脂肪酶,置于转速为150 r/min的摇床中振荡反应3 h后,用去离子水洗去残余酶液,并置于4℃的冰箱中冷藏备用。
方法Ⅳ:称取3 g壳聚糖微球加入10 mL一定质量分数的戊二醛溶液,室温下置于转速为150 r/min的摇床中交联反应30 min后,用去离子水洗去残余戊二醛。然后加入5 mL稀释至一定浓度的碱性脂肪酶,置于转速为150 r/min的摇床中振荡反应1 h后,倾倒出多余酶液,加入10 mL一定浓度的EDC溶液,置于转速为150 r/min的摇床中活化反应30 min。然后用去离子水洗去残余EDC,加入5 mL稀释至一定浓度的碱性脂肪酶,置于转速为150 r/min的摇床中振荡反应3 h后,用去离子水洗去残余酶液,并置于4℃的冰箱中冷藏备用。
1.2.4 脂肪酶酶活与蛋白质含量的测定
采用橄榄油乳化法[8]测定脂肪酶的酶活,在50℃、pH值7.5(对游离脂肪酶)或55℃、pH值8.5(对固定化脂肪酶)。每分钟水解橄榄油释放出1 μmol游离脂肪酸所需脂肪酶的量,定义酶活为1 U。
采用Bradford法进行蛋白质含量的测定,以牛血清白蛋白作为标准蛋白。
1.2.5 固定化脂肪酶的酶活回收率

1.2.6 pH值对固定化脂肪酶酶活与稳定性的影响
(1)对酶活的影响
分别测定游离脂肪酶与固定化脂肪酶在不同pH值缓冲液中催化分解橄榄油的酶活。反应体系:游离脂肪酶1 mL,温度50℃;固定化脂肪酶1 g,温度55℃。
(2)对酶稳定性的影响
分别将一定量的游离脂肪酶和固定化脂肪酶置于不同pH值的缓冲液中保温1 h后,分别测定游离脂肪酶(在 pH值7.5、50℃)和固定化脂肪酶(在pH值8.5、55℃)的酶活。
1.2.7 温度对固定化脂肪酶酶活与稳定性的影响
(1)温度对酶活的影响
分别测定游离脂肪酶与固定化脂肪酶在不同温度下(35~65℃)催化分解橄榄油的酶活。反应体系:游离脂肪酶1 mL,pH值7.5;固定化脂肪酶1 g,pH值8.5。
(2)温度对酶稳定性的影响
分别将一定量的游离脂肪酶和固定化脂肪酶置于pH值8.0和8.5的磷酸缓冲液中,在不同的温度下(20~60℃)保温1 h后,分别测定游离脂肪酶在pH值7.5、50℃下和固定化脂肪酶在pH值8.5、55℃下的酶活。
1.2.8 固定化脂肪酶的操作稳定性
在最优固定化条件下制备固定化脂肪酶,以橄榄油乳液为底物,在pH值 8.5、55℃下反应30 min,每次催化反应后将固定化脂肪酶从反应液中回收,用磷酸缓冲液清洗后重新加入到新的反应液中,并检测其酶活。通过考察固定化脂肪酶的相对酶活随重复使用次数的变化,确定固定化脂肪酶的操作稳定性。
1.2.9 固定化脂肪酶对TG的催化水解性能
量取25 mL TG乳液加入到25 mL pH值8.5的磷酸缓冲液中,混合均匀后再加入3.3 g固定化脂肪酶,置于55℃水浴中搅拌反应,每隔5 min取一定量样品测定TG浓度。TG浓度是利用0.05 mol/L的氢氧化钠标准液在自动电位滴定仪上滴定(至pH值10.3为终点)并计算得出的。
2 结果与讨论
2.1 EDC质量分数对固定化脂肪酶酶活的影响
碳二亚胺类化合物对生物酶的毒性非常小,还可与壳聚糖的羟基直接交联形成一种酰基过渡态中间体,从而将生物酶分子固定化到壳聚糖上。因此,碳二亚胺类化合物是一种非常适合用来固定脂肪酶的活化剂[6]。在单元固定化脂肪酶过程中,首先考察了活化剂EDC质量分数对固定化脂肪酶酶活的影响,结果如图1所示。从图1可以看出,随着活化剂EDC质量分数的提高,固定化脂肪酶的相对酶活先提高后下降,当EDC质量分数为0.5%时,固定化脂肪酶相对酶活最大。可见,随着EDC质量分数的增加,可起到加强固定化的作用,但浓度过高会导致脂肪酶失活。而根据Chiou等人[6]的研究可知,利用EDC活化壳聚糖微球固定化脂肪酶的最佳质量分数应控制在0.25%左右,这与本研究结果基本一致。
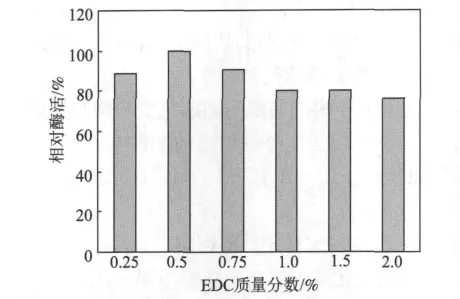
图1 EDC质量分数对固定化脂肪酶酶活的影响
2.2 戊二醛质量分数对固定化脂肪酶酶活的影响
使用戊二醛交联固定化生物酶是常用的固定化方法之一,但戊二醛的质量分数对固定化脂肪酶的酶活影响很大[9-10]。实验考察了戊二醛质量分数对固定化脂肪酶酶活的影响,结果如图2所示。由图2可以看出,随着戊二醛质量分数的提高,固定化脂肪酶酶活逐渐降低。戊二醛是一种双功能试剂,其双醛基可以与壳聚糖分子和酶分子上的氨基发生希夫(Schiff)碱反应,从而将生物酶分子固定在壳聚糖微球上,但过量的戊二醛会使酶分子之间发生交联作用,导致酶活下降[11-12]。由于各种生物酶的结构与活性都不相同,在固定化过程中受戊二醛的影响也有差异,但戊二醛质量分数较高时就会使造纸用碱性脂肪酶迅速失活。Hung等人[7]的研究结果表明,戊二醛交联固定化脂肪酶的最佳质量分数应保持在0.0025%左右。由图2可知,戊二醛交联固定化脂肪酶的最佳质量分数为 0.0025%。
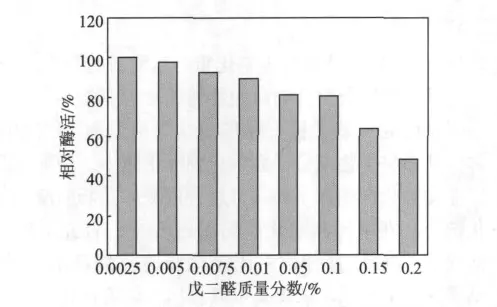
图2 戊二醛质量分数对固定化脂肪酶酶活的影响
2.3 固定化方法对固定化脂肪酶酶活的影响
为了获得最高的固定化脂肪酶酶活,本实验采用4种方法对碱性脂肪酶进行固定化处理,即分别为2种单元固定化和2种双元固定化方法,得到的固定化脂肪酶酶活如表1所示。从表1可以看出,单独使用戊二醛交联载体后进行脂肪酶的固定化,固定化脂肪酶酶活和蛋白质含量均较低,只有15.6 U/g壳聚糖和117.3 μg/g壳聚糖。同样,单独使用EDC活化载体后进行脂肪酶的固定化,固定化脂肪酶酶活和蛋白质含量也较低,仅仅只有14.2 U/g壳聚糖和81.7 μg/g壳聚糖。但采用双元固定化方法,即对载体既活化又交联后,壳聚糖载体上的蛋白质含量增加,固定化脂肪酶酶活也迅速提高。其中,使用方法Ⅲ固定化后,固定化脂肪酶酶活和蛋白质含量分别达到64.6 U/g壳聚糖和 253.7 μg/g壳聚糖,且酶活回收率也达到最大值。而使用方法Ⅳ固定化后,固定化脂肪酶酶活和蛋白质含量都比使用方法Ⅲ稍低。因此,可以确定采用方法Ⅲ进行脂肪酶的固定化最优。
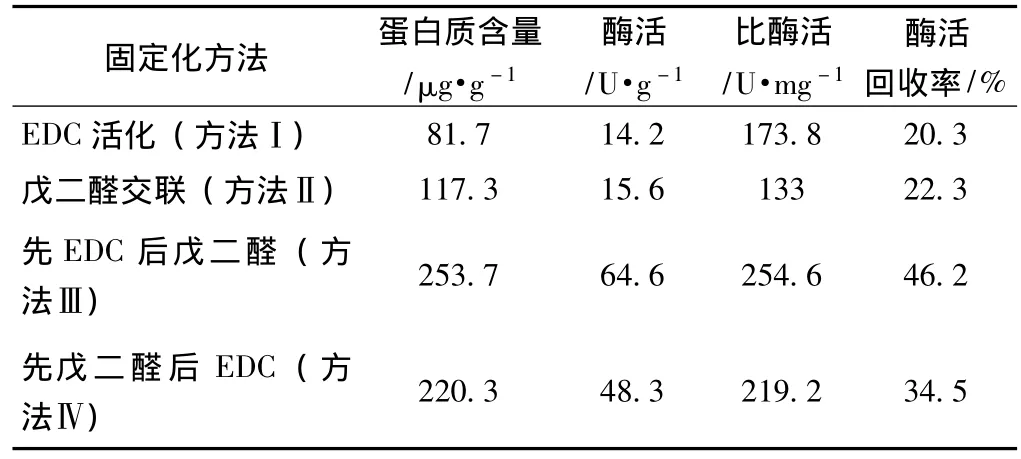
表1 不同固定化方法下的固定化脂肪酶酶活
2.4 pH值对游离和固定化脂肪酶酶活的影响
在50和55℃的反应体系中,游离和固定化脂肪酶在不同pH值缓冲液(pH值6.0~9.0)中的相对酶活如图3所示。与游离脂肪酶相比,双元固定化脂肪酶的最适pH值从7.5漂移到8.5。这主要是因为经过EDC的活化,使得带正电荷的壳聚糖载体转变成为带负电荷的载体,因此,固定化脂肪酶的最适pH值向碱性范围漂移。由于目前中碱性抄纸占主导地位,固定化脂肪酶非常适合用于处理中碱性造纸过程中形成的树脂类沉积物。
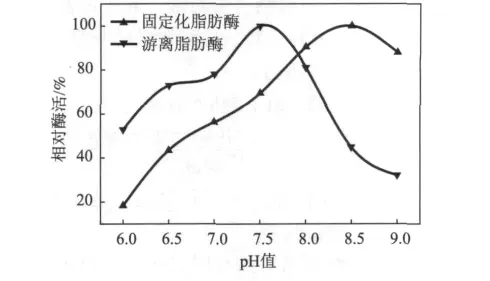
图3 pH值对游离和固定化脂肪酶酶活的影响

2.5 pH值对游离和固定化脂肪酶稳定性的影响
为了研究游离和固定化脂肪酶的酸碱稳定性,将固定化脂肪酶和游离脂肪酶在不同pH值缓冲液(pH值4.0~10.0)中保温1 h后,测定其相对酶活并进行比较,结果如图4所示。由图4可以看出,在pH值5.0时,固定化脂肪酶的相对酶活可保持85%左右,游离脂肪酶的相对酶活却只能保持70%左右;而在pH值大于9.0的条件下,固定化脂肪酶的相对酶活可保持80%左右,游离脂肪酶的相对酶活却只能保持约75%左右。这说明脂肪酶经双元固定化后pH值的稳定性得到一定程度的提高,可满足中碱性条件下控制树脂沉积物的需要。
2.6 温度对游离和固定化脂肪酶酶活的影响
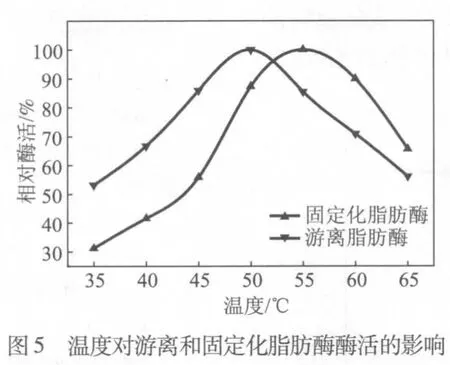
温度是影响生物酶活性的重要参数之一,在35~65℃的范围内分别研究了游离和固定化脂肪酶的最适反应温度,结果如图5所示。从图5可以看出,经过双元固定化后,脂肪酶最适反应温度从50℃升至55℃。在最适反应温度之后,随着温度的升高固定化脂肪酶的相对酶活下降速度明显小于游离脂肪酶。当反应温度达到65℃时,游离脂肪酶的相对酶活下降到55%左右,而固定化脂肪酶的相对酶活仍能保持在65%左右,这表明脂肪酶经过固定化后具有更广的温度使用范围,能满足处理较高温度造纸白水的要求。造纸白水温度一般在50~60℃之间,固定化脂肪酶在该温度范围内可保持最高酶活,可发挥出较好的控制树脂沉积物的效果。
2.7 温度对游离和固定化脂肪酶稳定性的影响
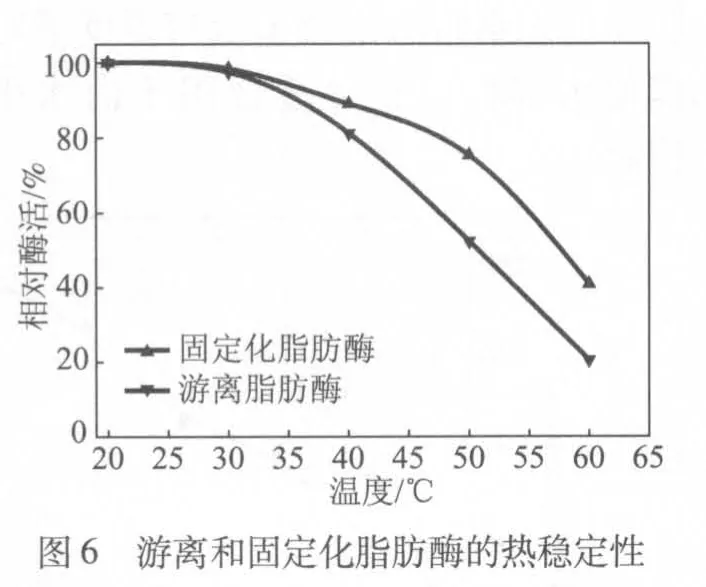
为了考察固定化脂肪酶和游离脂肪酶的热稳定性,将其分别置于不同温度(20~60℃)的磷酸缓冲液中,保温1 h后检测其相对酶活(见图6)。从图6可以看出,在40℃保温,固定化脂肪酶可保持约90%的相对酶活,而游离脂肪酶只能保持约80%的相对酶活;在60℃保温,固定化脂肪酶还可保持约40%的相对酶活,而游离脂肪酶只能保持约20%的相对酶活,这表明经过固定化后脂肪酶的热稳定性得到了一定程度的提高。因此,固定化脂肪酶更加适合用于较高温度下造纸系统中树脂沉积物的控制。
2.8 固定化脂肪酶的操作稳定性
操作稳定性是评价固定化脂肪酶的主要指标之一。为了考察固定化脂肪酶的重复使用性,对其进行连续8次酶活测定操作,并计算每次使用后的相对酶活,结果如图7所示。从图7可以看出,固定化脂肪酶的相对酶活随回用次数的增加而逐渐降低,但在连续使用5次后相对酶活仍保持在70%左右的较高的水平上;连续使用8次后,还能保持59%的相对酶活。在多次回用过程中,虽然会引起生物酶的部分失活,但该固定化脂肪酶所具有的优良的操作稳定性,为在实际生产过程中的重复利用提供了保障。
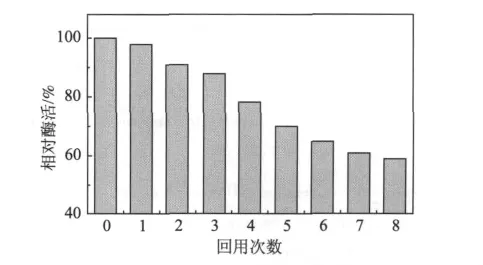
图7 固定化脂肪酶的回用性能
2.9 固定化脂肪酶对TG的催化水解性能
为了考察固定化脂肪酶对树脂胶黏物的控制效果,特别选择TG为树脂胶黏物的模型物。图8是固定化脂肪酶对TG的催化水解性能。从图8可以看出,在55℃反应温度下,随着水解时间的延长,油酸浓度急剧增加。当催化水解150 min时,经固定化脂肪酶水解生成的油酸浓度达到154 mmol/L。这说明固定化脂肪酶在55℃反应温度下对TG具有强烈的催化水解性,非常适合用于白水中树脂胶黏物的控制。
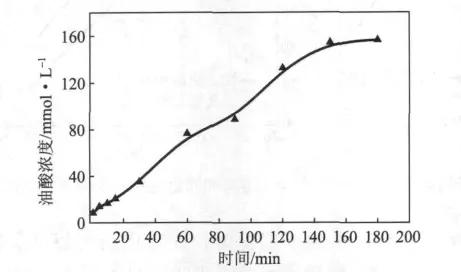
图8 固定化脂肪酶对TG的催化水解性能
3 结论
采用生物酶固定化技术,通过4种方法对造纸用碱性脂肪酶进行固定化处理,其中利用先进行碳二亚胺盐酸盐(EDC)活化然后进行戊二醛交联壳聚糖微球的方法固定化脂肪酶,可使固定化脂肪酶酶活和蛋白质含量达到最高。脂肪酶经过固定化后,最适温度从50℃升高到55℃,最适 pH值从7.5上升到8.5,并且脂肪酶的酸碱稳定性、热稳定性以及操作稳定性都得到明显提高。这些结果表明,脂肪酶经过固定化后不仅更加适合控制中碱性抄纸过程中形成的树脂沉积物,还可实现脂肪酶的回收利用。
[1]陈建平,黄儒珠,陈 静,等.用碱性脂肪酶消除磨木浆的树脂障碍的探索[J].福建师范大学学报:自然科学版,2000,16(1):94.
[2]王 旭,詹怀宇.树脂障碍生物控制技术进展[J].中国造纸,2001,20(6):58.
[3]李胜树.生物酶树脂控制的实践[J].中华纸业,2003,24(7):32.
[4]陈守勤,林一亭.用生物酶技术克服树脂障碍[J].国际造纸,2001,20(5):1.
[5]Rundlof M,Eriksson M,Stron H,et al.Effect of mannanase and lipase on the properties of colloidal wood extractives and their interaction with mechanical pulp fines[J].Cellulose,2002,9:127.
[6]Chiou S H,Wu W T.Immobilization of Candida rugosa lipase on chitosan with activation of the hydroxyl groups[J].Biomaterials,2004,25:197.
[7]Hung T C,Giridhar R,Chiou S H,et al.Binary immobilization of Candida rugosa lipase on chitosan[J].Journal of Molecular Catalysis B:Enzymatic,2003,26:69.
[8]Tang Z X,Qian J Q,Shi L E.Characterizations of immobilized neutral lipase on chitosan nano-particles[J].Materials Letters,2007,61:37.
[9]许敬亮,袁振宏,张 宇,等.氨基功能载体固定化酶研究进展[J].化工进展,2010,29(3):494.
[10]刘 颖,高 晗,范婷婷.壳聚糖-戊二醛交联吸附法固定β-葡萄糖苷酶的研究[J].食品科学,2008,29(5):315.
[11]Zhang Y D,Zhang Y,Jiang J J,et al.Surface derivatization with spacer molecules on glutaraldehyde-activated amino-microplates for covalent immobilization of beta-glucosidase[J].Applied Surface Science,2011,257(7):2712.
[12]Yigitoglu M,Temocin Z.Immobilization of Candida rugosa lipase on glutaraldehyde-activated polyester fiber and its application for hydrolysis of some vegetable oils[J].Journal of Molecular Catalysis B:Enzymatic,2010,66(1/2):130.
