奶水牛乳腺组织学研究报告
2012-12-15谭丽勤余长林王绍卿刘学洪
朱 柳,谭丽勤,余长林,王绍卿,刘学洪
在我国,水牛的用途多为役用。近年来,水牛的乳用性能开发利用越来越得到关注,采用乳役兼用河流型水牛与我国沼泽型水牛杂交,改进其产奶性能,取得良好的效果。然而,与普通牛相比,水牛的泌乳性仍有很多特殊性,如放乳慢、产量不高等。泌乳量与乳腺内部结构有关,水牛与普通奶牛泌乳的差异特性是否因为水牛乳房内部结构与普通奶牛不同是值得探索的。
1 材料与方法
1.1 材料
乳腺组织采自云南省大理州家畜繁育指导站奶水牛场的摩拉水牛和摩×尼×本三元杂水牛泌乳正常,无疾病的水牛。
1.2 试剂及工具
4%甲醛溶液、Harris苏木精染色液、盐酸酒精分色液、0.5%伊红染液、50%酒精、75%酒精、85%酒精、95%酒精Ⅰ、95%酒精Ⅱ、100%酒精Ⅰ、100%酒精Ⅱ、二甲苯Ⅰ、二甲苯Ⅱ、石蜡Ⅰ、石蜡Ⅱ、蛋白甘油,中性树脂。手术刀、手术剪、毛笔、细针、小镊子、载玻片、盖玻片、小木块,小瓶子、滤纸、恒温箱、水浴箱、石蜡切片机、荧光显微镜。
1.3 方法
1.3.1 取材和固定 屠宰,割下乳房并将其固定在解剖台上,用手术剪剪开皮肤,用手术刀在乳房的左上、左外、左后、左前靠中、右外、右前靠中、右后、右上乳头周围处切取大小1.0cm×2.0cm×4.0cm组织块,投入到4%的甲醛溶液中固定24h以上。
1.3.2 组织块处理 将固定好的组织从甲醛溶液中取出,用锋利的手术刀修成大小为1cm×1cm×0.2cm组织块。将修整好的组织块放到洗瓶内,每隔15min用清水冲洗一次,洗1h左右。
1.3.3 脱水和包埋 将组织块依次放到50%(3 h),75%乙醇(3h),85%乙醇(3h),95%乙醇Ⅰ(过夜),95%乙醇Ⅱ(3h),100%乙醇Ⅰ(1.5h),100%乙醇Ⅱ(1.5h)进行脱水。将脱水后的组织放入二甲苯中半小时左右使组织透明。提前一天将石蜡Ⅰ和石蜡Ⅱ放到58~60℃的恒温箱中融化,将处理好的组织放到石蜡Ⅰ中浸1h,之后再放到石蜡Ⅱ中浸1h。将熔好的石蜡Ⅱ倒入包埋盒内,用镊子夹取组织块放到石蜡中,置好方向,放到室温下冷却。
1.3.4 制片 切去组织周围过多的石蜡,在组织周围留有1~2mm的蜡边,对边须平行,这样切出的切片比较均匀。将修好的蜡块固定在小方木块上,用夹子固定在切片机上,调整角度及厚度进行连续切片,将切好的薄片放到装有40℃水的水浴箱中进行展片,用涂有蛋白甘油的载玻片取出,并随手将玻片上的水甩干,有利于切片与载玻片之间的结合。将展好的切片放到40℃恒温箱中烤1h,之后用H.E染色法进行染色,中性树脂封片,最后盖上盖玻片放到显微镜下观察照相。
2 结果与分析
泌乳期水牛乳腺结缔组织和脂肪组织较少,腺泡较多,且为不规则的卵圆形,大小不一,内充满乳汁(图1),经过H.E染色后,结缔组织、上皮细胞的细胞质和腺泡内的乳汁被染成红色,上皮细胞的细胞核被染成紫蓝色。显微镜观察初步统计该水牛在乳腺小叶区域的乳腺泡数量范围为80~150个/mm2,直径范围为50~100μm。经过显微图片初步统计泌乳水牛乳腺组织占62.8%,结缔组织占7.6%,脂肪组织占19.6%。
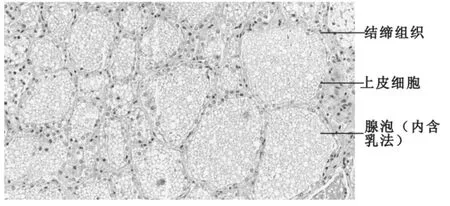
图1 摩拉水牛泌乳期乳腺组织切片(H.E×100倍)

图2 摩×尼×本三元杂水牛泌乳后期乳腺组织切片(H.E×40倍)
图2、3、4为不同放大倍数下的摩尼本三元杂泌乳后期水牛乳腺组织切片,泌乳后期水牛泌乳量减少,乳腺间质开始增加,在显微镜观察下乳腺内的结缔组织和脂肪组织相对较多,导管较发达,从图2中可以清楚的看到与乳腺泡相连的乳腺小叶内导管,小叶间导管和导管与腺泡间的结缔组织,腺泡数量相对较少,腺泡较小,乳汁被挤出,内为空腔。在显微镜下统计该水牛在乳腺小叶区域的腺泡数量范围为50~100个/mm2,直径范围为50~150μm。摩×尼×本三元杂泌乳后期的腺泡数量与摩拉水牛泌乳期的相比较少,但最大腺泡直径相比要大一些。

图3 摩×尼×本三元杂水牛泌乳后期乳腺组织切片(H.E×100倍)

图4 摩×尼×本三元杂水牛泌乳后期乳腺组织切片 (H.E×200倍)
3 讨论
乳腺泌乳能力是由分泌乳汁的细胞数量和活力大小来决定的。在泌乳期激素的刺激下,乳腺上皮细胞增加,表现为乳腺泡的增大。在反刍动物中,乳腺在进入泌乳期时开始生长,Tucker(1987)对动物妊娠后期和泌乳第一天乳房中的DNA总量估计,山羊和奶牛的乳腺细胞数量呈显著上升趋势[1],在泌乳期的第一周DNA水平持续增加[2]。Knight(1987)在体外测量到有乳糖和蛋白的合成证明,在泌乳期开始时乳腺上皮细胞的活性开始升高3]。Franke(1979)研究发现,泌乳期乳腺上皮细胞发生有丝分裂现象[4]。而在泌乳期即将结束时,乳腺上皮细胞的活性开始下降,并逐渐衰亡,细胞数量逐渐减少,乳腺泡也逐渐变少。有研究发现在小鼠的乳房退化期乳腺细胞发生程序化死亡[5,6]。在奶牛泌乳期结束后,乳腺泡上皮细胞开始膨胀,细胞内脂质逐渐积累,细胞脱落进入腺泡腔内或被细胞膜降解,凋亡的细胞在衰退的奶牛乳腺组织中占4.8%,比在泌乳期占有 的比例 (2.4%)要高[7]。Capuco(1997)等研究表明,荷斯坦奶牛乳腺上皮细胞在泌乳期第90d时占乳腺组织的79%,240d以后只占73%[8]。
本试验结果显示摩拉水牛在泌乳中后期乳腺小叶区域的腺泡数量范围为80~150个/mm2,直径范围为0.05~0.1mm,与Parekh(2002)[9]报道的水牛在泌乳期的乳腺泡数量范围72.73~123.38个/mm2和 A.K.Patel(2007)[10]报道的摩拉水牛泌乳期乳腺泡数量平均分别为130.0±2.98个/mm2以及腺泡直径平均大小在泌乳期腺泡直径42.89~71.47μm基本相符。这在一定程度上说明,摩拉水牛的乳腺上皮细胞的数量和大小是遗传力较大的性状,受环境的影响小,可以稳定遗传并表达,奶水牛的这一特点为我们的选种带来了便利。
摩×尼×本三元杂在泌乳后期乳腺小叶区域的腺泡数量范围为50~100个/mm2,直径范围为0.05~0.15mm,与摩拉水牛相比,腺泡直径范围很接近,而腺泡数量明显较少,这可能就是摩×尼×本三元杂泌乳量较摩拉水牛低的原因之一。本研究没有取沼泽型水牛做对照,原因是沼泽型水牛并不挤奶,希望以后对沼泽型水牛哺乳期的乳腺组织进行研究,提供更多的证据。
试验结果表明,泌乳量均与腺泡数量和大小有关,这与Linzell(1966)研究报道乳腺大小与产奶量之间存在着正相关[11]结果一致。Nagai(1978)等在小鼠中发现乳腺细胞的数量与乳腺大小相比,数量与泌乳量的相关性更高[12]。Capuco(2001)等在研究奶牛泌乳中发现在泌乳期第90~240d内产奶量下降了23%,与乳腺上皮细胞的总DNA下降了17%[13]的研究结果具有一致性。值得注意的是,本研究中摩拉水牛的腺泡直径上限比杂交牛的小,这也许是测定误差所致,有待进一步研究。
据报道荷斯坦奶牛在泌乳期乳腺泡直径范围为50~250μm,比水牛的腺泡直径范围中的最大值要大,由此推测荷斯坦奶牛的分泌细胞分泌乳汁的能力比水牛的要大,但单位面积的腺泡数量未见报道。试验中测定的水牛乳腺组织中,在泌乳中后期,腺泡部分占整个乳房的62.8%,而荷斯坦奶牛的占75%~80%[14]左右,荷斯坦奶牛的泌乳期乳腺泡直径最大值和其乳腺组织含量均明显大于奶水牛,通过观察乳腺组织切片得到的这一差距不仅从生理结构上解释了荷斯坦牛优越的泌乳性能,更为我们的今后选种提供指导依据。
4 结论
奶水牛的乳腺腺泡数量少于荷斯坦牛,腺泡直径小于荷斯坦牛;杂种水牛腺泡数比摩拉水牛的少,暗示腺泡数及大小是影响水牛泌乳量的重要内在因素。
[1]Tucker H A.Quantitative estimates of mammary growth during various physiological states:a review[J].J Dairy Sci.,1987,70:1958-1966.
[2]Anderson R R,Harness J R,Snead A F,etal.Mammary growth pattern in goats during pregnancy and lactation[J].J Dairy Sci.,1981,64:427-432.
[3]Knight C H,Wilde C J.Mammary growth during lactation:implications for increasing milk yield[J].J Dairy Sci.,1987,70:1991-2000.
[4]Franke W W,Keenan T W.Mitosis in milk secreting epithelial cells of mammary gland:an ultrastructural study[J].Differentiation,1979,13:81-88.
[5]Quarrie L H,Addey C V,Wilde C J.Programmed cell death during mammary tissue involution induced by weaning,litter removal,and milk stasis[J].J Cell Physiol.,1996,168:559-569.
[6]Strange R,Li F,Saurer S,etal.Apoptotic cell death and tissue remodeling during mouse mammary gland involution[J].Development,1992,115:49-58.
[7]Wilde C J,Addey C V,Li P,etal.Programmed cell death in bovine mammary tissue during lactation and involution[J].Experimental Physiology,1997,82:943-953.
[8]Capuco A V,Akers R M,Smith J J.Mammary growth in Holstein cows during the dry period:quantification of nucleic acids and histology[J].J Dairy Sci.,1997,80:477-487.
[9]Parekh B H.Gross and microscopic studies on the udder of lactating and non lactating,non pregnant adult buffaloes(Bubalus bubalis)[J].M.V.Sc.Thesis submitted to Gujarat Agriculture University,Anand,2002.
[10]Pate A K,Koringa P G,Nandasana K N,etal.Comparative histology of mammary gland in heifer,pregnant,lactating and dry buffaloes[J].Indian Journal of Veterinary Anatomy,2007,19(1):71-78.
[11]Linzell J L.Measurement of udder volume in live goats as an index of mammary growth and function[J].J Dairy Sci.,1966,49:307-311.
[12]Nagai J,Sarkar N K.Relationship between milk yield and mammary gland development in mice[J].J Dairy Sci.,1978,61:733-739.
[13]Capuco A V,Wood D L,Baldwin R,etal.Mammary cell num-ber,proliferation,and apoptosis during a bovine lactation:relation to milk production and effect of bST.J Dairy Sci.,2001,84:2177-2187.
[14]莫 放.养牛生产学[M].北京:中国农业出版社,2010.
