胶质母细胞瘤干细胞的分离、培养及其生物学特性
2012-12-06李蕴潜丁丽娟于洪泉
齐 玲,李蕴潜,金 宏,丁丽娟,于洪泉,温 娜,刘 威
(1.吉林医药学院病理学教研室,吉林 吉林132013;2.吉林大学第一医院神经外科,吉林 长春130021;3.吉林医药学院实验中心,吉林 吉林132013)
胶质母细胞瘤干细胞的分离、培养及其生物学特性
齐 玲1,李蕴潜2,金 宏3,丁丽娟2,于洪泉2,温 娜3,刘 威3
(1.吉林医药学院病理学教研室,吉林 吉林132013;2.吉林大学第一医院神经外科,吉林 长春130021;3.吉林医药学院实验中心,吉林 吉林132013)
目的:从人胶质母细胞瘤SC 326和SC 189细胞株分离培养干细胞,研究其自我更新、增殖和分化等生物学特性。方法:用无血清培养基培养人胶质母细胞瘤SC 326和SC 189细胞,检测细胞形成神经球的能力。对培养3代以上的细胞(GSC)进行神经球细胞单细胞克隆形成率实验;用第3代和第7代的细胞评价神经球单细胞克隆形成率;免疫荧光染色法检测神经球细胞的干细胞标记物表达及多向分化能力。结果:无血清培养基培养24 h时SC 326、SC 189形成神经球样细胞团,1周时神经球内细胞可达数百个,3代内神经球细胞SC 326的增殖率为(2.10±4.33)%、(4.03±4.14)%和(6.91±5.12)%,SC 189为(12.79±2.32)%、(15.78±3.25)%和(37.91±4.58)%;单细胞克隆形成率 GSC 326和 GSC 189分别为5.56%和8.33%,次级单细胞克隆形成率分别为9.89%和14.58%;GSC 326 P3和P7神经球克隆形成率最大值为(12.67±2.86)%和(20.44±1.73)%,GSC 189 P3和P7神经球克隆形成率最大值为(32.00±1.00)%和(42.67±5.03)%。免疫荧光染色,干细胞表面标记物CD133和神经巢蛋白呈强阳性表达,分化标记物胶质纤维酸性蛋白(GFAP)和神经元特异性类β-微管蛋白Ⅲ(β-TubulinⅢ)表达极弱。分化诱导后分化标记物GFAP和β-TubulinⅢ的表达呈阳性。结论:早期原代胶质母细胞瘤细胞株中存在少量具有自我更新、增殖和多向分化能力的细胞,这些细胞具有明显的干细胞特性。
胶质母细胞瘤干细胞;自我更新;增殖;分化
脑肿瘤以胶质瘤最为常见,70%以上胶质瘤为恶性,以胶质母细胞瘤恶性度最高。寻找脑肿瘤复发的根源,延长患者的生存时间,已成为亟待解决的难题。越来越多的研究[1-3]显示:脑肿瘤干细胞可能是脑肿瘤复发及治疗抵抗的根源。国内外相关研究[4-5]显示:由于脑肿瘤干细胞标本来源少,难以培养,不易获得足够的研究材料,这给脑肿瘤干细胞的研究带来了一定困难。本研究在以往研究的基础上,应用早期原代(3代以内)胶质母细胞瘤SC 326和SC 189细胞株[6],用无血清培养基(serum-free media,SFM)进行培养,培养3代后对其干细胞特性进行初步探讨。
1 材料与方法
1.1 细胞及主要试剂 本实验室保存胶质母细胞瘤SC 326和SC 189细胞株[6]。DMEM/F12培养液、神经培养基、B27添加剂和小牛血清(美国Gibco公司);人碱性成纤维细胞生长因子(b FGF,英国Pepro Tech公司);人表皮生长因子(EGF,英国Pepro Tech公司);兔抗人CD133多克隆抗体(美国Cell Signaling公司);鼠抗人Nestin单克隆抗体、鼠抗人β-TubulinⅢ单克隆抗体和兔抗人GFAP多克隆抗体(加拿大Inc公司);Tex-Red标记驴抗鼠和FITC标记驴抗兔IgG抗体(美国Jachson Immunoresearch公司)。
1.2 人胶质母细胞瘤神经球的培养 将SC 326和SC 189细胞以104cm-2的密度接种到SFM(神经培养基含有EGF 20μg·L-1、bFGF 20μg·L-1、1×B27添加物)中,置于5%CO2、37℃孵箱中培养。每天观察生长情况,5~7 d后收集无血清培养基的悬浮神经球,110 g离心10 min后换新鲜SFM,机械吹打成单细胞悬液,按1∶2或1∶3比例传代,3代以后细胞命名为GSC 326、GSC 189。
1.3 单细胞悬液的制备及单细胞克隆形成率的测定 将GSC 326、GSC 189神经球细胞机械吹打成单细胞悬液,300目滤网过滤,台盼蓝计数活细胞。细胞梯度稀释到10 m L-1浓度,在96孔板每孔中加入100μL细胞悬液,6 h后显微镜下观察孔中的细胞数目,记录含单细胞的孔。1个月后计数单细胞克隆形成率。神经球长至100~200个细胞后,将克隆球连同培养液吸出,机械吹打成单细胞后接种于96孔板中,继续观察次级克隆形成率,单细胞或次级克隆形成率=含神经球孔/含细胞孔×100%。
1.4 神经球干细胞表面抗原的检测 收集神经球,800 g离心3 min,弃上清。PBS洗涤沉淀转至1.5 m L离心管中,4% 多聚甲 醛 固 定。0.3%Triton X-100通透细胞。5%驴血清室温封闭1 h,加 入 一 抗(Nestin 1,200;CD1331,100;β-TubulinⅢ1,200;GFAP 1∶1000)4℃过夜,加入相应的二抗(Tex-Red或FITC 1∶200),室温下避光孵育1 h。用DAPI染色试剂盒进行核染色并封片,荧光显微镜下观察拍照。
1.5 神经球诱导分化后多分化潜能的检测 将GSC 326和GSC 189神经球制备成单细胞悬液,以每孔1×104的密度接种于已放入玻片的6孔板中,诱导分化14 d。取出玻片,PBS冲洗2次;4%多聚甲醛固定30 min,PBS冲洗3次;0.3%Triton X-100通透15 min,PBS冲洗2次。5%驴血清封闭30 min。加入一抗4℃过夜。PBS冲洗2次。加入相应二抗,室温黑暗条件下孵育1 h。PBS冲 洗2次。4′,6-二 脒 基-2-苯 基 吲 哚(4′,6-diamidino -2-phenylindole,DAPI) 染 色 封 片。荧光显微镜下观察并拍照。每组取2张作阴性对照,分别不加一抗和不加一抗及二抗,以PBS代替。
1.6 统计学分析 采用SPSS 17.0统计学软件进行数据分析。神经球细胞增殖能力和神经球单细胞克隆形式率以±s表示,第3和7代神经球单细胞克隆形成率比较采用t检验。
2 结 果
2.1 胶质母细胞瘤在SFM中形成神经球的能力SC 326和SC 189细胞转入SFM中培养,6 h后细胞从伸展状态开展缩小、变圆。24 h细胞变亮呈球形,增生形成神经球样细胞团。3 d后神经球明显增多、增大,形状多规则,由数量不等的圆形细胞组成。1周后神经球内细胞可达到数百个,晃动培养瓶时可见神经球滚动。台盼兰计数细胞后,计算1至3代传代形成神经球细胞的增殖率,SC 326细胞为(2.10±4.33)%、(4.03±4.14)%和(6.91±5.12)%,SC 189 细 胞 为(12.79±2.32)%、(15.78±3.25)%和(37.91±4.58)%。见图1。
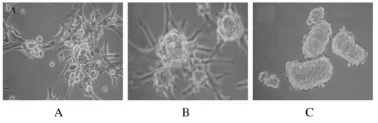
图1 胶质母细胞瘤细胞在SFM中形成神经球的过程Fig.1 The process of neuroshpere formation from glioblastoma cells in SFM
2.2 神经球单细胞克隆形成率 观察96孔板中细胞,接种24 h时细胞明显增大、肿胀和变亮,约7 d时可见到明显的细胞分裂增殖,2周时已形成有数十个细胞的神经球,1个月后GSC 326和GSC 189单细胞克隆形成率分别为5.56%和8.33%。将神经球再消化成单细胞,GSC 326和GSC 189次级单细胞克隆形成率分别为9.89%和14.58%。见图2。
2.3 第3和7代神经球单细胞克隆形成率 将每孔200个神经球细胞按1∶2密度梯度稀释方法接种于96孔板中。24 h后P3和P7均出现部分细胞明显增大、肿胀、变亮和细胞增殖缓慢,不同的是第7代神经球比第3代形成次级神经球速度快,并且形成更大的次级神经球;GSC 189较GSC 326形成神经球的速度快,且神经球的体积更大。2周后计算克隆形成率GSC 326 P3和P7最大值分别为(12.67 ± 2.86)% 和(20.44 ± 1.73)%,GSC189 P3和P7最大值分别为(32.00±1.00)%和(42.67±5.03)%,2组比较差异无统计学意义(P>0.05)。见图3。
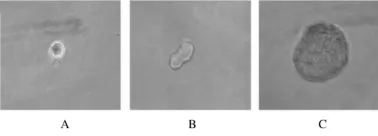
图2 GSC 326和GSC 189单细胞克隆形态Fig.2 The morphology of neurosphere formation of GSC 326 and GSC 189 single cells
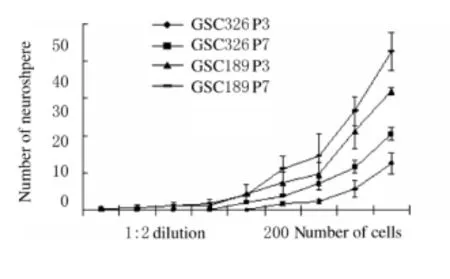
图3 不同代神经球次级克隆形成率Fig.3 The sub-clone formation rates of different passages of neurospheres
2.4 神经球干细胞表面抗原特异性标记物的表达
神经球干细胞标记物CD133和巢蛋白表达呈强阳性;分化标记物胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和神经元特异性类β-微管蛋白Ⅲ(neuron-specific classβ-TubulinⅢ,β-TubulinⅢ)表达较弱。见图4(封二)。
2.5 神经球经分化诱导后分化标记物的表达 在最初几天可见到神经球开始分散伸展,细胞形态出现不同的变化,第7天时观察到有明显的神经元出现,随着时间的延长出现更多的神经元。荧光抗体标记后,第7天时神经元特异性抗体表达不明显,在2周时表达明显增加;GFAP表达较多,随着分化时间的延长表达量也增加。见图5(封二)。
3 讨 论
在人体各部位的肿瘤中,脑肿瘤对生命的威胁较大,对生活质量的影响也更明显。最近肿瘤生物学研究[1]显示:肿瘤的生长和更新是由一小群肿瘤干细胞(tumor stem cells,TSCs)所驱动。因此,脑肿瘤中存在 “脑肿瘤干细胞(brain tumor stem cells,BTSCs)”,其是脑肿瘤发生、复发的根源,并使肿瘤对放、化疗等产生抵抗[1-3]。
1992年Reynolds等[7]建立了神经球分离神经干细胞的方法。神经球由干细胞、祖细胞和终末分化细胞组成,在神经球中仅有10%~50%的细胞具有干细胞特性,在传代过程中,终末分化细胞很快死亡,干细胞增殖并具有再形成神经球的能力,且这个过程可以重复出现。这样在培养体系中存在大量、稳定的神经干细胞[8-10]。针对这一特性,本研究选用3代以内的SC 326和SC 189细胞,将细胞接种至SFM中培养[11],大部分细胞死亡,有少量细胞增大、变圆和变亮,开始增生,形成神经球。最初形成的神经球数量很少,但在传代过程中神经球数量逐渐增多。本研究还发现:SC 189较SC 326更易形成神经球,形成神经球的数量明显增多。
肿瘤干细胞在SFM中呈悬浮球状生长,具有无限增殖、自我更新和多向分化的特性[7]。本文作者通过胶质母细胞瘤在SFM中形成神经球的能力、单细胞克隆形成率、次级单细胞克隆形成率和不同代神经球单细胞克隆形成率的比较发现:所获得的GSC 326、GSC 189神经球细胞具有明显的增殖能力,并且具有干细胞特性的细胞所占比例极小。在神经干细胞的标记物中CD133和巢蛋白应用较多[12-14],这些标记物也同样应用于肿瘤干细胞的检测中。本研究中免疫荧光检测GSC 326和GSC 189神经球表达干细胞标记物CD133和巢蛋白,显示神经球干细胞标记物表达呈强阳性;同时分化标记物β-TubulinⅢ和GFAP表达极弱。脑肿瘤干细胞除了需要鉴定神经干细胞的表面标记外,由于其具有多向分化潜能,可以诱导分化为多种终末分化细胞,故还需进行分化标记物的鉴定。脑肿瘤干细胞主要分化为神经元和星形胶质细胞[15]。GFAP是星形胶质细胞的标志蛋白。神经细胞的标记蛋白有Neu N、Map2和β-TubulinⅢ。有研究还检测到树突状细胞的标记蛋白有Olig-2、O4和S-100β。本实验选取GFAP作为星形胶质细胞分化标记物,β-TubulinⅢ作为神经细胞的分化标记物。本研究对GSC 326、GSC 189神经球细胞进行分化诱导后,免疫荧光染色结果显示:2株神经球细胞均可诱导出典型分化细胞(星形胶质细胞和神经元),分化标记物染色阳性。
从患者脑胶质瘤标本分离培养干细胞的培养条件比较特殊,培养液组成复杂,费用昂贵,给胶质瘤干细胞的研究带来了很多不便。从胶质母细胞瘤细胞株原代培养细胞中筛选干细胞,使脑肿瘤干细胞的分离、培养更加简便快捷,不受实验室条件的影响,但还需要继续研究其培养的条件,简化培养基组成成分。
[1]Dirks PB.Brain tumor stem cells:the cancer stem cell hypothesis writ large[J].Mol Oncol,2010,4(5):420-430.
[2]Wang R,Chadalavada K,Wilshire J,et al.Glioblastoma stem-like cells give rise to tumour endothelium[J].Nature,2010,468(7325):829-833.
[3]Silvestre DC,Pineda JR,Hoffschir F,et al.Alternative lengthening of telomeres in human glioma stem cells[J].Stem cells,2011,29(3):440-451.
[4]齐 玲,金 宏,丁丽娟,等.CD133免疫磁珠分选脑肿瘤干细胞及其生物学特性[J].吉林大学学报:医学版,2011,37(3):441-444.
[5]齐 玲,金 宏,丁丽娟,等.脑肿瘤干细胞的培养及生物学特性研究[J].中国实验诊断学,2011,15(2):227-228.
[6]Li YC,Tzeng CC,Song JH,et al.Genomic alterations in human malignant glioma cells associate with the cell resistance to the combination treatment with tumor necrosis factorrelated apoptosis-inducing ligand and chemotherapy[J].Clin Cancer Res,2006,12(9):2716-2729.
[7]Reynolds BA,Weiss S.Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system[J].Science,1992,255(5052):1707-1710.
[8]Gritti A,Frolisthal-Schoeller P,Galli R,et al.Epidermal and fibroblast growth factors behave as mitogenic regulators for a single multipotent stem cell-like population from the subventricular region of the adult mouse forebrain[J].J Neurosci,1999,19(9):3287-3297.
[9]Galli R,Fiocco R,Filippis LD,et al.Emx2 regulates the proliferation of stem cells of the adult mammalian central nervous system[J].Development,2002,129(7):1633-1644.
[10]Parras CM,Galli R,Britz O,et al. Mash1 specifies neurons and oligodendrocytes in the postnatal brain[J].EMBO J,2004,23(22):4495-4505.
[11]Soria JM,Taglialatela P,Gil Perotin S,et al.Defective postnatal neurogenesis and disorganization of the rostral migratory stream in absence of the Vax1 homeobox gene[J].J Neurosci,2004,24(49):11171-11181.
[12]Yuan X,Curtin J,Xiong Y,et al.Isolation of cancer stem cells from adult glioblastoma multiforme[J].Oncogene,2004,23(58):9392-9400.
[13]Singh SK,Hawkins C,Clarke ID,et al.Identification of human brain tumour initiating cells[J].Nature,2004,432(7015):396-401.
[14]Lendahl U,Zimmerman LB,Mc Kay RD.CNS stem cells express a new class of intermediate filament protein[J].Cell,1990,60(4):585-595.
[15]Chaichana KL,Guerrero-Cazares H,Capilla-Gonzalez V,et al.Intra-operatively obtained human tissue:Protocols and techniques for the study of neural stem cells[J].J Neurosci Methods,2009,180(1):116-125.
Isolation and culture of glioblastoma stem cells and their biological characteristics
QI Ling1,LI Yun-qian2,JIN Hong3,DING Li-juan2,YU Hong-quan2,WEN Na3,LIU Wei3
(1.Department of Pathology,Jilin Medical College,Jilin 132013,China;2.Department of Neurosurgery,First Hospital,Jilin University,Changchun 130021,China;3.Experimental Center,Jilin Medical College,Jilin 132013,China)
Objective To isolate and culture the stem cells from human glioblastoma SC 326 and SC 189 cells and to investigate the biological characteristics such as self-renewal,proliferation,and differentiation.Methods The human glioblastoma SC 326 and SC 189 cells were cultured in serum-free media,the capability of forming neurospheres was detected.Clone forming rate assay was performed to assess the capacity of self-renewal and clonogenic potential of the cells.Immunofluorescence staining method was used to study the expressions of surface markers of stem cells and the multi-differentiation function of neurospheres.Results The cells isolated from SC 326 and SC 189 cultured in serum-free media for 24 h had strong characteristics of self-renewal,proliferation,and neurosphere reformation.The proliferation rates of SC 326 were(2.10±4.33)%,(4.03±4.14)%,and(6.91±5.12)%;and those of SC 189 were(12.79±2.32)%,(15.78±3.25)%,and(37.91±4.58)%in the first three generations;the rates of neurospheres formation of GSC 326 and GSC 189 single cells were 5.56%and 8.33%,and the rates of sub-spheres formation were 9.89%and 14.58%;the maximum clone formation rates of GSC 326 P3 and P7 neurospheres were(12.67±2.86)%and(20.44±1.73)%,and those of GSC 189 P3 and P7 were(32.00±1.00)%and(42.67±5.03)%.Immunofluorescence staining showed that the neuron stem cells marker CD133 and nestin positively expressed;and the glial fibrillary acidic protein(GFAP)and neuron-specific classβ-tubulinⅢ(β-Tubulin Ⅲ)weekly expressed.After treated with differentiated media,the expressions of differentiation markersβ-Tubulin Ⅲ and GFAP were positive.Conclusion A few cells existed in glioblastoma SC 326 and SC 189 cell lines in the primary and early stage have the capacities of self-renewal,proliferation and multi-differentiation and the cells present definite features of stem cells.
glioblastoma stem cells;self-renewal;proliferation;differentiation
R739.41;Q813
A
1671-587Ⅹ(2012)06-1043-05
2012-06-11
国家自然科学基金青年基金资助课题(81201671);吉林省科技厅自然科学基金资助课题(202015242);吉林省教育厅 “十二五”科学技术研究项目资助课题(2012330)
齐 玲(1974-),女,吉林省吉林市人,副教授,医学博士,主要从事脑肿瘤干细胞方面的研究。
齐 玲(Tel:0432-64560027,E-mail:qiling1718@163.com)
时间:2012-10-2509:34
网络出版地址:http://www.cnki.net/kcms/detail/22.1342.R.20121025.0934.004.html
