国外茁霉多糖上游处理研究现状及进展
2012-12-04苏安祥冯印刘杰王玉华
苏安祥,冯印,刘杰,王玉华
(吉林农业大学 食品科学与工程学院,吉林 长春 130118)
国外茁霉多糖上游处理研究现状及进展
苏安祥,冯印,刘杰,王玉华*
(吉林农业大学 食品科学与工程学院,吉林 长春 130118)
茁霉多糖(Pullulan)是一种水溶性胞外中性多糖,由真菌出芽短梗霉(Aureobasidium pullulans)发酵生产的。茁霉多糖在食品工业、药品等领域有广泛的应用,是一种很有前景的多糖,但是大规模生产的还很少,主要原因有两个,一个是产量低,另一个是多糖中色素难以除去。综述茁霉多糖的生产菌种、生物合成机理,培养条件的最新研究成果,同时讨论了茁霉多糖的应用前景和研究热点。
茁霉多糖;微生物来源;合成机理;培养条件
茁霉多糖是由出芽短梗霉生产的一种微生物多糖。它是一种白色粉末,无味,无臭,无毒,极易溶于水,可塑性极强,具有良好的成膜性,膜具有光泽而透明,透气性较其他高分子膜低,具有更好的阻隔氧气的性能。茁霉多糖已广泛应于医药、食品、化妆、轻工和石油等领域,是一种非常有前景的新型多糖。但是在发酵生产中的一个缺点是产量低并且在发酵生产中分泌一种黑色素类化合物。另外一个缺点是,出芽短梗霉随着发酵的进行,胞外多糖的平均分子量会减小,黏度降低,并且发酵液中底物糖用尽后茁霉多糖被分解以维持细胞的生长发育,正是这些问题阻碍着茁霉多糖的生产。近年来引起了国外学者的广泛关注,发表了许多关于微生物来源、结构、上游处理、下游加工以及应用等方面的文章。本文将对国外有关茁霉多糖生物合成机理、生产菌种、培养条件的研究现状和进展进行回顾和讨论。
1 生物合成的机理研究
茁霉多糖的生产是在对数期后期和稳定期的前期。Catley[1]首先发现,在菌丝体转变成酵母状细胞形式时茁霉多糖出现,据此推断酵母状细胞独立负责茁霉多糖的加工。有研究证明了这种理论,因为在有利于酵母状细胞形态生长的条件下多糖产量最大。有数据显示溶涨细胞以及厚膜孢子的形成和茁霉多糖形成是同时的。Simon等提出,不论菌丝形式细胞合成何种多糖,都不是茁霉多糖。当大量的厚膜孢子出现时,无论培养基是何种条件都一直进行茁霉多糖的加工。Yurlova等认为,菌丝体细胞形式也可以产生胞外多糖,而Seviour等认为多糖生产不和任何形态的转变相联系。Campbell等最近研究显示,厚膜孢子和溶涨细胞分泌多糖,但是分生孢子或菌丝体不分泌。有些研究之间是相互冲突的,这可能是因为茁霉多糖的生产受多种因素的影响。
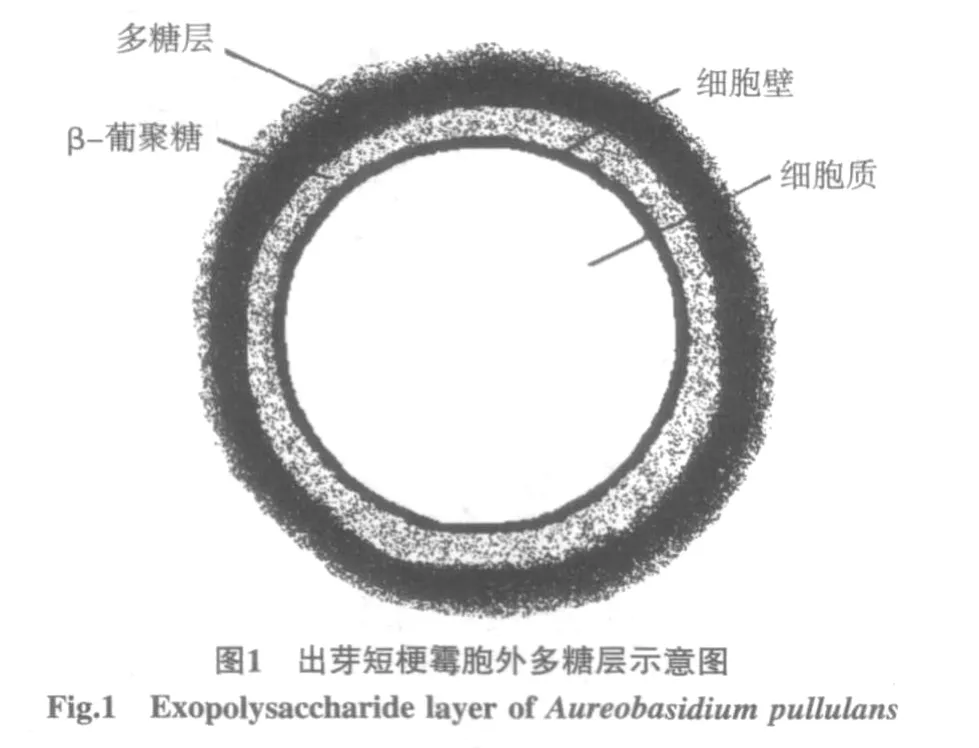
研究人员还提出了几种关于茁霉多糖是如何加工的理论。关于各种出芽短梗霉菌株生物合成茁霉多糖的各种性质特点的完整论述出版于1981年。Catley[2]在1971年提出一个类脂是茁霉多糖运到细胞膜外的载体。Lee和Simon等的研究证明了这一观点。Rho等[3]提出了2个途径,一个是直接由葡萄糖转换,第2个是从确定的前体转化。Simon等[4]研究提出,茁霉多糖和不溶性多糖都集中在厚膜孢子的外表面上,如图1。
最外层是密集的多糖层,里面包着一层由葡萄糖和甘露糖通过β-1,3-糖苷键连接而成的不溶性的多聚糖层。Simon等[5]1998年研究表明,茁霉多糖在胞外的聚集和细胞内糖原浓度呈现负相关,但是糖原如何转化茁霉多糖的机制还没有搞清楚。
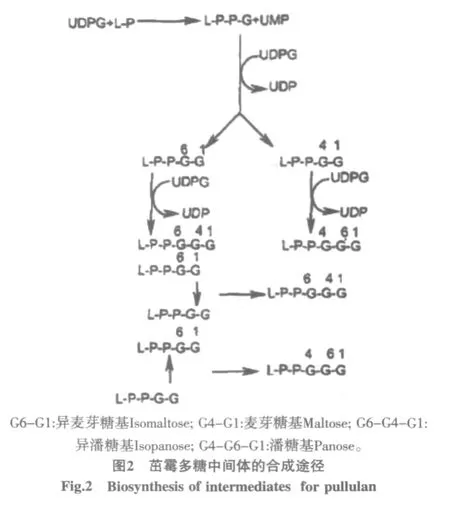
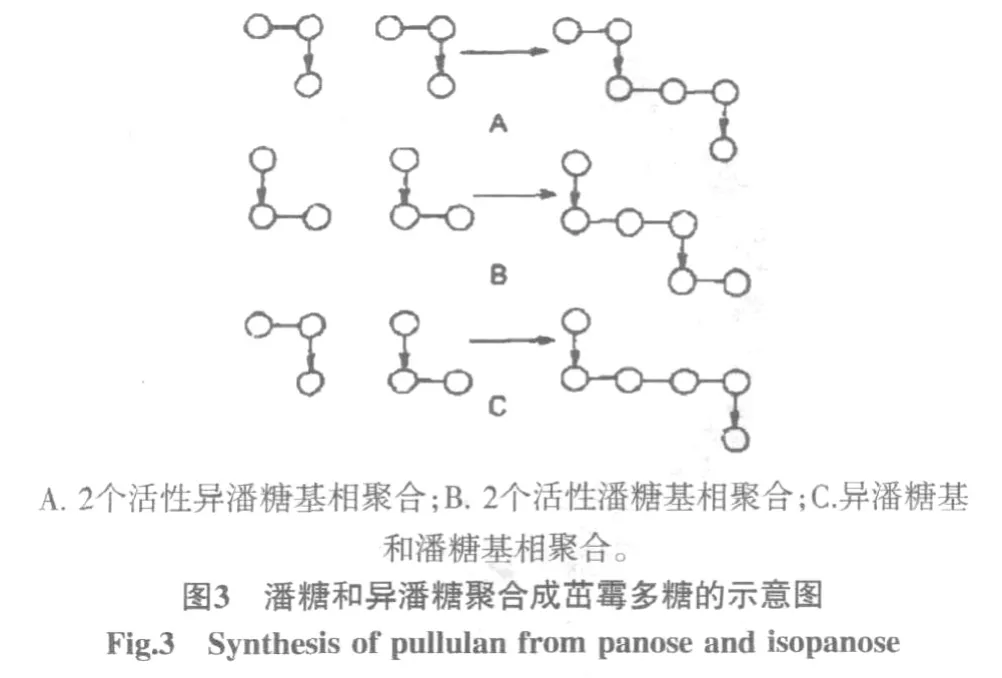
Catley和McDowell在总结各自研究结果和数据的基础上,提出下面的茁霉多糖生物合成的途径[6]。第一步是UDPG(尿苷二磷酸葡糖)把一个D-葡萄糖基转到脂质磷酸(L-P)上形成焦磷酸葡糖(L-P-P-G),然后再转移一个D-葡萄糖基形成脂质键合的异麦芽糖(L-PP-G6-G1)和麦芽糖基(L-P-P-G4-G1),接着再从UDPG转移一个D-葡萄糖,或用L-P-P-G上的葡糖基与脂质键合的异麦芽糖基作用,生成脂质键合的异潘糖基和潘糖基(中间体,见图2),最后这些活性的异潘糖基和潘糖基相互聚合,形成茁霉多糖链,见图3。
2 菌种
有关茁霉多糖生产菌种报道最多的是出芽短梗霉(A.pullulans),出芽短梗霉(A.pullulans)是一种普遍存在的由环境分离的真菌。它们生长于土壤、水和腐生物的腐烂叶、乱抛垃圾等。大部分出芽短梗霉能够生产茁霉多糖,但不是全部。除出芽短梗霉外,其他有报道的一些生产茁霉多糖的微生物总结见表1。
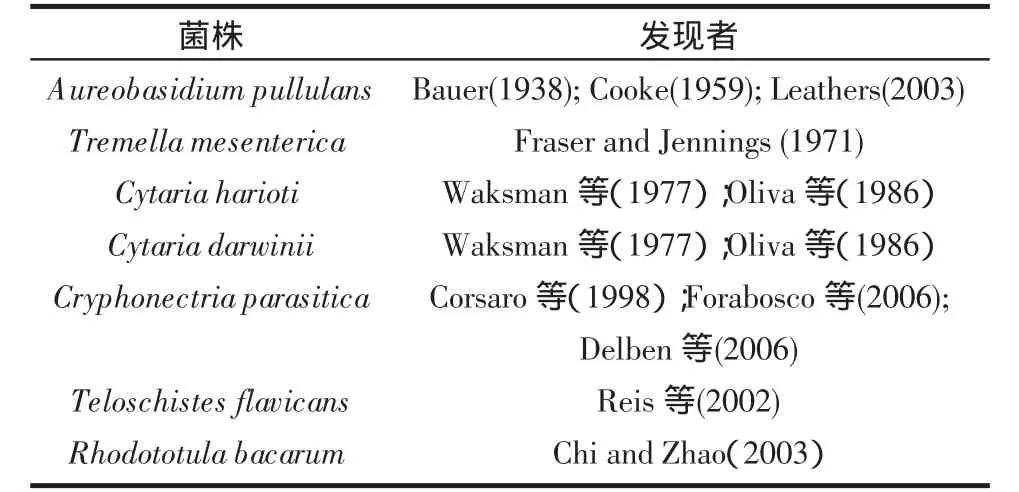
表 1 茁霉多糖主要生产菌株Table 1 Microbial sources of pullulan
茁霉多糖产生菌在腐生菌银耳肠膜菌Tremellamesenterica[7],寄生真菌Cytaria harioti和C.darwinii[8-9]和板栗枯萎病真菌、寄生藻类菌Cryphonectria parasitica[10]中(这是第1次报道寄生藻类菌生产茁霉多糖)也有分离。从子囊菌中分离到的多糖,类似于从出芽短梗霉肠膜菌素中分离到的多糖,其键1∶1的比例不同于众所周知的出芽短梗霉产生的茁霉多糖2∶1[11]。一个从中国植物叶片中分离得到的酵母菌—红酵母,报道称茁霉多糖产量高并且未产生黑色素[12]。那淑敏[13]从加拿大切峰虫茧上分离到菌株A22,其按照Hermanides-Nijhhof分类系统,与出芽短梗霉变种(A.pullulans Am.Var.pullulans)相似。Pollock等[14]从San Diego的一种植物树叶表面分离到一种出芽短梗霉菌株,能生产高分子量的茁霉多糖,同时色素产量大大降低。此外,S.Prasongsuk等[15]还对泰国土壤中的出芽短梗霉菌株进行研究,希望能获得低色素高产的茁霉多糖。S V N Vijayendra等[16]对出芽短梗霉CFR-77菌株进行研究,以5%椰子树汁制得的粗糖为唯一碳源,发酵过程中细胞始终呈酵母状并带有厚垣孢子,菌体不产生色素,发酵72 h产量达到51.9 g/L,此菌株发酵周期短,多糖产量高且黏性好。Hyung-Pil Seo等[17]对出芽短梗霉ATCC4202进行紫外诱变,得到诱变株出芽短梗霉HP-2001,该菌株发酵时无色素产生,所产的高分子量普鲁蓝多糖不会因糖浓度的升高而被分解。
3 培养条件
糖类如蔗糖、葡萄糖、果糖、麦芽糖、淀粉、低聚糖都可以作为出芽短梗霉的碳源,而木糖、阿拉伯糖、半乳糖、鼠李糖、乳糖,虽然使用的很少但也可以作为碳源,只是多糖的产量低。而丙三醇在有诱导葡萄糖存在的条件下也可以作为碳源,诱导作用会被放线菌酮抑制,这表明合成新蛋白质是一个必不可少的步骤。葡萄糖果糖或者能降解成这些糖的糖类都可以用作碳源。
Schuster等[18]以不产黑色素的出芽短梗霉突变株研究不同碳源(蔗糖、葡萄糖、果糖、木糖和乳糖等)对茁霉多糖产量的影响,发现不同的碳源间存在显著的差异,蔗糖为最佳碳源。Gniewosa等[19]比较了11种5%浓度的碳源对出芽短梗霉AP3合成茁霉多糖的影响,蔗糖为最佳碳源,发酵5 d茁霉多糖浓度最高,其次为麦芽糖、木糖、葡萄糖、甘露糖和果糖,以核糖、阿拉伯糖、半乳糖和淀粉为碳源时,茁霉多糖产量较低。Kato等[20]发现在20%麦芽糖的水解产物中,出芽短梗霉发酵的茁霉多糖的浓度比在葡萄糖浆中得到的高115%。其它的农业和食品工业的废弃物,如去蛋白乳清、甜菜糖浆、甜甘蔗汁、泥炭水解物、乙醇发酵废液葡萄皮浆都是生产茁霉多糖既经济又高效的底物。
碳源浓度对多糖生产也有影响,浓度太低会成为限制因素,浓度太高又会产生抑制作用。Le Duy[21]以甜菜糖浆为发酵底物,发现在糖浆起始浓度为50 g/L~100 g/L的范围内,随着糖浆浓度增加,茁霉多糖的浓度也逐渐增高,但如果进一步增加糖浆浓度,茁霉多糖浓度反而降低。这种下降可能是因为在发酵后期,菌丝产生1种内生葡糖糖化酶(又叫葡糖糖化酶B),它不仅可以降解淀粉,还可以降解茁霉多糖。
生物反应器的设计和氮源会影响茁霉多糖的生产,但不会影响出芽短梗霉的细胞形态,铵和复合氮源比用硝酸盐要好。Lee和Yoo[22]发现初始pH6.0时多糖产量最高。另据报道,pH4.5时最适合多糖生产,pH6.5最适合酵母状细胞的生长[23]。茁霉多糖生产的最适温度是24℃~30℃,不同菌株间有微小差异。Bender[24]报道称VB1可以增加多糖的产量。生物素、氯化铁、氯化锰和氯化锌也可以增加多糖的产量[25-26]。
出芽短梗霉是需氧发酵的,通气量对多糖产量有重要的影响。在无氧条件下发酵,细胞既不生长也不分泌多糖,而大量通气则可以显著提高多糖的浓度。这种影响在富含氮的介质中很明显,而在缺氮源的介质中,大量通气,会抑制茁霉多糖的生成[27]。Audet等[28]认为在营养均衡的介质中,虽然提高溶解氧的浓度,产率也随之增高,但是大量通气时应当谨慎,因为通气过大,分子质量会降低。Dufresne等[29]发现茁霉多糖产量与氧气的分压关系很复杂:随着氧气分压的增加,茁霉多糖产量升高,但是增到一定值后会迅速降低。Dufresne在试验中还发现通过增大气体分压使氧气利用率增大,可以改进出芽短梗霉生产多糖的活性,高的气流量和大的工作压有益于细胞本体的生长和茁霉多糖的生成。
搅拌速度过高和过低都会降低多糖的产量。Lazaridou[30]发现在搅拌速度为300 r/min~700 r/min范围内,茁霉多糖的浓度有明显增高,在700 r/min时多糖浓度达到最大值,此后,再增加搅拌速度,多糖浓度反而下降。Simon[31]发现在搅拌速度450 r/min,通气量小于175 L/h时,茁霉多糖的产量最高;而Gibbs和Seviour[32]也发现搅拌速度过大如750r/min,茁霉多糖的浓度会下降。
Miure等以蔗糖为底物研究发现,如果在发酵体系中加入淀粉酶抑制剂,可以抑制后期酶对茁霉多糖的分解,并且得到的茁霉多糖分子量较大。为解决常规发酵生产茁霉多糖伴随的一些问题,避免氧限制,形态转变及形成色素等难题,Schabtai等[33]建立了双相发酵工艺,这种发酵工艺较单底物发酵时间短,产量高,可以用酵母状真菌出芽短梗霉生产无色素的茁霉多糖。
许多学者研究了分批发酵、补料分批发酵、连续发酵。近年来许多学者开始研究固定发酵的方法。Urkut等[34]对P56菌株用合成的培养基在海藻酸钙凝胶球中固定化发酵,结果表明这种方法适合分批发酵和连续发酵。
响应面分析法(RSM)是一种新的较好的方法。许多学者用此方法来优化茁霉多糖的生产条件。Goksungur等用响应面分析法对P56菌株游离细胞在搅拌釜反应器中进行了试验,考察了糖浓度、搅动速度、通气量3个因素。Thibault等通过摇瓶试验调查了菌株、碳源、氮源、氮浓度、通气量、初始pH 6个因素对茁霉多糖产量的影响,分析主要因素的影响及因素之间的相互作用,并且用经验模型优化了6个因素。Urkut等[34]用响应面分析法对固定化分批发酵和连续发酵进行研究,分析初始pH,搅动速率、培养时间3个参数,在试验中海藻酸钙凝胶球固定化菌种在重复发酵中用了6轮,没有出现活力的明显损失。
4 结论与展望
与发达国家相比我国的茁霉多糖研究非常落后,1976年~1980年是第1个研究高峰,主要针对其性质和发酵方法的研究。1984年~1996年是第2个研究高峰,主要集中在对其产生机理和应用研究。日本2009年产量已超万t,从20世纪70年代中期开始生产到现在,日本(主要是日本某一个公司)仍然垄断国际市场。我国国内学者现在主要在研究菌株的筛选,而培养基的优化方面,需要进一步深入研究。
另外,我们在筛选高产菌株和不产黑色素菌株的同时,可以开拓一下思路,可以利用黑色素,据报道天然黑色素不仅可以用于食用色素添加剂,在化妆品、染发剂的装饰、防紫外辐射、清除自由基以及生物杀虫剂的光保护等方面应用也比较广泛。目前市场上红色素、黄色素比较多,天然黑色素还较为罕见。许多研究者一直对出芽短梗霉发酵过程中的黑色素作为杂质去除,忽视了黑色素可作为一种天然色素加以开发和应用。有学者还发现,在用出芽短梗霉生产多糖时,不仅可以利用工业废弃物作为底物,还可以用一些已知结构的葡萄糖类似物如3-甲氧基-葡萄糖,D-葡萄糖胺和N-乙酰-D-葡萄糖胺作为底物,一些菌株可以单一的生成含葡聚糖和甘露聚糖。
总之,这方面的研究具有很大的开发潜力和经济价值,深入研究,充分利用好,使之产业化,对于我们这样一个有着丰富资源的农业大国来说有着重要的意义。
[1]Catley B J.The rate of elaboration of the extracellular polysaccharide pullulan during growth of Pullularia pullulans[J].Journal of general microbiology,1973(8):33-38
[2]Catley B J.Role of pH and nitrogen limitation in the elaboration of the extracellular polysaccharide pullulan by Pullularia pullulans[J].Applied Microbiology,1971(2):650-654
[3]Rho D.Oxygen requirement in pullulan fermentation[J].Applied microbiology and biotechnology,1988(8):361-366
[4]Simon.Relation between pullulan production,morphological state and growth conditions in Aureobasidium pullulans:New observations[J].Journal of general microbiology,1993(9):979-985
[5]Simon.Studies on pullulan extracellular production and glycogen intracellular content in Aureobasidium pullulans[J].Canadian journal of microbiology,1998,44(12):1193-1199
[6]Catley B J.Lipid-linked saccharides formed during pullulan biosynthesis in Aureobasidium pullulans[J].Carbohydr Res,1982(10):65-75
[7]Fraser C.A glucan from Tremella mesenterica NRRL-Y6158[J].Canadian journal of chemistry,1971(9):1804-1807
[8]Waksman N.The structure of an α-D-glucan from Cyttaria harioti Fischer[J].Carbohydrate research,1977(9):505-515
[9]Oliva E M.Characterization of a pullulan in Cyttaria darwinii[J].Carbohydrate research,1986(8):262-267
[10]Corsaro M M.Phytotoxic extracellular polysaccharide fractions from Cryphonectria parasitica(Murr)Barr strains[J].Carbohydrate Polymers,1998(7):167-172
[11]Reis R A.A newpullulan and α branched(1-3),(1-6)-linked βglucan from thelichenised ascomycete Teloschistes flavicans[J].FEMS microbiology letters,2002(2):1-5
[12]Chi Z.Optimization of medium and new cultivation conditions for pullulan production by a new pullulan-producing yeaststrain[J].Enzyme and microbial technology,2003(5):206-211
[13]Na S M.Screening and product analysis of bacterial strain producing expolysaccharides[J].Food and fermentation indus,1989(4):7-9
[14]Pollock T J.Isolation of new Aureobasidiumstrains that produce high molecular weight pullulan with reduced pigmentation[J].Appl environ microbiol,1992(5):877-773
[15]Prasongsuk S.Thailand habit at sources of pullulan-producing strains of Aureobasidium pullulans[J].World microbiol biotech,2005(11):393-398
[16]Devendra.Jaggery:a novel substrate for pullulan production by Aureobasidium pullulans CFR-77[J].Process biochemistry,2001(6):359-364
[17]Hyung Pil Seo.Production of high molecular weight pullulan by Aureobasidium pullulansHP-2001with soybeanpomace as a nitrogen source[J].Bioresource technology,2004(9):293-299
[18]Schusster R.Production of the fungal exopolysaccharide pullulan by batchwise and continuous fermentation[J].Appl microbiol biotech,1993(9):155-158
[19]Gniewosa M.Effect of saccharide on pullulan synthesis by Aureobasidium pullulans[J].Polish Food Nutr Sci,1992(1):37-43
[20]Kato K.Method of producing pullulan[P].US Patent,1974
[21]Le Duy AA.Pullulan production from peat hydralyzate[J].Canada Microbiol,1983(4):143-146.
[22]Lee K Y.Optimization of pH for high molecularweight pullulan[J].Biotechnology letters,1993(15):1021-1024
[23]Madi N S.Influence of culture pH and aeration on ethanol production and pullulan molecular weight by Aureobasidium pullulans[J].Journal of chemical technology and biotechnology,1996(11):343-350
[24]Bender H.Pullulan,an extracellularglucan from Pullularia pullulans[J].Biochimica et Biophysica Acta,1959(5):309-316
[25]West T P.Influence of vitamins and mineral salts upon pullulan synthesis of Aureobasi dium pullulans[J].Microbios,1992(7):115-123
[26]West T P.Effect of manganese on polysaccharide production and cellular pigmentation in the fungus Aureobasidium pullulans[J].Worldjournal-of microbiology and biotechnology,1997,13(2):233-235
[27]Taguchi R.Synthesis of pullulan by acetone-dried cells and cell-free enzyme from Pullularia pullulans and the participation of lipid intermediate[J].Agric Biol chem,1973(9):1635-1641
[28]Audet J.Pullulan fermentation in a reciprocating plate bioreactor[J].Bioproc Eng,1996(7):209-215
[29]Dufresne R.The influence of pressure on the growth of Aureobasidium pullulans and the synthesis of pullulan[J].Appl microbiol biotechnol,1990(6):526-532
[30]Le Duy A A.Pullulan production from peat hydralyzate[J].Canada Microbiol,1983(11):143-146
[31]Simon L.Pullulan elaboration and differentiation of the resting forms in Aureobasidium pullulans[J].Canada Microbiol,1995(8):35-45
[32]Gibbs P A.Does the agitation rate and/or oxygen saturation influence exopolysaccharide production by Aureobasidium pullulans in batch culture[J].Appl Microbiol Biotechnol,1996(6):503-510
[33]Shabtai Y.Enhanced production of pigment-free pullulan by a morphogenetically arrested Aureobasidium pullulans(ATCC42023)in a two-stage fermentation with shift from soybean oil to sucrose[J].Appl Microb Biotechnol,1995(9):595-603
[34]Urkut Z.Optimization of pullulan production using Caalginate immobilized Aureobasidium pullulans by response surface methodology[J].Journalofchemicaltechnologyandbiotechnology,2007(10):837-846
Research Progress of Upstream Processing of Pullulan Abroad
SU An-xiang,FENG Yin,LIU Jie,WANG Yu-hua*
(School of Food Science and Engineering,Jilin Agriculture University,Changchun 130118,Jilin,China)
Pullulan,a neutral water-soluble extracellular polysaccharide,is obtained by fermentation using a fungus,Aureobasidium pullulans.Pullulan was widely used in food industrial,pharmaceutical industrial and other commercial and industrial areas.It was a promising polysaccharide.But mass production is also small,for two main reasons,one is low yield and the other is difficult to remove the polysaccharide pigment.The latest advances on the study of the microbial sources,synthesis mechanism and culture conditions were reviewed.Its industrial applications and current research focus were discussed.
pullulan;microbial sources;synthesis mechanism;culture conditions
吉林省科技厅科技支撑计划(20080251)
苏安祥(1984—),男(汉),在读硕士研究生,研究方向:食品微生物与功能性食品。
*通信作者:王玉华(1972—),女(汉),副教授,博士,研究方向:食品微生物与功能性食品。
2011-07-01
