酸解玉米芯制备木糖及其提纯工艺的研究
2012-12-04郭仁杰孙婉赵灵希熊海容
郭仁杰,孙婉,赵灵希,熊海容
(中南民族大学生命科学学院,湖北 武汉 430074)
酸解玉米芯制备木糖及其提纯工艺的研究
郭仁杰,孙婉,赵灵希,熊海容*
(中南民族大学生命科学学院,湖北 武汉 430074)
探讨玉米芯的酸解工艺及木糖的纯化过程。玉米芯经1%NaOH 60℃预处理24 h后,最优酸解条件为硫酸浓度1.5%,料水比1∶13(g/mL),反应时间3 h。溶液经活性炭脱色和树脂去离子,由酿酒酵母As2.541去除木糖母液中的葡萄糖,纯化后的糖液经薄层层析(TLC)鉴定其单糖种类,3-5二硝基水杨酸法(DNS)测定还原糖总量,高效液相法(HPLC)做糖液的定量分析,最后将糖液浓缩醇沉,制备木糖结晶率为1.5%,纯度为90%。
玉米芯;木糖;酸解;纯化
木糖为白色细针状结晶或结晶性粉末。它常被用作无热量的甜味剂,以满足糖尿病患者和爱吃甜食却又担心发胖者的需求。木糖不会被口腔内的细菌利用,可以防龋齿。除此之外,木糖还具备膳食纤维的部分生理功能,有降血脂、降低糖固醇及预防肠癌等作用[1]。
自然界中的木糖通常以大分子的木聚糖形式广泛存在于植物半纤维素中,目前,工业上通常采用酸解法制备木糖。在各种原料中,玉米芯的多缩戊糖含量最高,而且在我国,玉米芯来源广泛、产量大、易集中。所以,综合各种因素利用玉米芯酸解法制备木糖有显著的社会效益和经济价值[2-4]。
玉米芯水解的过程中会有多种杂质产生,去除杂质,不但可以加快水解的反应速率,同时可以纯化木糖结晶[2]。
酿酒酵母属于兼性厌氧菌,在有氧的情况下,它把葡萄糖分解成二氧化碳和水;在缺氧的情况下,酿酒酵母把葡萄糖分解成酒精和二氧化碳。酿酒酵母代谢过程消耗葡萄糖,但不利用木糖。而玉米芯酸解的木糖母液中,含有少量葡萄糖。利用酿酒酵母的特性,通过酵母发酵法,消耗掉木糖母液中的葡萄糖,可以提高木糖的纯度[5]。
TLC法是快速分离和定性分析少量物质的一种实验技术,利用不同的糖其分子量、羟基数目及其醛基、酮基性质存在的差异,可以将不同种类的糖分离开来。DNS法可用于检测木糖母液中总还原糖含量。HPLC是一种快速准确的含量测定方法,根据不同糖的保留时间、峰面积等,可准确测得木糖母液中各组分糖的含量,是目前普遍应用的检测方法之一。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与主要试剂
酿酒酵母Saccharomyces cerevisiae As2.541:从湖北工业大学生物工程学院张华山教授实验室获得;玉米芯粉:购于湖北武汉,去杂后烘干粉碎,过80目筛,粉末备用。
YPD液体培养基:葡萄糖2 g,酵母浸粉1 g,蛋白胨2 g,H2O 100 mL。
3-5二硝基水杨酸(DNS):6.3 g DNS,加262 mL 2 mol/LNaOH,加入500 mL含有182 g酒石酸钾钠热水溶液再加入5 g重蒸酚和5 g亚硫酸钠,搅拌溶解,冷却后加水定容至1 L,避光备用[4]。
甲基红和亚甲基蓝混合指示剂:将甲基红乙醇溶液(1 g/L)与亚甲基蓝乙醇溶液(1 g/L)按2∶1的体积比混合。
HPLC所用乙腈为sigma色谱纯,水为去离子水,其余药品均为国药准字分析纯。
1.1.2 仪器
高效液相色谱仪:日本岛津;真空冷冻干燥机:北京博医康;AVANTI J-E高速离心机:BECK MAN COULTER;卧式灭菌器:上海华线医用核子;PGF-4AB型立式电热鼓风干燥箱:天津市泰斯特;752型紫外可见分光光度计:上海光谱仪器,等。
1.2 方法
1.2.1 玉米芯预处理
玉米芯中含有的少量蛋白质,在木糖制备过程中会影响木糖的产率,使用2种方法对玉米芯进行预处理,在清洗原材料的同时,可以降低蛋白质的含量,再检测处理后玉米芯中蛋白的含量变化,选择蛋白含量低的作为玉米芯的预处理方法。
取玉米芯粉2 g,加硫酸钾6 g,硫酸铜0.2 g,浓硫酸20 mL于500 mL定氮瓶中,瓶口加漏斗,倾斜置于电炉上,微火加热约4 h,待溶液呈蓝绿色且完全澄清后,再加热1 h,加热后的溶液冷却至室温,移至100 mL容量瓶中定容,用0.05 mol/L盐酸标准液滴定,甲基红和亚甲基蓝混合指示剂检测,同时做试剂空白试验[6]。
1)向玉米芯粉中加入蒸馏水[料水比1∶15(g/mL)],搅拌均匀,100℃煮沸30 min,纱布过滤,烘干,取2 g,同上,凯氏定氮法检测其蛋白质含量。
2)向玉米芯粉中加入1%NaOH[料水比1∶15(g/mL)]60℃水浴24 h,纱布过滤,蒸馏水洗至中性,烘干,取2 g,同上,凯氏定氮法检测其蛋白质含量。
1.2.2 优化玉米芯酸解条件[7-8]
1.2.2.1 标准曲线的测定
精确称取20 mg木糖到100 mL容量瓶中,充分溶解后定容至100 mL,制成木糖标准溶液。取8支干净具塞试管,分别从1至8标记,管中依次加入木糖标准液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL,相应加水2、1.8、1.6、1.4、1.2、1、0.8、0.6 mL。再加入3 mL DNS,混匀后煮沸5 min。冷却至室温,以1号试管为参比,测定在540 nm时各试管中溶液吸光度。以木糖为X(mL)轴,对吸光度Y作图,得出木糖与吸光值之间关联的标准曲线[2-3]。
1.2.2.2 最适料水比的测定
取玉米芯40 g,将玉米芯粉与1.5%的稀硫酸按1∶7,1∶9,1∶11,1∶13,1∶15比例(g/mL),加到锥形瓶中,121℃,处理3 h。冷却至室温,抽滤,取上清液,碳酸钙中和后,再抽滤,活性炭脱色,DNS法检测还原糖含量,每个样品做3个平行。
1.2.2.3 最适反应时间的测定
取40g玉米芯粉,加入1.5%的稀硫酸520mL,121℃,分别加热2、3、4、5 h。冷却至室温,抽滤,取上清液,碳酸钙中和后,再抽滤,活性炭脱色,DNS法检测还原糖含量[9],每个样品做3个平行。
1.2.2.4 最适硫酸浓度的测定
取玉米芯40 g,分别加1.5%、2.0%、3.0%、4.0%硫酸520 mL,121 ℃,加热3 h,冷却至室温,抽滤,取上清液,碳酸钙中和后,再抽滤,活性炭脱色,DNS法检测还原糖含量,每个样品做3个平行。
1.2.3 木糖母液的脱色及离子交换
1.2.3.1 活性炭脱色
在中和后的玉米芯酸解液中加入活性炭适量,加好后搅拌混匀,将混合液加热至80℃,真空抽滤[10]。
1.2.3.2 离子交换树脂对离子的去除
在玉米芯酸解的制备过程中,有部分离子杂质残留,离子交换树脂可以去除木糖母液中部分离子。采用001×12(强酸性苯乙烯树脂磺酸钠阳离子交换树脂)为阳离子树脂,AH-1(三聚氰胺-胍-甲醛树脂缩合弱碱性阴离子交换树脂)为阴离子树脂。去离子水膨胀24 h后,再水洗呈中性,分别装入100 mL层析柱,再生(阳柱用100 mL,2.5%H2SO4冲洗2 h,阴离子柱用100 mL,4.5%Na2CO3冲洗2 h),用恒流泵控制流速稳定,再生完成后将树脂水洗至中性,将活性炭脱色后的木糖母液与树脂进行置换反应,先过阳柱再过阴柱,控制木糖母液通过树脂柱流速为1 mL/min。用氯化钡,草酸,亚铁氰化钾做指示剂检测过柱前后溶液中Ca2+,Fe3+,SO42-离子含量的变化[2,11]。
1.2.4 木糖母液分析方法的比较
1.1.4.1 DNS法检测样品中还原糖含量[12]
先将样品做梯度稀释,选择样品最佳稀释倍数。取1 mL稀释后样品,加入1 mL水,3 mL DNS,混匀后沸水中加热5 min,冷却至室温,测波长为540 nm时的吸光度。取2 mL水,加3 mL DNS同上操作,作为参比。
1.2.4.2 TLC法检测样品中单糖的种类[13]
配制葡萄糖,木糖,蔗糖标准品溶液1 mL,浓度为10 mg/mL,取制备好的木糖母液1 mL,备用。
将G254硅胶板置于烘箱中烘干,备用。配制显色剂为苯胺(2 mL)-二苯胺(2 g)-磷酸(10 mL,85%)-浓盐酸(1 mL)-丙酮(100 mL);展开剂为正丁醇∶乙酸∶水=4∶1∶5(体积比)。将糖液标准品和木糖母液用毛细管点样2 μL于硅胶板上,放入展缸中,待展开剂前沿距板顶1 cm时取出,烘干,再用喷雾器将显色剂均匀喷于板上,烘干后,显色。
1.2.4.3 HPLC对样品的检测
色谱条件的确定:色谱柱为Agilent ZORBAX Carbohydrate 4.6×250 mm 5Micron,检测器为示差检测器,流动相为乙腈∶水=65∶35(体积比),流速设定为1 mL/min,柱温20℃。乙腈为色谱纯,水为去离子水。
木糖,葡萄糖标准曲线的制备:将木糖,葡萄糖分别配置成100 mg/mL的标准品溶液,在分别稀释成浓度1、10、20、30、40 mg/mL的木糖,葡萄糖标准溶液,每种浓度的标准品溶液取20 μL进样检测,以糖浓度为X轴,峰面积为Y轴,作标准曲线。
木糖母液检测:木糖母液10000 r,离心5 min,取上清,用0.22μm的水系滤膜过滤,滤液在同上的色谱条件下,取20 μL,进样检测,记录保留时间和峰面积。
1.2.5 酿酒酵母去除葡萄糖[14-15]
酿酒酵母的扩大培养:制备YPD液体培养基400mL,灭菌后,在无菌操作台上将酿酒酵母接入YPD液体培养基,28℃,摇床培养3 d。
1.2.5.1 酿酒酵母对标准品混合液中葡萄糖的消耗
精确称取木糖4 g,葡萄糖2 g,与100 mL容量瓶中,加水混匀后,定溶至刻度。为葡萄糖,木糖标准品的混合溶液,葡萄糖浓度2%,木糖浓度4%。再将活化好的酿酒酵母,加入离心管,12000 r,离心10 min,取酿酒酵母沉淀2 g,加入葡萄糖和木糖的标准品混合液100 mL,28℃,分别培养1、6、12、24 h,每时间段取混合液10 mL,高效液相检测溶液中各种糖含量的变化。
1.2.5.2 酿酒酵母对木糖母液中葡萄糖的消耗
取木糖母液100 mL,同上将酵母离心后,加酿酒酵母沉淀1 g,28 ℃,分别培养1、2、3 h,每时间段取混合液10 mL,高效液相检测溶液中各种糖含量变化。
1.2.6 木糖的结晶制备[16]
将处理后的木糖母液置于烘箱中,70℃制备成浓缩糖液,0.22μm滤膜抽滤,滤液按1∶10(体积比)的比例加入乙醇,静置沉淀,再次抽滤,沉淀物冷冻干燥。将冷冻干燥后的木糖溶水,重结晶[17]。晶体烘干至恒重,取样品配制成20 mg/mL的溶液,高效液相法检测其峰面积,通过标准品的线性方程,算得木糖结晶的纯度。
2 结果与讨论
2.1 玉米芯预处理
用蒸馏水、碱对玉米芯预处理后,玉米芯中蛋白质含量的变化,见表1。

表 1 玉米芯中蛋白质含量Table 1 Protein content of corncob %
在酸水解条件下,蛋白质通常会发生水解生成氨基酸。这些游离氨基酸将会与酸解玉米芯后产生的单糖发生颜色反应,导致单糖产量的降低并增加了木糖提纯的困难程度。为了避免蛋白质对后续工艺的影响,探讨了不同的预处理方法,在玉米芯粉中加入蒸馏水,100℃下处理30 min。或将玉米芯粉用稀NaOH溶液60℃下处理24 h。预处理完成后,检测并比较2种方法对蛋白去除的影响。
由表1可知,玉米芯中原蛋白质的含量为2.255%,蒸馏水处理以后,蛋白质含量有所下降,但蛋白去除效果不明显,相比之下用NaOH处理后,玉米芯中的蛋白质含量降至0.988%,所以,碱处理作为玉米芯预处理的较好方法。
2.2 玉米芯酸解条件的优化
用DNS法检测,以木糖浓度为X轴(mL),吸光度为Y轴,得线性回归方程 y=0.7907x-0.3175(R2=0.9995)。在不同玉米芯与硫酸的料水比、反应时间、硫酸浓度条件下,观察还原糖产量的变化,见图1。注:A为料水比与还原糖产量间的关系;B为加热时间与还原糖产量间的关系;C为酸浓度与还原糖产量间的关系。

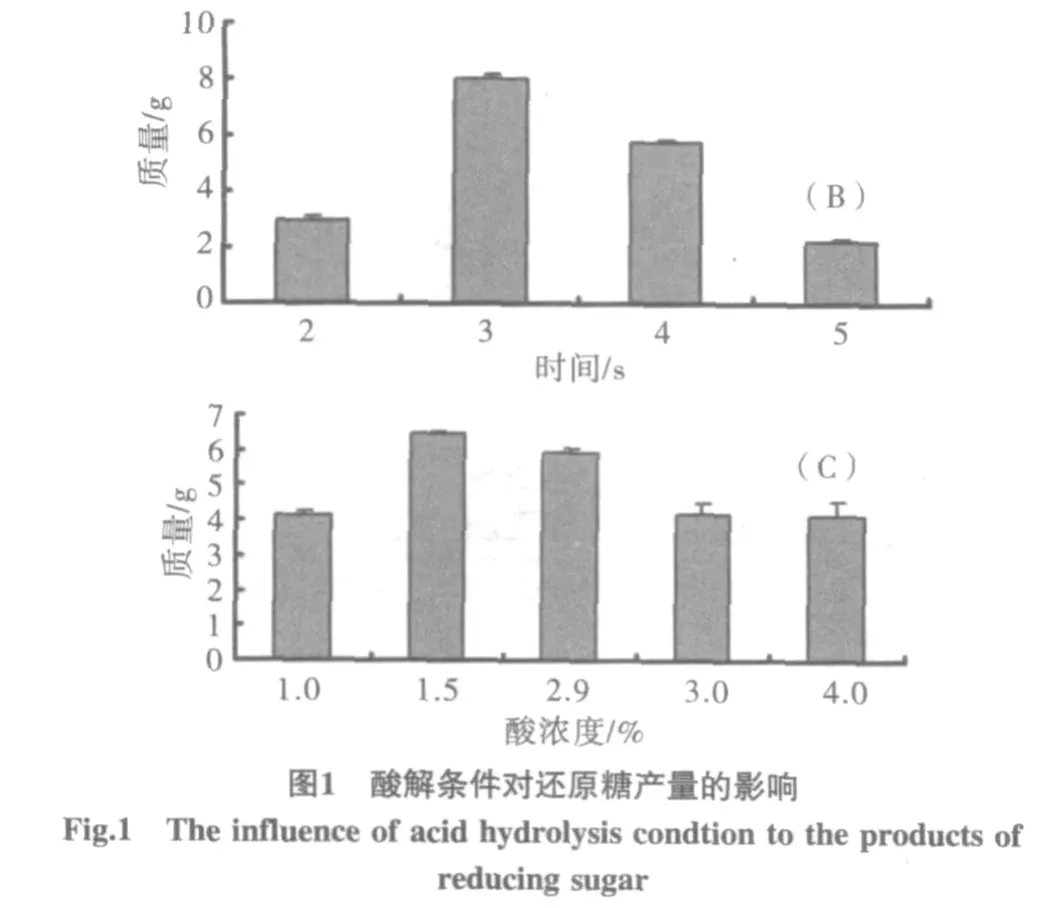
玉米芯中含有的多聚戊糖,在硫酸的作用下可降解得到木糖溶液,而木糖的产率与加热时间,酸浓度及玉米芯与硫酸的料水比都呈一定的线性关系。由图1的结果可得出,随着反应条件改变,木糖的产率起初随之增加,在反应时间3h,硫酸浓度1.5%,料水比1∶13(g/mL)时,木糖产率为最高。而随后产率所出现的回落,可能是由于玉米芯酸解时间的加长,硫酸浓度和体积的增加,使木糖在高温下与溶液中的杂质发生反应,从而降低了木糖的产率。
2.3 木糖母液的脱色及离子交换
活性炭脱色:选用分析纯活性炭脱色,每100 mL木糖母液加入活性炭约5 g,80℃下活性炭将样品由深褐色脱为无色,效果显著。
离子交换树脂去离子:选择001×12阳离子树脂去除Ca2+、Fe3+,AH-1阴离子树脂去除SO42-。木糖母液过柱前,分别加草酸、氯化钡结果均有沉淀生成,加入亚铁氰化钾后有浅蓝色沉淀生成。过柱后,加入草酸无沉淀生成,表明溶液中Ca2+已去除,加入氯化钡无沉淀生成,表明溶液中不含SO42-,加入亚铁氰化钾后无沉淀,表明Fe3+被去除。检测结果显示100 mL阳离子柱对于木糖母液的工作容量为60 mL,100 mL阴离子柱对木糖母液工作容量为45 mL。
2.4 木糖产率的分析方法比较
2.4.1 DNS检测
经试验证明,用DNS检测木糖母液中还原糖含量,100倍为最佳稀释倍数,稀释后的木糖母液在540 nm处吸光度为0.745,代入DNS法木糖的线性方程得母液中还原糖浓度为26.87 mg/mL。
2.4.2 TLC检测
木糖母液和标准糖的薄层层析图谱见图2。
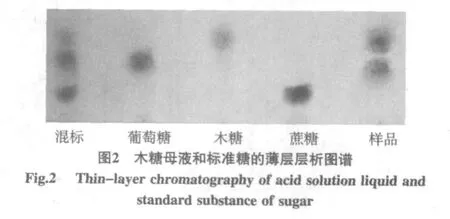
由图2可知,使用苯胺(2 mL)-二苯胺(2 g)-磷酸(10 mL,85%)-浓盐酸(1 mL)-丙酮(100 mL)为显色剂后,葡萄糖显浅蓝色,木糖显黄色,蔗糖显深蓝色,样品经展开剂正丁醇∶乙酸∶水=4∶1∶5(体积比)展开分为2层,且上层为黄色,下层为浅蓝色,再结合标准品和样品在硅胶板上的分离距离,可以确定木糖母液中所含的糖为葡萄糖和木糖。
2.4.3 HPLC检测[8]
在最佳反应条件下酸解玉米芯,木糖母液经HPLC检测后各组分及含量见图4(A),图4(A)中木糖峰面积为2530393.9,葡萄糖的峰面积为758528.9,代入木糖和葡萄糖的线性方程得到,木糖母液中木糖浓度为20.34 mg/mL,葡萄糖浓度为5.69 mg/mL。
综合3种检测方法结果可知,薄层层析可以快速方便的检测出样品中所含糖的种类,但不能准确的检测出各种糖的含量,所以只能对样品做定性的分析。DNS法是利用还原糖对特定波长光的吸收来测定样品的含糖量,但样品中还原糖除了木糖还有葡萄糖,所以检测结果会比木糖母液中木糖的实际含量要多。高效液相是比较常用也是最为精确的检测样品的方法,根据出峰时间和峰面积的大小可以准确的得到样品中糖的种类及各种糖的含量。
2.5 酿酒酵母去除葡萄糖
2.5.1 酿酒酵母对混合液标准品中葡萄糖的消耗
由于木糖和葡萄糖的物理、化学性质相近,采用一般方法从木糖葡萄糖混合物中分离获得木糖的大生产工艺操作难度较大。相比之下,利用一些只代谢葡萄糖不代谢木糖的特定微生物预先消耗掉葡萄糖,不但去除效果明显,而且操作简便,适用于工业生产。将酿酒酵母加入木糖和葡萄糖标准品混合液后,标准品中2种糖含量的变化见图3。
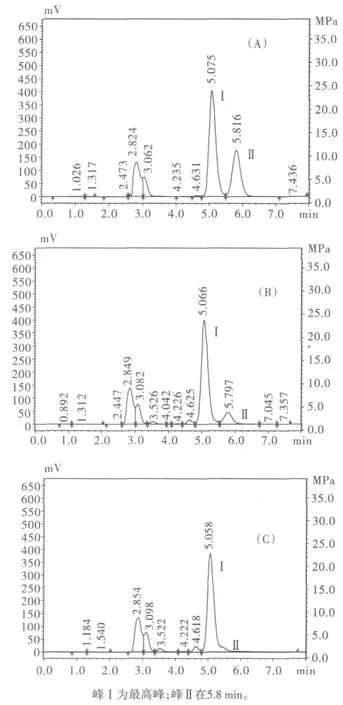
图3 酿酒酵母对木糖葡萄糖标准品混合物中葡萄糖的消耗Fig.3 Glucose consumption in the mixture of standard xyloseand glucose
由图3的实验结果可得出,木糖保留时间约为5.0min,葡萄糖的保留时间约为5.8 min。当标准糖液中葡萄糖的浓度为20 mg/mL,体积100 mL时,2 g酿酒酵母在12 h内可以将标准液中的2 g葡萄糖完全消耗,同时不影响标准液中木糖的含量。
2.5.2 酿酒酵母对样品中葡萄糖的消耗
将酿酒酵母加入木糖母液后,随着代谢时间的增加,木糖母液中葡萄糖,木糖含量的变化见图4。

图4 酿酒酵母对样品中葡萄糖的消耗趋势Fig.4 The consumption trend of glucose in sample bySaccharomyces cerevisiae
由图4的实验结果可看出,当木糖母液中葡萄糖含量约为5 mg/mL时,每100 mL母液,加酿酒酵母1 g,3 h后溶液中葡萄糖消耗完全,且木糖无损失。说明活化后的酿酒酵母在不消耗木糖的情况下,可有效去除木糖母液中的葡萄糖,提高木糖纯度。
2.6 木糖结晶的制备
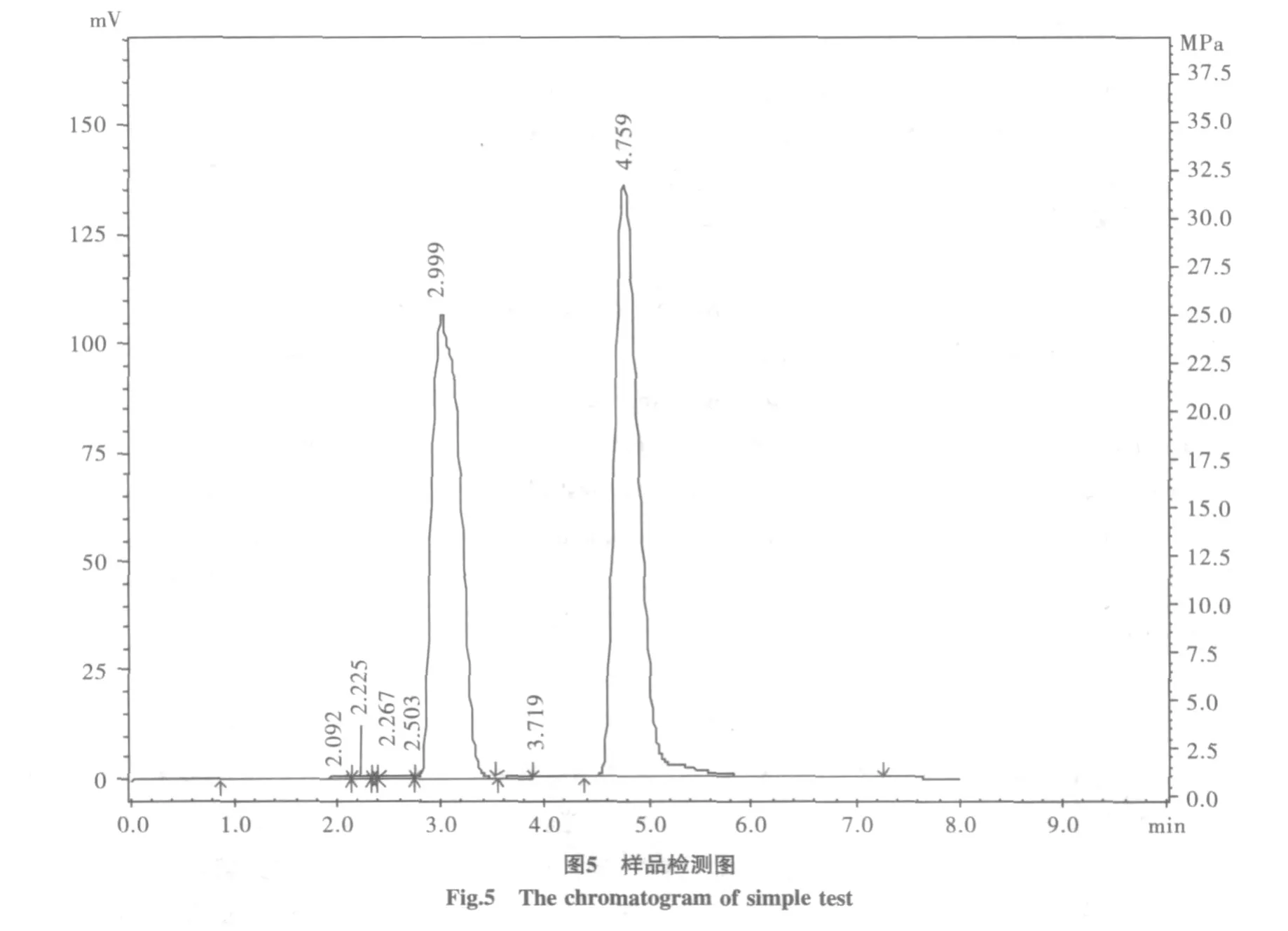
糖液浓缩过程会有少量杂质析出,木糖常温下不溶于乙醇,用乙醇冲洗结晶,可以将某些溶于乙醇的有机杂质去除,最终制备的木糖结晶产率为每100克玉米芯粉产木糖1.5 g。高效液相检测,结晶溶解为20 mg/mL的木糖溶液,峰面积为2263928.0,结晶纯度90%(图5)。
3 结论
根据以上研究结果表明,碱处理玉米芯,可将玉米芯中的蛋白含量降至0.988%,玉米芯最佳酸解条件为1.5%硫酸,作用时间3 h,料水比1∶13(g/mL),在最适反应条件下木糖母液经高效液相检测,木糖含量为20.34 mg/mL,葡萄糖含量为5.69 mg/mL。活性炭可将木糖母液由褐色褪为无色,离子交换树脂001×12,AH-1能有效去除母液中的部分离子。1 g酿酒酵母3 h内可将100 mL木糖母液中葡萄糖完全去除。最佳工艺条件下,100 g玉米芯产木糖结晶1.5 g,纯度为90%。
[1]李士雨,李响,齐向娟,等.乙醇溶析结晶法由棉籽壳制备木糖[J].化工学报 ,2006,61(6):1483-1485
[2]尤新,李明杰.木糖与木糖醇的生产技术及其应用[M].北京:中国轻工业出版社,2006:56-78
[3]孟昭宁.玉米芯生产木糖的工艺技术[J].杭州食品科技,2009(2):30-31
[4]农旭华,张继泰,王玉瑛,等.嗜热真菌DSM10635生产耐热木聚糖酶的小试研究[J].工业微生物,2009,39(3):62-66
[5]陈玉梅.酿酒酵母工程菌研究的进展[J].生物工程进展,1998,13(1):11-16
[6]高凤岭.食品中蛋白质的测定原理及操作中的注意事项[J].应用技术,2007,6:74
[7]李雪雁,王丹,胡朝霞,等.玉米芯酸法提取木糖的工艺改进[J],食品工业科技,2009,30(6):263-264
[8]Elina Sjöman,Mika M覿nttöri,Marianne Nyström,et al.Separation ofxylose from glucose by nanofiltration from concentrated monosaccharide solutions[J].Journal of membrane science,2007,292(1):106-115
[9]毛忠贵,朱利丹,邓绍荣.用薄层层析法分析海藻糖[J].无锡轻工业大学报,1997,16(4):42-44
[10]蒋琦霞,杨瑞金,孙中国,等.低聚木糖液脱色工艺研究[J],食品工业科技,2008,29(3):229-230
[11]王立东,唐伟,隋明,等.利用树脂D392进行低聚木糖提取液脱色的研究[J].粮油食品科技,2010,18(3):36-39
[12]张永勤,王哲平,宋雨梅,等.还原糖测定方法的比较研究[J].食品工业科技,2010,31(6):321-323
[13]王文岭,黄雪松.DNS法测定木糖含量时最佳测定波长的选择[J].食品科学,2006,27(4):196-197
[14]王秀娟,王成福,秦庆阳,等.酵母发酵法去除木糖母液中葡萄糖[J].食品研究与开发,2010,31(3):154-156
[15]刘建伟,刘志华,刘智勇.HPLC法测定木糖母液的组成[J].安徽农业科学,2009,37(5):1881-1882
[16]Gabas N,Garillon T,Hiquily N.Solubilities of d-xylose and dmanmose in water-ethanol mixtures at 25℃[J].Journal of chemical and engineering data,1988,33(2):128-130
[17]Gabas N,laguerie c.Batch crystallization of d-xylose by programmed cooling or by programmed adding of ethanol[J].Chemical engineering science,1992,47(12):3148-3152
Study on Production and Purfication of Xylose from Corncob by Acid Hydrolysis
GUO Ren-jie,SUN Wan,ZHAO Ling-xi,XIONG Hai-rong*
(College of Life Science,South Central University for Nationalities,Wuhan 430074,Hubei,China)
This research was to explore the acid hydrolysis process of corn cob to produce xylose and its purification procedure.After the corn cob was pretreated by 1%NaOH at 60 ℃ for 24 h,the optimal acid solution is to use sulfuric acid concentration at 1.5%for 3 h reaction with the feed/water ratio of 1∶13(g/mL).After decoloration by activated carbon and desalination by resin,the glucose in hydrolysis solution was then removed by Saccharomyces cerevisiae stain As 2.541 consumption.The result of thin layer chromatography(TLC)assay showed the monosaccharide type in the purified sugar solution was mainly xylose.The total reduction sugar content was monitored and quantified by 3,5-dinitrosalicylic acid (DNS)method and high performance liquid chromatography(HPLC).In the end,the sugar was concentrated by alcohol precipitation.In this research,the crystallization rate and purity of the xylose prepared was reached to 1.5%and 90% ,respectively.
corn-cob;xylose;acidolysis;purification
武汉市重点科技攻关计划项目(201060623267)
郭仁杰(1985—),女(汉),硕士研究生,研究方向:酶工程。
*通信作者:熊海容(1966—),男,博士,教授。
2011-07-04
