TiC/Ti复合泡沫材料对细胞增殖和分化的影响
2012-12-03刘笑涵吴琳张劲松高勇钟鸣
刘笑涵,吴琳,张劲松,高勇,钟鸣
(1.中国医科大学口腔医学院修复科,辽宁省口腔医学研究所,沈阳110002;2.中国科学院金属研究所,沈阳110016;3.中国医科大学口腔医学院中心实验室,沈阳110002)
近年来,具有良好生物相容性和安全性的人工关节的开发已成为研究的热点[1]。钛材料因其低密度、良好的耐腐蚀能力、比强度高以及令人满意的生物相容性成为应用最为广泛的人工关节材料,但钛材料的低表面硬度,低抗磨损能力,制约了其发展[2]。而TiC化合物具有很高的硬度和耐磨性,将TiC加入钛材料除了可进一步提高材料的比弹性模量、比强度和抗蠕变能力外,最明显的是提高钛材料的耐磨性能。TiC/Ti复合泡沫材料(TiC/Ti)为生物惰性材料,为了增加其表面活性,制备了表面经氧化处理的TiC/Ti(TiO2/TiC/Ti)和表面经ZSM-5分子筛修饰的TiC/Ti(ZSM-5/TiC/Ti)。本课题组前期研究证实泡沫碳化硅(SiC)具有良好的生物相容性[3],可以促进成骨细胞生长[4],并且有良好的骨传导性[5]。本实验以SiC为阴性对照,将TiC/Ti、TiO2/TiC/Ti、ZSM-5/TiC/Ti材料与SiC进行比较,研究这3种实验材料对细胞增殖和分化的影响,旨在为新型人工关节材料的研发提供实验室数据。
1 材料与方法
1.1 材料及分组
实验分为 4 组:TiC/Ti组、TiO2/TiC/Ti组、ZSM-5/TiC/Ti组、阴性对照SiC组。4种材料均为直径14 mm、厚2 mm的圆片,平均孔径1mm,孔隙率80%(中国科学院金属研究所制备)。用75%乙醇超声清洗,40 Hz,5 min,烘干,高温高压(134 ℃、0.21 MPa)灭菌处理。
1.2 方法
1.2.1 细胞增殖实验:将灭菌处理后的4种材料分别加入培养液,置于 CO2培养箱(37℃,5%CO2)中培养24 h,制备出材料浸提液[6],试件浸提量与试样质量比为0.2 g/mL[7]。将浓度为1×104/mL 的 L929细胞(由中国医科大学中心实验室提供)悬液接种于96 孔板,每孔100 μL,每组10 孔。培养24 h,PBS 冲洗后,分别用A~E组液体置换,培养1,3,5 d后取出。加入50 μL/孔浓度为5 mg/mL的MTT液,继续培养 4 h,吸去原液,加入150 μL/孔的 DMSO[8],振荡10 min,在免疫酶仪上以550 nm波长测定吸光度,并计算细胞的相对增殖度(RGR):RGR=实验组平均吸光度值/阴性对照组平均光密度值×100%。
1.2.2 细胞黏附实验:将灭菌备用的4组材料置入24孔培养板中,将浓度为2×104/mL的小鼠成骨细胞MC3T3(由中国医科大学中心实验室提供)悬液,接种到各样品表面,置于37℃,5%CO2的细胞培养箱内培养。细胞培养1,3,5 d后取出,用0.l mol/L的PBS漂洗后放入2.5%戊二醛中固定24 h,1%锇酸固定1 h,然后将试样再次用PBS漂洗,随后依次乙醇系列梯度脱水、CO2临界点干燥、喷金后[9],在扫描电子显微镜(Quanta600,中国科学院金属研究所)观察材料表面细胞的形态。
1.2.3 碱性磷酸酶(alkaline phosphatase,ALP)含量测定:将2×104/mL的MC3T3成骨细胞悬液接种于24孔板的各组材料表面,分别培养1,3,5 d后,将细胞消化下来,超声破碎仪破碎后,取样。用ALP试剂盒(南京凯基生物公司)检测ALP含量,以酶联免疫检测仪在520 nm处测定光密度值(optical delnsity,OD)。依据公式 ALP(U/gprot)=测定管吸光度/标准管吸光度×标准管含酚的量(0.003 mg)/取样量中的蛋白(g),计算MC3T3的平均ALP活性。
1.3 统计学处理
2 结果
2.1 细胞增殖结果
结果可见,L929细胞在3种材料浸提液中均能生长,且随时间的延长而不断增多。TiC/Ti、TiO2/TiC/Ti、ZMS-5/TiC/Ti组和SiC组间细胞量有统计学差异(P<0.05)。经LSD-t检验比较分析,与SiC比较,在1 d 时,TiO2/TiC/Ti>SiC(P <0.05),而 TiC/Ti、ZSM-5/TiC/Ti组的细胞量与SiC相近(P>0.05);在3 d时,SiC>ZSM-5/TiC/Ti(P <0.05),TiC/Ti>SiC(P <0.05),TiO2/TiC/Ti组的细胞量与SiC组相近(P>0.05);在5 d 时,TiC/Ti、TiO2/TiC/Ti>SiC(P <0.05),SiC>ZSM-5/TiC/Ti(P<0.05),见表1。

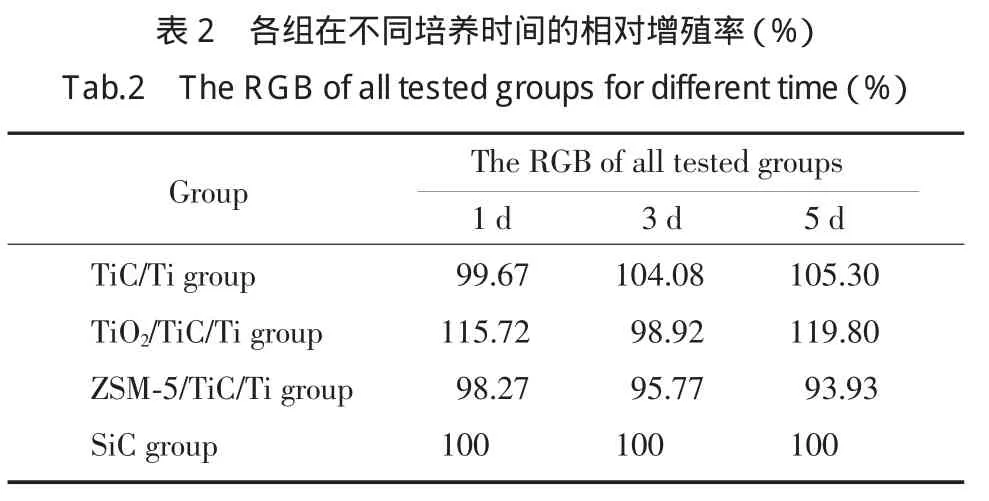
与SiC组比较,TiC/Ti组增殖率和增殖速度随时间延长而逐渐升高;TiO2/TiC/Ti增殖率不断升高,增殖速度在3 d时减缓后加快;而ZSM-5/TiC/Ti增殖率低于SiC,而且增殖速度不断下降,见表2。
2.2 细胞黏附试验
扫描电镜观察可见:3种实验材料与阴性对照SiC组表面均有MC3T3细胞黏附,并随观察时间的延长而逐渐增多,贴壁伸展的MC3T3细胞表面具有许多突起,并伸出较多的丝状、纤维状伪足,有的细胞将伪足伸向孔径的内部,细胞间靠伪足相连,3 d开始出现细胞外基质沉积,而5 d可见明显的细胞外基质沉积,细胞包绕在细胞外基质内,细胞边界逐渐模糊。3种实验材料表面上黏附的MC3T3细胞形态与阴性对照SiC组没有明显差别,见图1。

2.3 ALP含量结果(表3)

结果可见,随时间延长,各组ALP含量逐渐增加。TiC/Ti、TiO2/TiC/Ti、ZMS-5/TiC/Ti组和 SiC 组间ALP含量有统计学差异(P<0.05)。经单因素方差分析,组间比较ALP含量有统计学差异(P<0.05)。经LSD-t检验比较分析,与SiC组比较,ALP含量在1 d时,TiC/Ti稍高于 SiC,但无统计学差异(P>0.05),TiO2/TiC/Ti>SiC( P<0.05),SiC>ZSM-5/TiC/Ti(P <0.05);在3 d 时,TiC/Ti、TiO2/TiC/Ti>SiC(P <0.05),SiC>ZSM-5/TiC/Ti(P <0.05);在5 d 时,TiC/Ti>SiC(P<0.05),TiO2/TiC/Ti稍高于 SiC,但无统计学差异(P >0.05),SiC>ZSM-5/TiC/Ti(P <0.05)。
3 讨论
从细胞增殖、细胞黏附和ALP含量测定实验结果可以看出,3种实验材料的生物相容性与SiC比较,TiC/Ti和 TiO2/TiC/Ti均优于 SiC,ZSM-5/TiC/Ti低于SiC。研究表明:钛材料表面的TiC涂层能够提高材料表面稳定性、植入材料的生物相容性[10]及成骨细胞的活性,促进细胞在植入体表面的黏附[11],这可能是本实验中TiC/Ti促进细胞增殖以及成骨细胞分化的原因。TiO2涂层可增加材料的比表面积,提高材料表面的生物活性[12],其纳米级表面,相对于微米级表面会吸附更多的蛋白,成骨细胞的吸附率很高[13],而且TiO2涂层在潮湿的环境下,表面会形成一些活性羟基,这些Ti-OH基团可以成为Ca、P离子的沉积位点[14],因此推断TiC/Ti表面氧化处理形成的TiO2/TiC/Ti有利于细胞的增殖和分化,但是由于Ti-OH基团形成钙、磷离子沉积位点需要一定的时间,有可能导致细胞的增殖速率由慢到快。TiC/Ti表面经ZSM-5分子筛修饰后形成的ZSM-5/TiC/Ti具有较高的热稳定性、抗酸性、水热稳定性、优良的催化性能[15]及良好的生物相容性,但是可能由于在高温或存在高温水蒸汽的环境中,硅铝分子筛出现骨架脱铝现象使分子筛的活性下降、不稳定[16],使细胞增殖的速率变缓,细胞分化能力低于SiC。
综上所述,TiC/Ti、TiO2/TiC/Ti及其降解产物可促进细胞的增殖和分化,具有良好的生物相容性,加上其优良的耐磨性能和机械性能,作为人工关节材料具有可行性,而ZSM-5/TiC/Ti还需进一步探讨及研究。
[1]荣小芳,吴琳,杨晓东,等.兔下颌骨临界骨缺损人工材料植入实验动物模型的建立[J].中国医科大学学报,2008,37(1):62-64.
[2]樊丁,戴景杰,孙耀宁,等.激光表面合金化制备TiC/Ti复合涂层的组织与性能[J].兰州理工大学学报,2006,32(4):13-15.
[3]吴琳,徐兴祥,李波,等.泡沫碳化硅的生物相容性[J].材料研究学报,2008,22(1):58-62.
[4]袁月,哈斯达来,吴琳,等.碳化硅对成骨细胞增殖和分化的影响[J].生物医学工程与临床,2012,16(2):109-113.
[5]吴琳,徐兴祥,王禄增,等.泡沫碳化硅细胞相容性及动物体内植入实验研究[J].无机材料学报,2010,25(2):212-215.
[6]刘广涛,朱松,刘志辉.自制义齿基托表面涂层材料的体外细胞毒性研究[J].中国实用口腔科杂志,2010,3(3):146-148.
[7]黄经春,朱雪涛,由少华,等.医疗器械生物学评价第12部分:样品制备与参照样品 GB/T16886.12-2000/ISO10993-12:1996[M].北京:中国标准出版社,2005:4-6.
[8]王青釭,朱圣韬,张澍田,等.环氧合酶-2启动子甲基化在食管鳞癌中的作用[J].首都医科大学学报,2010,31(3):324-328.
[9]张云松,高建华,鲁峰,等.I型胶原支架材料与人脂肪干细胞体外生物相容性研究[J].南方医科大学学报,2007,27(2):223-225.
[10]Brama M,Rhodes N,Hunt J,et al.Effect of titanium carbide coating on the osseointegration response in vitro and in vivo[J].Biomaterials,2007,28(4):595-608.
[11]Ricci A,Brama M,Ferro D,et al.Modulation of osteoblastic cells activity on improved titanium carbide(TiC)coated substratum[J].Calcif Tissue Int,2003,72(4):355-356.
[12]张静娴,张新平,孙学通,等.医用多孔NiTi合金表面溶胶-凝胶法制备 TiO2 涂层[J].无机化学学报,2011,27(2):264-268.
[13]于晓琳.阳极氧化法制备的二氧化钛纳米管在钛表面改性中的研究进展[J].国际口腔医学杂志,2012,39(1):80-82.
[14]贺刚,陈治清,盛祖立.纯钛种植体表面纳米TiO2生物活性涂层的构建[J].中国口腔种植学杂志,2008,13(3):101-105.
[15]李永红.ZSM-5分子筛及分子筛膜的合成[D].天津大学,2006:1-6.
[16]马广伟,谢在库.硅铝分子筛骨架脱铝模型[J].材料研究学报,2009,23(2):205-210.
