高侵袭性胶质瘤细胞转移相关miRNA的芯片分析
2012-12-03李少一高芸刘宏宇王国栋李晓东马维宁刘云会
李少一,高芸,刘宏宇,王国栋,李晓东,马维宁,刘云会
(中国医科大学1.附属盛京医院神经外科,沈阳110004;2.附属第一医院内分泌研究所,沈阳110001)
胶质瘤是人脑最常见的恶性肿瘤,约占40.49%,胶质瘤的特点是侵袭性强且容易复发。微小RNA(microRNA或miRNA)是指长度约21~25 nt的某些特殊的小型非编码RNA组成的家族,这些miRNA能够识别特定的目标mRNA,并在转录后水平通过促进靶mRNA的降解和(或)抑制翻译过程而发挥负调控基因表达的作用[1]。近年来,其研究已经从基础研究迅速上升到临床研究,研究证实miRNA参与诸多基因激活和失活的调节,逐渐成为肿瘤、心血管、免疫、炎症等疾病发生发展过程中的重要分子标志[2~4]。miRNA作为肿瘤标志物,对预测人胶质瘤的侵袭转移和临床预后的相关研究还需要深入解析。肿瘤侵袭和转移是主动过程,该过程可以概括为3个步骤:(1)肿瘤细胞与细胞外基质成分黏附;(2)肿瘤细胞释放或诱导释放蛋白水解酶,降解细胞外基质;(3)降解区域肿瘤细胞在趋化因子引导下迁移。肿瘤细胞必须启动并成功地完成所有这些步骤才能进入循环系统和淋巴系统,形成远隔转移[5,6]。为了深入研究侵袭转移步骤的机制,研究者建立了一些体外侵袭模型用于评估不同肿瘤细胞的侵袭活性[7,8]。为了深入了解转移相关性miRNA表达的改变对人胶质瘤淋巴转移的影响,我们从人类胶质瘤细胞系T98G中用Transwell侵袭小室技术通过体外筛选,建立了高侵袭性的胶质瘤细胞亚群(命名为T98G-4M-1、T98G-4M-2和T98G-4M-3)。通过分析其在软琼脂中集落形成情况,比较几种细胞亚群的体外集落形成能力,并采用miRNA芯片技术分析胶质瘤中与转移密切相关的miRNA表达谱,旨在筛选与胶质瘤侵袭转移密切相关的miRNA。
1 材料与方法
1.1 细胞培养
人胶质瘤细胞系T98G购自ATCC,细胞培养在含10%胎牛血清的DMEM培养液中,放置37℃、5%CO2的细胞培养箱中。
1.2 Transwell体外侵袭实验筛选高侵袭性的细胞亚群
用Transwell侵袭小室根据T98G细胞的侵袭性差异把他们分成不同细胞亚群。即用一种重新溶解配成原来浓度的基膜凝胶涂铺Transwell有小插孔的聚碳酸酯膜(含8 μm孔)。将T98G细胞(5×104/孔)接种于Transwell小室上室,高侵袭性细胞消化基质胶后穿过Transwell小室聚碳酸酯膜上8 μm小孔进入小室下室,于37°C放置48 h后,收集高侵袭性细胞群。分别选出3个细胞亚群T98G-4M-1、T98G-4M-2和T98G-4M-3。那些没有移行至Transwell小室下室,停留在上室的细胞群,作为对照细胞命名为T98G-4C-1、T98G-4C-2和T98G-4C-3。
1.3 软琼脂集落形成实验
1×103个对数生长期T98G细胞悬浮于含0.3%软琼脂的完全培养液中,播种于1%底层软琼脂上(100 mm组织培养皿),放置37℃、5%CO2的细胞培养箱中2周后,计数可见集落。
1.4 miRNA芯片分析
用Trizol(Invitrogen公司)提取RNA,委托博奥生物公司进行miRNA芯片分析。采用LuxScan10K激光共聚焦扫描仪扫描杂交芯片,并用LuxScan3.0软件分析表达谱。采用Partek Genomics Suite分析表达谱结果,P<0.05、Fold Change>2为差异表达miRNA。
2 结果
2.1 T98G细胞亚群的成瘤性比较
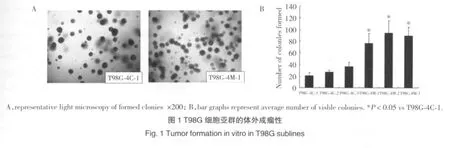
利用Transwell小室,根据其侵袭性的差异,将人类的胶质瘤细胞株T98G分为2个不同的细胞亚群。穿过基质膜的细胞作为高侵袭性的细胞亚群(T98G-4M-1、T98G-4M-2和T98G-4M-3)。而那些留在小室上室的细胞亚群作为对照组(T98G-4C-1、T98G-4C-2和T98G-4C-3)。用体外集落形成实验来检测选定的细胞亚群的成瘤性。如图1所示,在软琼脂上的T98G-4M-1、T98G-4M-2和T98G-4M-3细胞亚群,形成的集落数量分别是对照组的2.7、3.4和3.2倍。
2.2 与人胶质瘤T98G细胞侵袭转移密切相关的miRNA表达谱
为了解析参与调控胶质瘤侵袭转移的miRNA,我们分析了高侵袭性细胞亚群与对照组的表达有差异的miRNA。如表1显示,高侵袭性细胞亚群与对照细胞亚群比较,采用Partek Genomics Suite分析表达谱结果,有11个miRNA的表达有显著差异(P<0.05,Fold Change>2),其中5个miRNA的表达上调(let-7b、miR-200A、miR-222、miR-106 和 miR-193)和6个miRNA的表达下调(mir-199B、mir-26A、mir-34、miR-29、mir-15A 和 mir-16)。
3 讨论
至今我们对肿瘤恶性转化及侵袭转移演变过程的了解还很有限,本研究采用Transwell侵袭小室,从人胶质瘤细胞株T98G中筛选出高侵袭及转移潜能的细胞亚群。结果显示,Transwell侵袭小室的体外筛选是一个可行的方法,能够分离不同恶性程度的细胞亚群,这些细胞亚群可用于进一步评估胶质瘤侵袭和转移相关性的研究。为了鉴别miRNA表达谱有显著差异,我们通过微点阵分析3个不同的高侵袭性亚群和对照亚群,并获得了与转移相关的miRNA差异表达图谱。本研究所用的所有细胞系均来自同一母细胞系,因此他们有相同的遗传背景,但有不同转移潜能。当我们比较侵袭性亚群和对照亚群时,我们鉴别出11个差异性调节miRNA。在高转移的细胞亚群与对照组间,已确定存在差异表达的11个 miRNA 中,有 9个 miRNA(let-7b、mir-222、mir-106、mir-193、mir-34、mir-29、mir-26a、mir-15a 和mir-200)在肿瘤细胞转移的进展中及间质上皮的转变发挥了重要作用[9~12];而mir-199B和mir-16分别涉及肿瘤干细胞的分化及凋亡[13,14]。

miRNA在不同组织、不同发育阶段中的表达水平有显著差异,miRNA表达模式具有分化的位相性和时序性,而且miRNA作为一种广泛存在的对基因表达进行微调的分子,通过网络式调控方式,可以从整体上调控有机体的生命活动。在本研究中我们获得了关于转移相关的miRNA差异表达的相关信息,提示这些miRNA可能显著影响肿瘤转移及恶性转化。因此需要进一步研究以确定miRNA差异表达的分子机制,并探究这些miRNA如何促进肿瘤转移。
[1]Landgraf P,Rusu M,Sheridan R,et al.A mammalian microRNA expression atlas based on small RNA library sequencing[J].Cell,2007,129(7):1401-1414.
[2] Hassler M,Singh S,Yue WW,et al.Crystal structure of the retinoblastoma protein N domain provides insight into tumor suppression,ligand interaction,and holoprotein architecture[J].Mol Cell,2007,28(3):371-385.
[3]Meng F,Henson R,Wehbe-Janek H,et al.MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer[J].Gastroenterology,2007,133(2):647-658.
[4]Papagiannakopoulos T,Shapiro A,Kosik KS.MicroRNA-21 targets a network of key tumor-suppressive pathways in glioblastoma cells[J].Cancer Res,2008,68(19):8164-8172.
[5]Fidler IJ,Kim SJ,Langley RR.The role of the organ microenvironmentinthebiologyandtherapyofcancermetastasis[J].JCellBiochem,2007,101(4):927-936.
[6]Bidard FC,Poupon MF.The metastatic process:history,models and recent advances[J].Med Sci(Paris),2012,28(1):89-95.
[7]史德刚,范钰,朱夫,等.靶向survivin基因RNAi沉默表达对恶性胶质瘤细胞侵袭的影响[J]. 南方医科大学学报,2009,29(5):1156-1158.
[8]刘巍,晁腾飞,龚燕华,等.应用微阵列芯片分析人髓母细胞瘤及瘤旁组织 miRNA 表达谱差异[J].首都医科大学学报,2009,30(3):355-359.
[9]Nikiforova MN,Tseng GC,Steward D.MicroRNA expression profiling of thyroid tumors:biological significance and diagnostic utility[J].J Clin Endocrinol Metab,2008,93(5):1600-1608.
[10]Gregory PA,Bracken CP,Bert AG,et al.MicroRNAs as regulators of epithelial-mesenchymal transition[J].Cell Cycle,2008,7(20):3112-3118.
[11]Korpal M,Kang Y.The emerging role of miR-200 family of microRNAs in epithelial-mesenchymal transition and cancer metastasis[J].RNA Biol,2008,5(3):115-119.
[12]Gebeshuber CA,Zatloukal K,Martinez J.miR-29a suppresses tristetraprolin,which is a regulator of epithelial polarity and metastasis[J].EMBO Rep,2009,10(4):400-405.
[13]Garzia L,Andolfo I,Cusanelli E,et al.MicroRNA-199b-5p impairs cancer stem cells through negative regulation of HES1 in medulloblastoma[J].PLoS ONE,2009,4(3):e4998.
[14]Guo CJ,Pan Q,Li DG,et al.miR-15b and miR-16 are implicated in activation of the rat hepatic stellate cell:An essential role for apoptosis[J].J Hepatol,2009,50(4):766-778.
