咪唑类离子液体中镁的可逆沉积-溶出性能
2012-11-24娜斯曼吐尔逊努丽燕娜赵青松王久林
娜斯曼·吐尔逊,努丽燕娜,赵青松,杨 军,王久林
(上海交通大学 化学化工学院,上海 200240)
咪唑类离子液体中镁的可逆沉积-溶出性能
娜斯曼·吐尔逊,努丽燕娜,赵青松,杨 军,王久林
(上海交通大学 化学化工学院,上海 200240)
采用循环伏安、恒电流充放电、X射线衍射、扫描电镜技术研究含有三氟甲基磺酸镁的1-乙基-3-甲基咪唑四氟硼酸盐、1-丁基-3-甲基咪唑四氟硼酸盐、1-丁基-2,3-二甲基咪唑四氟硼酸盐、1-丁基-2,3-二甲基咪唑鎓双三氟甲基磺酰亚胺盐4种离子液体中镁的沉积与溶出行为以及沉积物的组成和形貌。结果表明:在咪唑阳离子基团中增加1-位碳上烷基链的长度和在2-位碳上引入甲基可以提高咪唑阳离子的还原稳定性,拓宽电解液还原电位窗口到-1 V (vs Mg RE);同时采用TFSI-阴离子可使电解液阳极氧化电位拓宽到3.1 V (vs Mg RE)以上;适量添加有机溶剂THF可增加Mg2+的还原-氧化峰电流,降低峰电位差,提高可逆性。
离子液体;镁;沉积-溶出;可逆性
在离子化合物中,阴、阳离子之间的作用力是库仑力,其强弱与阴、阳离子的电荷及半径大小有关。离子半径越大,它们之间的作用力越弱,离子化合物的熔点就越低。某些离子化合物的阴、阳离子体积很大,结构松散,导致它们之间的作用力较弱,以至于熔点很低,在室温或近于室温下(100 ℃以下)呈液体状态,这种盐被称为离子液体(Ionic liquid简称IL),也叫室温熔融盐(Room temperature melt salt 简称RTMS)。它们通常由含有氮、磷等元素体积相对较大、不对称的有机阳离子和体积相对较小的无机阴离子组成,其中不含任何中性分子,结构可表示为[cation]+[anion]-[1-2]。离子液体既可以起溶剂作用,也可以起电解质的作用。与传统有机电解液相比,具有液程宽、蒸气压低、不易燃烧、热稳定性好、电化学窗口宽、导电性较好、对无机物和有机物均有良好的溶解性等优点[3]。离子液体的种类很多,具有代表性的阳离子有烷基取代的季铵离子([NRxH4-x]+)、季鏻离子([PRxH4-x]+)、吡咯离子、哌啶离子、吡唑离子、吡啶离子([RPy]+)、咪唑离子([RR’im]+或[RR’ R’im]+)等;具有代表性的阴离子有、三氟甲基磺酸离子(OTF-或)、二(三氟甲基磺酰)亚胺离子(TFSI-或(CF3SO2)2N-)等[4]。
利用离子液体的特性,将其应用于金属的电沉积,室温下即可得到在高温熔融盐中才能电沉积得到的金属或合金,没有高温熔融盐的强腐蚀性,且能耗大大降低[5]。研究人员对在离子液体中电沉积各种金属及合金进行了广泛的研究,利用在其中可逆电沉积-溶出金属锂的过程,将离子液体作为锂电池新一代的电解液,有可能满足电解液不挥发、长期稳定的要求[6-8]。袁华堂等[9]在对离子液体应用于电池的评述中,表明可将离子液体用作可充镁电池的电解液。
镁与锂离子半径相近,化学性质相似。与锂相比,镁虽然电极电位较高、理论比容量较低,但价格低廉、安全性好,因此,以镁作为负极的镁电池虽不能与应用于小尺度的锂电池竞争,但在大负荷用途方面有潜在优势[10]。镁在绝大部分溶液中会生成致密的、镁离子不易通过的钝化膜,限制了镁的电化学活性,从而使金属镁在电解液中的可逆沉积与溶出变得非常困难。研究者在溶于醚溶剂中的格氏试剂、Mg(BR2R′2)2(其中 R、R′为烷基或芳基)、Mg(AX4-nRn′R′n″)2络合物(其中 A = Al、B、Sb、P、As、Fe和 Ta等,X = Cl、Br 和 F,R、R′为烷基或芳基,0<n<4,n′+n″=n)或氨基镁卤化物的有机溶液体系中,实现了镁的可逆沉积[11-12]。其中突破性的进展是由以色列科学家AURBACH 等[10]提出的 Mg(AX4-nRn′R′n″)2的醚溶液,但此体系由于含有易挥发的醚溶剂使其不稳定。为了拓宽可充镁电池电解液的研究范围,NULI等[13-18]研究了在含有 Mg(CF3SO3)2的咪唑类(BMImBF4)和哌啶类(PP13-TFSI)离子液体体系中镁沉积-溶出过程。其研究发现,在起始几次循环中镁沉积-溶出过程电位较高,可尝试使用混合离子液体体系加以改进;并可通过加入 EC(碳酸乙烯酯)添加剂改善 BMImBF4离子液体电解液中的镁沉积-溶出性能。由于咪唑型离子液体价格较为便宜、粘度较低,本文作者进一步对不同咪唑型离子液体中镁沉积-溶出过程进行研究,具体为咪唑阳离子基团1-位上烷基链的长度、2-位上引入烷基对电解液还原分解电位的影响,不同阴离子对电解液阳极氧化电位的影响,并通过添加少量有机溶剂THF来改善镁沉积-溶出性能。

图1 文中所用4种咪唑基离子液体的化学结构Fig. 1 Chemical structures of four kinds of imidazolium-based ionic liquids used in this work
1 实验
1.1 试剂与仪器
1-乙基-3-甲基咪唑四氟硼酸盐(1-ethyl-3-methylimidazolium tetrafluoroborate, EMImBF4) (>99.0%,质量分数)、1-丁基-3-甲基咪唑四氟硼酸盐 (1-butyl-3-methylimidazolium tetrafluoroborate,BMImBF4) (>99.0%,质量分数)、1-丁基-2, 3-二甲基咪唑四氟硼酸盐(1-butyl-2,3-dimethylimidazolium tetrafluoroborate, Butyl-DMImBF4)(>99.0%,质量分数)、1-丁基-2, 3-二甲基咪唑鎓双三氟甲基磺酰亚胺盐(1-butyl-2,3-dimethylimidazolium bis-((trifluoromethyl)sulfonyl)imide, Butyl-DMImTFSI)(>99.0%,质量分数)均由中国科学院兰州化学物理研究所绿色化学与催化中心提供,4种离子液体的分子结构如图 1所示。三氟甲基磺酸镁(Mg(CF3SO3)2)(>97%,质量分数)购买于 Aldrich公司,金属镁条(>99%,质量分数)购买于百灵威化学技术有限公司。镁粉(99%,质量分数)购买于上海国药集团化学试剂有限公司,所有试剂放置于氩气气氛手套箱(MBRAUN,德国UNILAB)中备用。高纯四氢呋喃(THF)由实验室自组装设备重蒸纯化制得。
三电极测试体系和实验扣式电池(CR2016)的组装均在氩气气氛手套箱中进行。使用CHI650C电化学工作站(上海辰华仪器有限公司)上进行循环伏安扫描测试。LAND-CT2001A系统测试溶解Mg(CF3SO3)2的咪唑类离子液体电解液中镁在 Cu上的恒电流电化学沉积-溶出过程。X射线衍射仪(D/max-2200/PC, Japan Rigaku Corporation)测定铜基质上的沉积组分,场发射扫描式电子显微镜(JSM-7401F, JEOL Ltd., Japan)拍摄铜基质上沉积物的形貌。
1.2 离子液体电解液的配制
在氩气气氛手套箱内,将定量Mg(CF3SO3)2分别加入到EMImBF4、BMImBF4、Butyl-DMImTFSI离子液体中,用磁子搅拌 24 h,使其溶解,配制成Mg(CF3SO3)2浓度为 0.3 mol/L的溶液;再加入 THF配成离子液体和THF体积比为3:1的混合溶液。由于Butyl-DMImBF4在常温下为固体(熔点为 38~40 ℃),先加热到 40 ℃使其溶解,然后再加入 Mg(CF3SO3)2和 THF,搅拌,配制成 0.3 mol/L 的 Mg(CF3SO3)2/Butyl-DMImBF4+THF的溶液,调节 THF的量,使Butyl-DMImBF4与 THF的体积比分别为 1:1、1:3和1:4。
1.3 循环伏安曲线测试
采用三电极体系测试离子液体电解液中镁的电化学沉积-溶出行为。电解液分别为 0.3 mol/L的Mg(CF3SO3)2/EMImBF4、Mg(CF3SO3)2/BMImBF4、Mg(CF3SO3)2/Butyl-DMImTFSI、 Mg(CF3SO3)2/BMImBF4+THF(BMImBF4与 THF的体积比为 3:1)、Mg(CF3SO3)2/Butyl-DMImBF4+THF的溶液(Butyl-DMImBF4与THF的体积比分别为1:1、1:3和1:4),工作电极为银片或铂盘(直径为2 mm),对电极和参比电极分别为镁条。工作电极用抛光粉处理后,擦拭干净;镁条采用 800CW 砂纸对表面进行打磨,擦拭干净。测试时,从开路电位开始向负方向扫描,扫描速率为50 mV/s。
1.4 镁沉积-溶出循环过程测试
离子液体电解液中镁的电化学沉积-溶出性能进一步通过实验扣式电池的充放电循环测试进行判断。正极为铜箔(d 12.5 mm)或银片;负极为镁粉,由镁粉(在350 r/min下球磨10 h)、乙炔黑和PVDF粘结剂(0.02 g/mL的四氢呋喃溶液)按90:3:7的质量比混合制得。恒电流充放电条件为:以0.1 mA进行30 min的放电(镁沉积),30 s的静置,再以相同电流进行充电(镁溶出)到截止电位0.8 V (vs Mg),如此循环。由于以相同的电流进行沉积与溶出,镁沉积-溶出效率可由充电时间除以放电时间计算得到。
1.5 XRD及SEM测试
XRD测试中,使用Cu靶的Kα射线(0.154 184 nm)进行实验,扫描速度为5 (°)/min。电极样品制备采用与正常扣式电池相同的程序,电池以0.1 mA 的电流进行镁的沉积-溶出循环,达到稳定循环后,沉积48 h,将放电态的电池在手套箱内拆开,迅速用THF将铜基质表面电解液洗干净,用滤纸将THF吸干,进行XRD测试。同样的处理方法制作样品进行扫描电子显微镜测试,观察沉积物的形貌,样品不需要喷金预处理。
2 结果讨论与分析
2.1 Mg(CF3SO3)2/EMImBF4体系
图 2所示为 EMImBF4离子液体中加入Mg(CF3SO3)2前后 Ag电极上的循环伏安图。由图 2可以看出,空白EMImBF4离子液体在Ag电极上的还原分解电位在0 V (vs Mg RE)附近,氧化分解电位为1 V (vs Mg RE)。加入Mg(CF3SO3)2后,出现了一对还原、氧化峰A/A′,应与Mg2+还原和氧化的过程有关。但EMImBF4离子液体的还原分解电位与Mg2+还原电位很接近,因而Mg(CF3SO3)2/EMImBF4不能用作镁沉积-溶出的电解液。

图2 EMImBF4离子液体和 0.3 mol/L 的 Mg(CF3SO3)2/EMImBF4溶液中Ag电极上的循环伏安图Fig. 2 Cyclic voltammograms (CVs) of EMImBF4 ionic liquid without and with 0.3 mol/L Mg(CF3SO3)2 on Ag electrode
2.2 Mg(CF3SO3)2/BMImBF4体系
将咪唑阳离子基团1-位上的乙基变成丁基,比较1-位上烷基链的长度对咪唑类离子液体还原分解电位的影响。图 3(a)所示为 BMImBF4离子液体中加入Mg(CF3SO3)2前后 Pt盘电极上循环伏安图。空白BMImBF4离子液体在 Pt盘电极上的还原分解电位在-0.30 V (vs Mg RE)附近,氧化分解电位为2.6 V (vs Mg RE)。加入 Mg(CF3SO3)2后,分别在-0.16 和 1.28 V(vs Mg RE)出现了一对与Mg2+还原氧化过程有关的还原氧化峰 A/A′,氧化电量明显低于还原电量。BMImBF4离子液体的还原分解电位比 Mg2+还原电位负,可以考虑作为镁沉积-溶出的电解液。从图 3(b)可以看出,经过几次之后循环到达稳定时,还原电量明显增加,Mg2+的还原氧化过程可逆性提高,而电解液也具有2.6 V (vs Mg RE)较高的阳极氧化分解电位。
与有机电解液相比,以离子液体为溶剂的电解液体系一般粘度较大,通过加入一定量的有机溶剂可以降低其粘度,提高电导率[19]。图 4所示为 0.3 mol/L的Mg(CF3SO3)2/BMImBF4电解液中加入THF前后在Pt盘电极上的循环伏安结果。由图4可以看到,加入THF后(BMImBF4与THF的体积比为3:1),Mg2+的氧化-还原峰电流增大,且还原峰电位负移,可逆性提高。

图3 在BMImBF4离子液体和0.3 mol/L 的Mg(CF3SO3)2/BMImBF4溶液中Pt盘电极上的循环伏安图和0.3 mol/L 的Mg(CF3SO3)2/BMImBF4电解液中Pt盘电极上稳定循环的循环伏安图Fig. 3 Cyclic voltammograms of BMImBF4 without and with 0.3 mol/L Mg(CF3SO3)2 on Pt disk electrode (a), and sTablecyclic voltammograms of 0.3 mol/L Mg(CF3SO3)2/BMImBF4 on Pt disk electrode (b)

图4 在 0.3 mol/L 的 Mg(CF3SO3)2/BMImBF4和 0.3 mol/L的Mg(CF3SO3)2/BMImBF4+THF(BMImBF4与THF的体积比为3:1)溶液中Pt盘电极上的循环伏安图Fig. 4 Cyclic voltammograms of 0.3 mol/L Mg(CF3SO3)2/BMImBF4 and 0.3 mol/L Mg(CF3SO3)2/BMImBF4+THF(volume ratio of 3:1 for BMImBF4 and THF) on Pt disk electrode
2.3 Mg(CF3SO3)2/Butyl-DMImBF4体系
从图1可以看到,咪唑环上存在3个酸性质子,特别是2-位碳上的质子,具有较强的还原性[20-21]。为了进一步提高咪唑阳离子的还原稳定性,本研究选择了在 2-位碳上有甲基的 Butyl-DMImBF4离子液体,将其加热溶解后与Mg(CF3SO3)2一起加入到THF中,配制成 0.3 mol/L Mg(CF3SO3)2/butyl-DMImBF4+THF的溶液,调节THF的量,使butyl-DMImBF4与THF的体积比分别为 1:1、1:3和 1:4。考虑到电解液的粘性,加入的THF量与上面BMImBF4体系相比较多。
图5所示为Butyl-DMImBF4+THF和0.3 mol/L 的Mg(CF3SO3)2/Butyl-DMImBF4+THF(BMImBF4与THF的体积比为1:1)溶液中Pt盘电极上的循环伏安图。由图5可以看出,未加Mg(CF3SO3)2时,Butyl-DMImBF4+THF的阴极还原电位为-0.8 V (vs Mg RE),阳极氧化电位可达到3 V (vs Mg RE)左右。加入Mg(CF3SO3)2后,出现了一对与Mg2+还原氧化过程有关的还原氧化峰 A/A′。
图 6所示为不同 THF含量的 0.3 mol/L 的Mg(CF3SO3)2/Butyl-DMImBF4+THF溶液中Cu基质上的镁沉积-溶出效率。由图6可以看出,镁沉积-溶出效率随循环次数的增加在提高。其中,Butyl-DMImBF4与THF体积比为1:3的溶液具有最高的镁沉积和溶出效率,5次循环后值可接近100%。

图 5 在 Butyl-DMImBF4+THF 和 0.3 mol/L 的Mg(CF3SO3)2/Butyl-DMImBF4+THF(BMImBF4与 THF的体积比为1:1)溶液中Pt盘电极的循环伏安图Fig. 5 Cyclic voltammograms of Pt disk electrode in Butyl-DMImBF4+THF and 0.3 mol/L Mg(CF3SO3)2/Butyl-DMImBF4 +THF (volume ratio of 1:1 for Butyl-DMImBF4 to THF) solutions
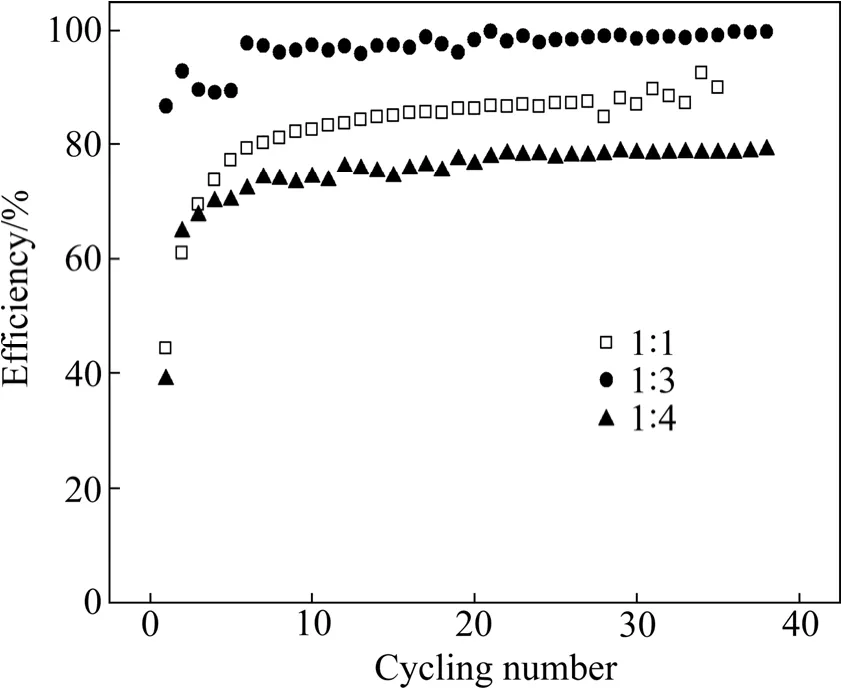
图6 在0.3 mol/L的Mg(CF3SO3)2/Butyl-DMImBF4+THF溶液中Cu基质上的镁沉积-溶出效率(Butyl-DMImBF4与THF的体积比分别为1:1、1:3和1:4)Fig. 6 Cycling efficiency of Mg deposition-dissolution on copper substrate in 0.3 mol/L Mg(CF3SO3)2/Butyl-DMImBF4+THF (volume ratio of 1:1, 1:3 and 1:4 for Butyl-DMImBF4 to THF, respectively) solution
图 7所示为 0.3 mol/L的 Mg(CF3SO3)2/Butyl-DMImBF4+THF(Butyl-DMImBF4与 THF的体积比为1:3)溶液中Cu基质上的镁沉积-溶出曲线。由图7可以看出,在首次沉积过程中,沉积电位可高达-0.9 V,可能与起始过程中Mg2+复杂的吸附过程有关[13-14]。第二次沉积电位即降低到-0.1 V,并随循环过程的进行沉积-溶出曲线变化不大,溶出电位则保持在0.1 V附近。

图7 在 0.3 mol/L 的 Mg(CF3SO3)2/Butyl-DMImBF4+THF(Butyl-DMImBF4与THF的体积比为1:3)溶液中Cu基质上的镁沉积-溶出曲线Fig. 7 Chronopotentiograms of Mg deposition-dissolution on copper substrate in 0.3 mol/L Mg(CF3SO3)2/Butyl-DMImBF4+THF (volume ratio of 1:3 for Butyl-DMImBF4 to THF) solution
图 8所示为在扣式电池中,Mg(CF3SO3)2/Butyl-DMImBF4+THF为电解液,以0.1 mA充放电达到稳定循环后,在Cu基质上用恒电流沉积48 h的沉积物的XRD测试结果。由图8可以看到,除了基质Cu的衍射峰之外,在2θ=36.6°出现的峰为金属Mg的特征峰(JCPDS 04-0770), 在2θ=42.6°出现的峰为金属MgCu2的特征峰(JCPDS 77-1178)。
图9所示为在Mg(CF3SO3)2/Butyl-DMImBF4+THF溶液中,在 Cu基质(见图 9(a)和(b))和 Ag基质(见图9(c)和(d))上沉积的Mg的SEM像。由图9可以看出,所沉积的Mg的形貌与基质材料有关。在Cu基质上沉积的Mg粒径较小,沉积层较为疏松,而在Ag基质上沉积的Mg粒径较大,且沉积层较为致密。
2.4 Mg(CF3SO3)2/Butyl-DMImTFSI体系
图 10所示为 Butyl-DMimTFSI离子液体、0.3 mol/L的Mg(CF3SO3)2/Butyl-DMimTFSI和0.3 mol/L的 Mg(CF3SO3)2/Butyl-DMimTFSI+THF (Butyl-DMimTFSI 与THF的体积比为3:1)溶液中Pt盘电极上的循环伏安图。由图10可以看出,将咪唑类离子液体的阴离子从换成THFI-,可提高阴离子的氧化稳定性,离子液体的阳极氧化分解电位可达到 3.1 V(vs Mg RE)。但加入镁盐后的Mg2+还原、氧化信息不强,再加入一定量的THF,可大大提高Mg2+还原、氧化峰电流。镁在其中沉积-溶出的循环可逆性需要进一步研究。

图8 Mg(CF3SO3)2/Butyl-DMImBF4+THF溶液中以0.1 mA电流在铜基质上沉积48 h后沉积物的XRD谱Fig. 8 XRD pattern of deposits on copper substrate deposited at 0.1 mA for 48 h in Mg(CF3SO3)2/Butyl-DMImBF4+THF solution

图9 在Mg(CF3SO3)2/Butyl-DMImBF4+THF溶液中以0.1 mA电流在Cu和Ag基质上沉积48 h后沉积物的SEM像Fig. 9 SEM images of deposits on copper ((a), (b)) and silver ((c), (d)) substrates deposited at 0.1 mA for 48 h in Mg(CF3SO3)2/Butyl-DMImBF4+THF solution
3 结论
1) 在咪唑阳离子基团中增加 1-位碳上烷基链的长度和在2-位碳上引入甲基,可以提高咪唑阳离子的还原稳定性,其中1-丁基-3-甲基咪唑的还原分解电位(-0.5 V vs Mg RE)在Mg2+沉积电位之外,可以作为Mg2+沉积-溶出的电解液。
2) 在咪唑阳离子基团 2-位上引入甲基,可以进一步拓宽电解液还原电位窗口到-1 V (vs Mg RE),同时采用 TFSI-阴离子,可使电解液阳极氧化电位拓宽到3.1 V (vs Mg RE)以上,满足作为可充镁电池电解液的条件。
3) 适量添加有机溶剂 THF可增加 Mg2+的还原-氧化峰电流,降低峰电位差,提高 Mg2+沉积-溶出的可逆性。

图10 在 Butyl-DMimTFSI离子液体、0.3 mol/L 的Mg(CF3SO3)2/Butyl-DMimTFSI和 0.3 mol/L 的 Mg(CF3SO3)2/Butyl-DMimTFSI+THF(Butyl-DMimTFSI与 THF的体积比为3:1)溶液中Pt盘电极上的循环伏安图Fig. 10 Cyclic voltammograms of Pt disk electrode in Butyl-DMimTFSI, 0.3 mol/L Mg(CF3SO3)2/Butyl-DMimTFSI and 0.3 mol/L Mg(CF3SO3)2/Butyl-DMimTFSI+THF (volume ratio of 3:1 for Butyl-DMimTFSI to THF) solutions
REFERENCES
[1] ROGERS R D, SEDDON K R. Ionic liquids-solvents of the future? [J]. Science, 2003, 302: 792-793.
[2] GALIŃSKI M, LEWANDOWSKI A, STĘPNIAK I. Ionic liquids as electrolytes [J]. Electrochimica Acta 2006, 51:5567-5580.
[3] 田中华, 华 贲, 王键吉, 刘 琴. 室温离子液体物理化学性质研究进展 [J]. 化学通报: 网络版, 2004, 67: w009.
TIAN Zhong-hua, HUA Ben, WANG Jian-ji, LIU Qin. Recent advances in the physico-chemical properties study of room temperature ionic liquids [J]. Chemistry Online, 2004, 67: w009.
[4] 杨 立, 房少华. 离子液体电解质在锂二次电池中的应用研究(上)[J]. 电源技术, 2010, 34(2): 101-105.
YANG Li, FANG Shao-hua. Application of ionic liquid electrolytes to rechargeable lithium batteries (part one) [J].Chinese Journal of Power Sources, 2010, 34(2): 101-105.
[5] 田国才, 李 坚, 华一新. 离子液体在有色金属冶金中的应用[J]. 过程工程学报, 2009, 9(1): 200-208.
TIAN Guo-cai, LI Jian, HUA Yi-xin. Application of ionic liquids in metallurgy of nonferrous metals [J]. The Chinese Journal of Process Engineering, 2009, 9(1): 200-208.
[6] NAKAGAWA H, FUJINO Y, KOZONO S, KATAYAMA Y,NUKUDA T, SAKAEBE H, MATSUMOTO H, TATSUMI K.Application of nonflammable electrolyte with room temperature ionic liquids (RTILs) for lithium-ion cells [J]. J Power Sources.2007, 174: 1021-1026.
[7] 刘 伟, 仇卫华, 王 赛, 盛喜优. 离子液体在锂离子电池中应用[J]. 电池, 2007, 37(1): 67-69.
LIU Wei, QIU Wei-hua, WANG Sai, SHENG Xi-you.Application of ionic liquid in Li-ion battery [J]. Battery Bimonthly, 2007, 37(1): 67-69.
[8] 黄再波, 高德淑, 李朝晖, 蒋 晶, 刘爱虹. 离子液体用作锂二次电池电解液的研究进展[J]. 电源技术, 2006, 30(9):774-778.
HUANG Zai-bo, GAO De-shu, LI Zhao-hui, JIANG Jing, LIU Ai-hong. The development of liquid electrolytes based on ionic liquids in lithium rechargeable batteries [J]. Chinese Journal of Power Sources, 2006, 30(9): 774-778.
[9] 袁华堂, 焦丽芳, 曹建胜, 刘秀生, 赵 明, 王永梅. 离子液体在电池中的应用进展[J]. 电池, 2005, 35(2): 144-145.
YUAN Hua-tang, JIAO Li-fang, CAO Jian-sheng, LIU Xiu-sheng, ZHAO Ming, WANG Yong-mei. The development and application of ionic liquids in batteries [J]. Battery Bimonthly, 2005, 35(2): 144-145.
[10] AURBACH D, LU Z, SCHECHTER A, GOFER Y, GIZBAR H,TURGEMANN R, COHEN Y, MOSHKOVICH M, LEVI E.Prototype systems for rechargeable magnesium batteries [J].Nature, 2000, 407(12): 724-727.
[11] 袁华堂, 刘秀生, 曹建胜, 焦丽芳, 赵 明, 王永梅. 可充镁电池有机电解液的研究进展 [J]. 电池, 2004, 34(2): 138-140.
YUAN Hua-tang, LIU Xiu-sheng, CAO Jiao-sheng, JIAO Li-fang, WNAG Yong-mei. The development of organic electrolyte for rechargeable magnesium battery [J]. Battery Bimonthly, 2004, 34(2): 138-140.
[12] 赵青松, 努丽燕娜, 郭永胜, 杨 军, 王久林. 可充镁电池电解液 [J]. 化学进展, 2011, 23(8): 1598-1610.
ZHAO Qing-song, NULI Yan-na, GUO Yong-sheng, YANG Jun,WANG Jiu-lin. Electrolytes for rechargeable magnesium batteries [J]. Progress in Chemistry, 2011, 23(8): 1598-1610.
[13] NULI Y N, YANG J, WU R. Reversible deposition and dissolution of magnesium from BMIMBF4ionic liquid [J].Electrochemistry Communications, 2005, 7: 1110-1115.
[14] NULI Y N, YANG J, WANG J L, XU J Q, WANG P.Electrochemical magnesium deposition and dissolution with high efficiency in ionic liquid [J]. Electrochemical and Solid-State Letters, 2005, 8(11): C166-C169.
[15] NULI Y N, YANG J, WANG P. Electrodeposition of magnesium film from BMIMBF4ionic liquid [J]. Applied Surface Science,2006, 252(23): 8086-8090.
[16] WANG P, NULI Y N, YANG J, FENG Z Z. Mixed ionic liquids as electrolyte for reversible deposition and dissolution of magnesium [J]. Surface & Coatings Technology, 2006, 201:3783-3787.
[17] 努丽燕娜, 杜国栋, 冯真真, 沈佳妮, 杨 军. 碳酸乙烯酯添加剂对BMImBF4离子液体作为镁沉积-溶解电解液的改性研究 [J]. 化学学报, 2008, 66(2): 175-180.
NULI Yan-na, DU Guo-dong, FENG Zhen-zhen, SHEN Jia-ni,YANG Jun. Study on modification of BMImBF4ionic liquid as the electrolyte of magnesium deposition-dissolution with ethylene carbonate additive [J]. Acta Chimica Sinica, 2008,66(2): 175-180.
[18] 努丽燕娜, 杨 军, 高鹏飞, 李 云, 王久林. 隔膜对BMImBF4离子液体电解液中镁沉积-溶出性能的影响 [J]. 化学学报, 2010, 68(10): 948-954.
NULI Yan-na, YANG Jun, GAO Peng-fei, LI Yun, WANG Jiu-lin. Effect of separators on BMImBF4ionic liquid as the electrolyte of magnesium deposition-dissolution [J]. Acta Chimica Sinica, 2010, 68(10): 948-954.
[19] CHAGNES A, DIAW M, CARRÉ B, WILLMANN P,LEMORDANT D. Imidazolium-organic solvent mixtures as electrolytes for lithium batteries [J]. Journal of Power Sources,2005, 145: 82-88.
[20] SEKI S, OHNO Y, KOBAYASHI Y, MIYASHIRO H, USAMI A,MITA Y, TOKUDA H, WATANABE M, HAYAMIZU K,TSUZUKI S, HATTORI M, TERADA N. Imidazolium-based room-temperature ionic liquid for lithium secondary batteries [J].Journal of the Electrochemical Society, 2007, 154(3):A173-A177.
[21] 蔡 燕, 李在均, 张海朗, 范 旭, 张锁江. 五种1-烷基-2, 3二甲基咪唑型离子液体的合成及作为Li/LiFePO4电池电解液的研究 [J]. 化学学报, 2010, 68(10): 1017-1022.
CAI Yan, LI Zai-jun, ZHANG Hai-lang, FAN Xu, ZHANG Suo-jiang. Study on the synthesis of five 1,2-dimethylimidazolium type of ionic liquids and their application to Li/LiFePO4battery as electrolytes [J]. Acta Chimica Sinica, 2010, 68(10): 1017-1022.
Deposition-dissolution properties of magnesium in imidazolium-based ionic liquids
NASIMAN Tuerxun, NULI Yan-na, ZHAO Qing-song, YANG Jun, WANG Jiu-lin
(School of Chemistry and Chemical Technology, Shanghai Jiaotong University, Shanghai 200240)
The deposition-dissolution performance of magnesium in four imidazolium-based ionic liquids, 1-ethyl-3-methylimidazolium tetrafluoroborate, 1-butyl-3-methylimidazolium tetrafluoroborate, 1-butyl-2,3-dimethylimidazolium tetrafluoroborate, 1-butyl-2,3-dimethylimidazolium bis((trifluoromethyl)sulfonyl)imide containing Mg(CF3SO3)2used as the electrolytes was studied by cyclic voltammogramms and constant current discharge-charge techniques. X-ray diffraction and scanning electron microscope measurements were conducted to characterize the components and morphologies of deposits. The results show that the cathodic satiability of imidazolium cations can be improved by increasing the length of alkyls at the first position and introducing methyl group at the second position of the imidazolium cations, and the cathodic limit of the electrolytes can be widen to -1 V (vs Mg RE). The anodic limit of the electrolyte with TFSI-anion can reach to 3.1 V (vs Mg RE). After adding appreciate amount of THF organic solvent, the peak currents and reversibility of Mg2+reduction-oxidation can be improved.
ionic liquids; magnesium; deposition-dissolution; reversibility
TM912.9
A
1004-0609(2012)09-2648-08
国家自然科学基金资助项目(20603022, 20973112)
2011-09-09;
2012-03-31
努丽燕娜,副教授,博士;电话:021-54745887;传真:021-54741297;E-mail: nlyn@sjtu.edu.cn
(编辑 何学锋)
