产灵菌红素菌株的分离鉴定
2012-11-22朱雄伟翟莉莉张楠苏腾甲
朱雄伟,翟莉莉,张楠,苏腾甲
(武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北 武汉 430074)
灵菌红素(prodigiosins,PG)是一类天然红色素的总称,是一些放线菌、沙雷菌及其他细菌的代谢产物.研究发现,灵菌红素具有抗细菌、抗真菌、抗疟疾、免疫抑制和抗肿瘤等生物活性,因此受到人们的广泛关注[1].长期以来,灵菌红素的研究主要侧重于其化学合成途径的探索及其潜在的临床应用,而对灵菌红素的生产研究较少.随着生物操作技术的发展和对灵菌红素的深入研究,人们将更加清晰地认识灵菌红素的产生和作用机制,大量生产制备灵菌红素,用于替代在癌症及免疫治疗中对人体有害作用的化学药物,造福于人类[2-3].本研究从糖化车间分离一种菌株,对其代谢产物进行分析,发现菌株可产灵菌红素,并对菌株形态和菌落特征、生理生化特性、全细胞脂肪酸组分进行研究,并通过测定其16S rRNA基因序列的方法来鉴定此菌株[4].
1 材料与方法
1.1 材料
1.1.1 样品 由湖北省黄石市兴华生化有限公司糖化车间提供.
1.1.2 试剂与仪器 琼脂糖;溴化乙锭;上样缓冲液;AE电泳缓冲液;特异引物;PCR Buffer;dNTPmix;Taq酶;AxyPrep 基因组DNA提取试剂盒;AxyPrep DNA 凝胶回收试剂盒;牛肉膏;蛋白胨;柠檬酸三钠;NaCl;琼脂粉;可溶性淀粉;CaCl2;PCR仪;电泳仪;电热恒温鼓风干燥箱;高压蒸汽灭菌锅;恒温培养箱;高速离心机;智能傅立叶红外光谱仪Nexus470 FT-IR;美国MIDI的全自动鉴定系统.
1.1.3 培养基 优化培养基:蛋白胨质量分数10%,牛肉膏质量分数5%, 琼脂质量分数 2%(固), CaCl2质量分数0.156%,调pH至5.0~6.5;基础培养基:葡萄糖质量分数2%,NaCl质量分数0.5%,琼脂质量分数 2%(固).
1.2 方法
1.2.1 筛选方法
(1)初筛培养.制备初筛菌悬液:称取土壤样品1 g.接种于高压灭菌的基础培养基中,30~37 ℃连续培养30 d进行富集,得初筛菌悬液;取初筛菌悬液20 μL涂布于固体基础培养基;在初筛平板上挑取不同形态的单菌落在液体优化培养基中扩大培养,并进一步进行涂布分离,经多次纯化、分离,最后得到不同菌落形态的纯平板;挑取纯平板的单菌落于基础培养基中,30 ℃恒温培养过夜,得分离菌悬液[5].
(2)复筛培养.制备复筛菌悬液,在一定浓度氯化铵基础培养基内,加入初筛分离菌的分离菌悬液50 μL,30 ℃恒温振摇5~7 d,得复筛菌悬液;取复筛菌悬液20 μL涂于固体优化培养基,30 ℃恒温培养1~2 d,观察并记录细菌生长情况以及菌落形态;然后挑取单菌落在优化培养基中逐级加入一定梯次浓度的柠檬酸三钠,分离得到纯的此菌株.
1.2.2 代谢产物红色素的提取与分离[6-7]发酵液离心后得到的菌体经过酸性甲醇萃取,萃取液经浓缩去溶剂,用乙酸乙酯溶解,低温静置,沉淀后得到的混合物用硅胶柱层析(氯仿和乙酸乙酯洗脱),最后去溶剂得到红色素粗产品,再利用薄层色谱和柱色谱法对其进行再分,得到红色素纯品.
1.2.3 代谢产物红色素红外分析[8-9]物质红外光谱的波长位置与吸收谱带的强度,反映了其分子结构的特点,结构不同的化合物具有不同的振动吸收频率,由此可鉴定未知物的结构组成、确定其化学基团.红外条件:采用液膜法, 红外光谱能量为 40 mW; 波数范围为 400~4 000 cm- 1.
1.2.4 菌株全细胞脂肪酸组分分析 采用美国MIDI的全自动鉴定系统.
1.2.5 菌株鉴定
(1)提取细菌核DNA(AxyPrep 基因组DNA提取试剂盒).
(2)16S rDNA基因的PCR扩增:PCR扩增引物参照Weisburg等人的方法合成:
P1:正向引物5’AGAGTTTGATCCTGGCTCAG3’.
P2:反向引物5’GGTTACCTTGTTACGACTT3’.
(3)PCR产物的凝胶电泳:将PCR产物以1%琼脂糖凝胶进行电泳.
(4)PCR产物凝胶回收(DNA 凝胶回收试剂盒).
(5)16S rDNA 测序:PCR测序用正反向引物参照Hiraishi等人方法合成.加入1μL模板DNA (<0.1μg),PCR扩增30个循环(94 ℃ 1 min,55 ℃ 30 s,72 ℃ 2 min).采用ABI PRI优化测序试剂盒中染料终止剂终止反应.然后,在Applied Biosystem 373 A DNA 测序仪上测序.测得的16SrDNA序列采用BLAST软件与GenBank 数据库比较分析,最终从分子水平上确定该菌的种属.
2 结果与分析
2.1菌株菌落形态图1所示的是产灵菌红素菌株的菌落形态,菌落呈红色、不透明、表面光滑、球状凸起、粘稠状,红色菌落周围是乳白色的菌株.
2.2红色素红外光谱分析图2所示的是红色素的红外光谱图,红色素的红外光谱的主要吸收峰的波数分别为:3 400、2 981、2 843、1 657、1 241、1 032、713 cm-1.

图1 菌株菌落形态
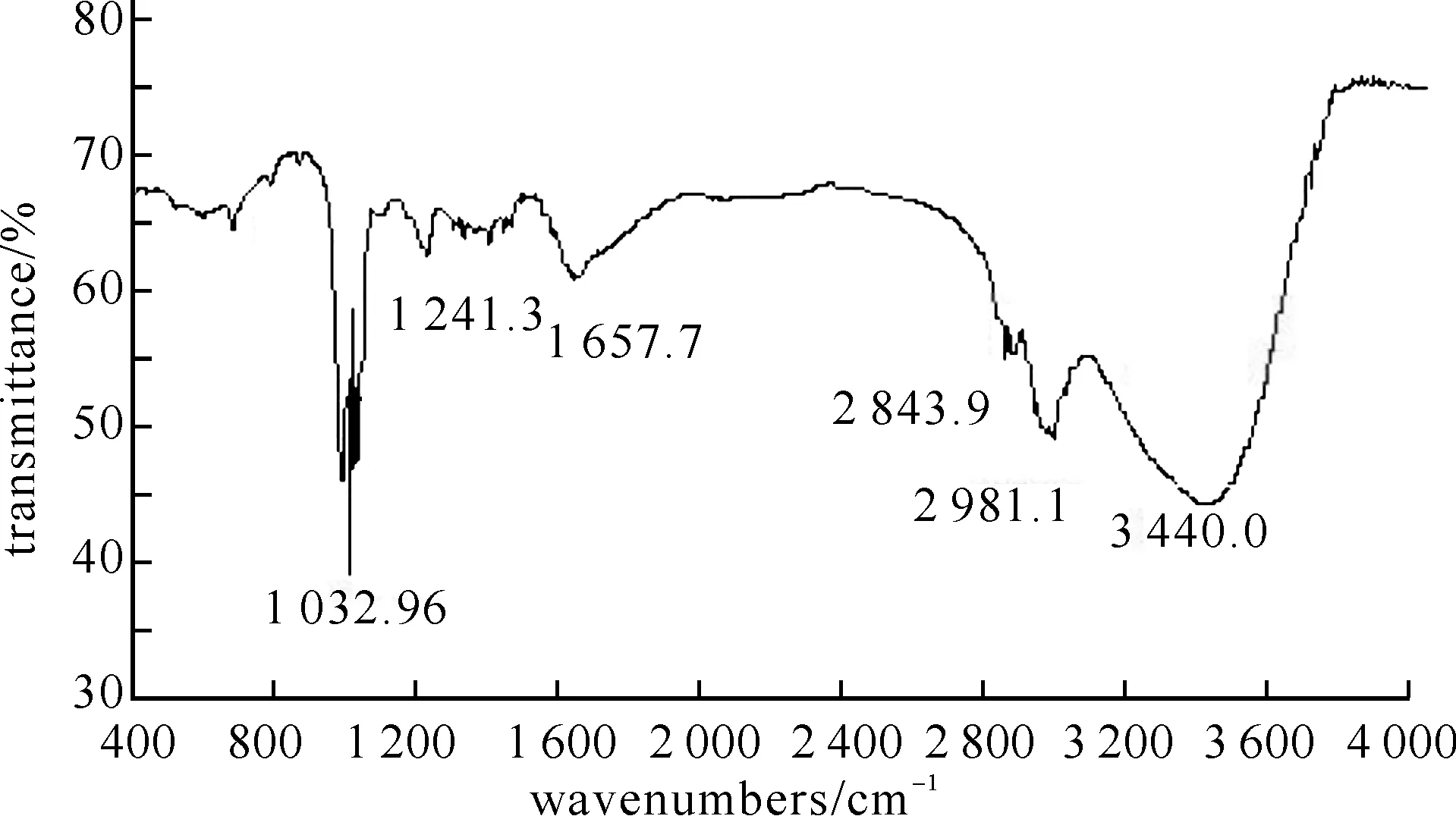
图2 红色素的红外光谱图


图3 菌株脂肪酸组成和含量色谱图
2.3全细胞脂肪酸组分分析图3所示的是菌株ZSG脂肪酸组成和含量色谱图[12].如图3可知:经MIS微生物系统分析,主要脂肪酸种类和含量为:14∶0 iso 3OH(5.63%),17∶0 cyclo(14.55%)14∶0 3OH/16∶1 iso I(8.46%),18∶1 w7c(12.44%),符合粘质沙雷氏菌的特征.
2.4菌株生理生化特性菌株生理生化特性如表1所示.
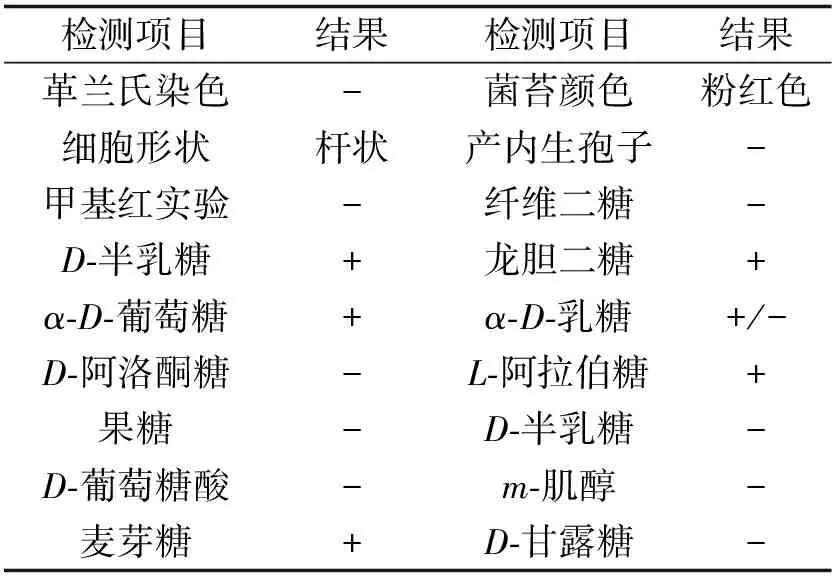
表1 菌株生理生化特性
2.516SrDNA序列测定及BLAST结果以细菌的核DNA为模板,以16S rRNA基因的PCR扩增的通用引物为引物,进行PCR扩增,得到长度为1 484 bp的扩增带(用1%琼脂糖凝胶电泳检测),PCR产物经纯化后,测定其全序列.
BLAST结果所示:gb|FJ360759.1|Serratiamarcescensstrain PSB19 16S ribosomal RNA gene, partial sequence Length=1 457 Score = 2 534 bits (1372), Expect = 0.0 Identities = 1 422/1 453 (97%), Gaps = 12/1453 (0%),Strand=Plus/Plus.根据16S rRNA基因测序BLAST结果,推断此菌株为粘质沙雷氏菌Serratiamarcescens.
3 结论
本研究从糖化车间分离得到一种产红色素菌株,该红色素经过红外光谱分析被证明为灵菌红素[13-14].通过测定菌株16S rRNA基因序列,并对其生理生化特征进行测定.通过对其16S rRNA基因序列和全细胞脂肪酸组分分析,均表明该菌株为粘质沙雷氏菌.
致谢感谢湖北省黄石市兴华生化有限公司对本研究的大力支持.
[1] 刘同军,杨海龙.灵菌红素的研究进展[J].食品与药品,2007,9(8):47-51.
[2] 刘萍,李静.灵菌红素体外对肿瘤转移相关生物学行为的影响[J].中国药理学通报,2010,26(4):501-505.
[3] Kan C, Nalaka S R, Yang C.Unusual odd-electron fragments from even-electron protonated prodiginine precursors using positive-ion electrospray tandem mass spectrometry[J].Journal of the American Society for Mass Spectrometry,2008,19:1856-1866.
[4] Sigal N H, Dumont F J.CyclosporinA and FK506:molecular mechanisms of immunosuppression and probes for transplantation biology,1993,5(5):763-773.
[5] 刘晓侠,唐威.一株新粘质沙雷氏菌所产红色素的结构鉴定及稳定性研究[J].安徽农业大学学报,2010,37( 3):488-492.
[6] 郝名慧,楼志华.一株新粘质沙雷氏菌发酵产红色素及其结构的研究[J].天然产物研究与开发,2007,19(3):439-442.
[7] Nabil M W,George P C.The stationary phase sigma factor, RpoS, regulates the production of a carbapenem antibiotic, a bioactive prodigiosin and virulence in the enterobacterial pathogenSerratiasp.ATCC 39006[J].Microbiology,2012,158(3):648-658.
[8] Patrick D S, Heather K A, Amy K.Psychrotrophic strain ofJanthinobacteriumlividumfrom a cold Alaskan soil produces prodigiosin[J].DNA and Cell Biology,2010,29(9):533-541.
[9] Suresh R C, Neil R W, Thabo M.Characterisation of PigC and HapC, the prodigiosin synthetases fromSerratiasp.andHahellachejuensiswith potential for biocatalytic production of anticancer agents[J].Chemical Science,2012(3):447-454.
[10] Espona-Fiedlera M, Soto-Cerratoa V, Hosseinib A.Identification of dual mTORC1 and mTORC2 inhibitors in melanoma cells:prodigiosin vs.obatoclax[J].Biochemical Pharmacology,2012,83(4):489-496.
[11] Isaka M, Jaturapat A, Kramyu J.Potent in vitro antimalarial activity of metacyclo- prodigiosin isolated fromStreptomycesspectabilisBCC 4785[J].Antimicrob Agents Chemother,2002,46:1112-1113.
[12] Poulter S, Carlton T M, Su X B.Engineering of new prodigiosin-based biosensors ofSerratiafor facile detection of short-chain N-acyl homoserine lactone quorum-sensing molecules[J].Environmental Microbiology Reports,2010(2):322-328.
[13] Someya N, Nakajim M, Watanabe K.Influence of bacteria isolated from rice plants and rhizospheres on antibiotic production by the antagonistic bacteriumSerratiamarcescensstrain B2 [J].Journal of general plant pathol,2003,69:342-347.
[14] Chawrai S R,Williamson N R, Mahendiran T, et al.Characterisation of PigC and HapC, the prodigiosin synthetases fromSerratiasp.andHahellachejuensiswith potential for biocatalytic production of anticancer agents [J].Chemical Science,2012(3):447-454.
